- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB 12417-1990 外科金属植入物 通用技术条件
标准号:
GB 12417-1990
标准名称:
外科金属植入物 通用技术条件
标准类别:
国家标准(GB)
标准状态:
已作废-
发布日期:
1990-07-17 -
实施日期:
1991-02-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
150.96 KB
标准ICS号:
医药卫生技术>>医疗设备>>11.040.40外科植入物、假体和矫形中标分类号:
医药、卫生、劳动保护>>医疗器械>>C35矫形外科、骨科器械
替代情况:
部分被YY 0341-2002代替;部分被GB/T 12417.1~12417.2-2008代替采标情况:
≈ASTM F601-86,F629-86,ISO 5832,ISO 6018-87
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
部分被YY 0341-2002代替 GB 12417-1990 外科金属植入物 通用技术条件 GB12417-1990
部分标准内容:
中华人民共和国国家标准
外科金属植入物通用技术条件
The general technological conditions ofsurgical metal implant
GB 12417 -~ 90
本标准参照采用[国际标准ISO5832《外科植人物一金属材料》第:部分:锻造不锈钢(1987年)、第部分:钛(1978年)、第二部分:钛、6铝、4钒可锻合金(1978年)、第四部分:钻-饹销铸合金(1978年)。标记、包装部分等效采用国际标准1SO6018--1987《骨科植人物印记、包装和标签的·-般规定》。
1主题内容与适用范围
本标准规定了外科金属植人物的技术要求、试验方法、捡验规则、标记、包装和使用要求等内容。本标准适用于外科金属植人物。2引用标准
ZBJ04 004射线照相探伤方法
ZBJ04005渗透探伤方法
Z.BC35005接骨板、接骨螺钉耐腐蚀性能试验方法3技术要求
3.1外科金属植人物应选用超低碳不锈钢、纯钛、钛合金、钴基合金四个种类的金属材料。3.1.1四个种类材料的化学成分应符合附录A(补充件)的规定。3.1.2四叫个种类材料的力学性能、显微组织、耐腐蚀性能应符合相应的产品标准。3.2外科金属植人物产品表面不应有微裂纹。3.3铸造合金产品高应力部位不应有疏松、裂纹、夹杂物等缺陷。3.4不锈钢类产品应进行钝化处理,具有良好的耐腐蚀性能,经腐蚀试验后产品表面不应有锈蚀。4试验方法此内容来自标准下载网
4.1表面微裂纹检验:按ZBJ04005中的FC-S或VC-S两种探伤方法的要求,应符合第3.2条的规定。
FCS荧光渗透探伤方法采用HB-1型探伤剂。VC-S着色渗透探伤方法采用SM-3R型探伤剂。4.1.外科金属植人物产品表面无损探伤以荧光渗透探伤方法为仲裁依据。4.2内部质量检验:按ZBJ04004的要求,应进行X射线内探伤,射线照相质量采用B级要求,应符合第3.3条的规定。
4.3耐腐蚀性能检验:按ZBC35005的要求,应符合第3.4条的规定。5检验规则
5.1外科金属植人物应符合本标准的规定,由制造厂检验部门进行检验,合格后方可提交验收。5.23.2、3.3、3.4条进行百分之百的检验,且应百分之百合格。国家技术监督局1990-07-17批准172
宽费光
1991-02-01实施
GB 12417-- 90
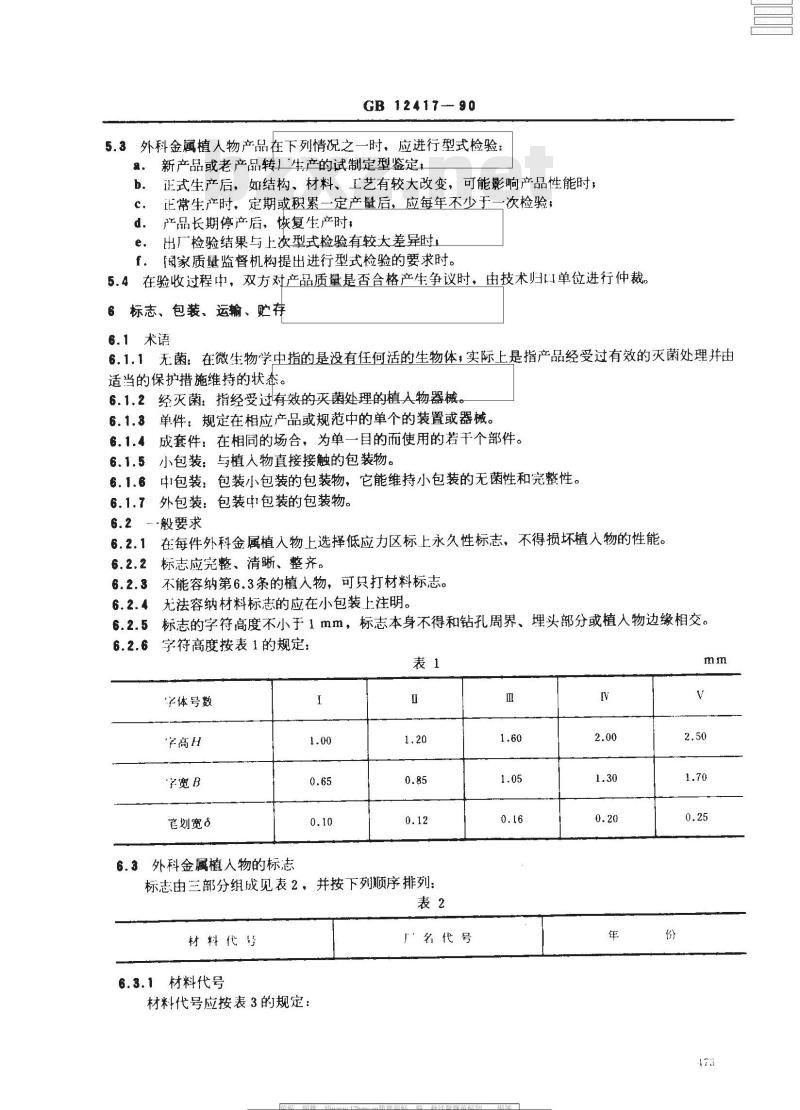
5.3外科金属植人物产品在下列情况之一时,应进行型式检验:a.
新产品或老产品转厂广生产的试制定型鉴定,正式生产后,如结构、材料、工艺有较大改变,可能影响产品性能时,b.
正常生产时,定期或积累一定产量后,应每年不少于一次检验;c.
产品长期停产后,恢复生产时,d.
出厂检验结果与上次型式检验有较大差异时,e.
f.[家质量监督机构提出进行型式检验的要求时。5.4在验收过程中,双方对产品质量是否合格产生争议时,由技术归叫单位进行仲裁。6标志、包装、运输、贮存
6.1术语
6.1.1无菌:在微生物学中指的是没有任何活的生物体,实际上是指产品经受过有效的灭菌处理并由适当的保护措施维持的状态。
6.1.2经灭菌:指经受过有效的灭菌处理的植人物器械6.1.3单件:规定在相应产品或规范中的单个的装置或器械。6.1.4成套件:在相同的场合,为单一目的而使用的若干个部件。6.1.5小包装:与植人物直接接触的包装物。6.1.6中包装:包装小包装的包装物,它能维持小包装的无菌性和完整性。6.1.7
外包装:包装中包装的包装物。6.2-般要求
6.2.1在每件外科金属植人物上选择低应力区标上永久性标志,不得损坏植人物的性能。6.2.2
标志应宪整、清晰、整齐。
不能容纳第6.3条的植物,可只打材料标志。无法容纳材料标志的应在小包装上注明。标志的字符高度不小于1mm,标志本身不得和钻孔周界、埋头部分或植人物边缘相交。字符高度按表1的规定:
字体号数
学高H
字宽B
笔划宽8
6.3外科金属植人物的标志
标志由三部分组成见表2,并按下列顺序排列:表2
材料代号
6.3.1材料代号
材料代号应按表3的规定:
广名代号
6.3.2」名代号
不锈钢
钛合金
钻基合金
GB 12417 90
6.3.2.1广名代号采用两个大写拉了学过。6.3.2.2打印时!名代号或商标任选一-种。6.3.3年份
用公年号最后两位阿拉伯数字表示。产品标志示例:
厂名代号
材料代号
6.4外科金属植人物的包装
6.4.1每:-植人物供货时必须洁净,并且装在密封的中性塑料袋内。重要部位和所有尖端或锐边须用包装材料妥善保护。
6.4.2格两个或更多的间-规格或成套件植人物,包装在同袋内,须用合适的材料将每·一植入物与其他植人物隔开。
注:对装后的植人物可以以火阐状态供货,在此情况下,必须按6.5.1条规定,也可以以不菌状态供货。6.4.3外包装必须在运输和贮存时保护其包装物。6.4.4每个小包装应易于用手开启。灭菌产品应保持无菌,并随时可用,中包装一-旦开启就不能重封,如果中包装能重封,则必须使人清楚地看出中包装曾被开启过,并且已作了重封。6.4.5小包装里应附使用说明书和检验合格证,合格证上应有\下列内容:理。制造广“名称;
b.检验员代号:
检验日期。
外科金属植人物的标签
标签应有下列内容:
制造名称、地址、商标,
材料标志,
产品名称、型号
规格、数量;
产品标准号:
植人物如经公认的方法灭菌处理。应注“灭菌除非包装破损”字样或相应的首训以及所用灭奇克市卖
GB12417—90
菌方法的标志,必须出现在被包装物的标签上。6.5.2同一规格或成套件植人物应装人同一盒内,盒上标志同6.5.1条。6.5.8盒上应有封签,封签上应有下列内容:8.封贴日期,
b.包装员代号。
6.6外包装和运输要求按许货合同规定。6.7包装后的植人物应贮存在相对湿度不大于80%、无腐蚀性气体和通风良好的室内。7使用要求
7.1产品在使用前必须确认其材料成分,无标志或标签的产品不能使用。7.2不同牌号的不锈钢植人物产品,不得配伍使用,且不得与其他材料的植人物配伍使用。7.3外科植人物产品不允许二次使用。注:在使用说明书中应写人使用要求。175
GB 12417-90
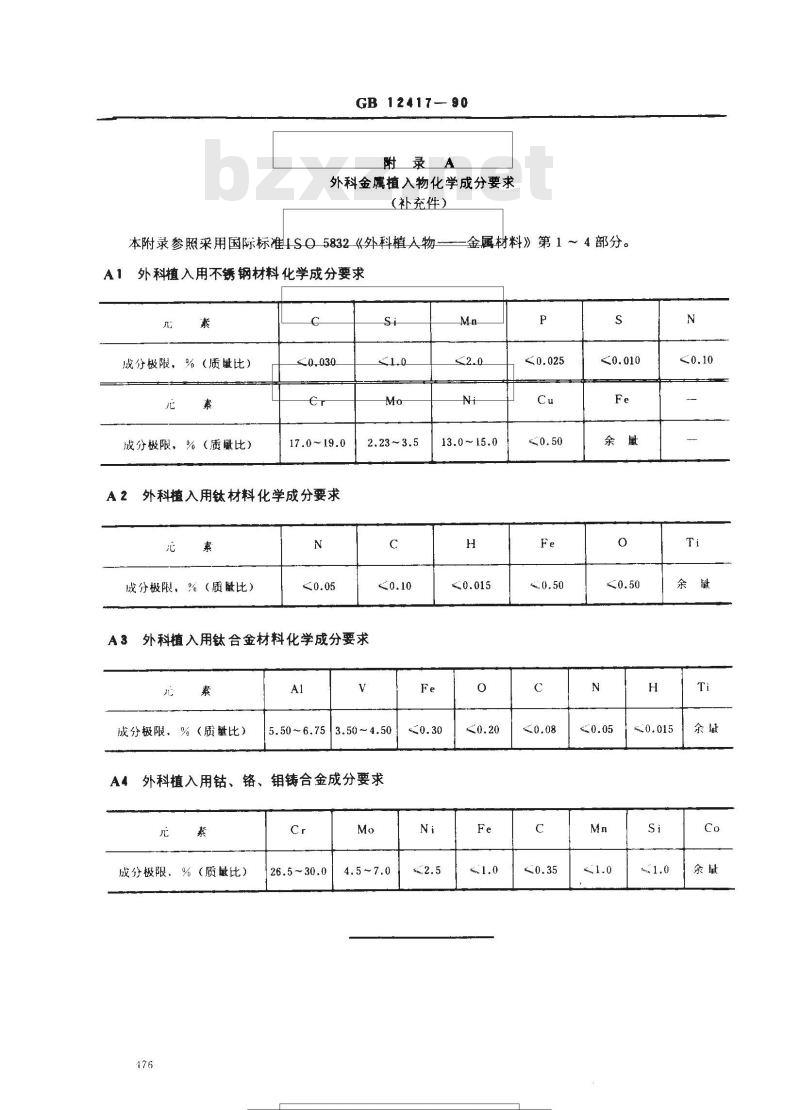
附录A
外科金属植入物化学成分要求
(补充件)
本附录参照采用国际标准ISO5832《外科植人物A1外科植入用不锈钢材料化学成分要求素
成分极限,%(质量比)
成分极限,%(质比)
17.0~19.0
外科植入用钛材料化学成分要求A2
成分极限,%(质比)
A3外科植入用钛合金材料化学成分要求素
成分极限、%(质量比)
5.50~6.753.50~4.50
钼铸合金成分要求
外科植入用钴、铬、
成分极限、%(质量比)
26.5~30.0
下装装
金属材料》第1~4部分。
13.0~15.0
附加说明:
GB12417—90
本标准由国家医药管理局提出。本标准由全国外科植人物和矫形器械标准化技术委员会归口。本标准由天津医疗器械研究所负责起草。本标准主要起草人王圣荣、周玉华。本标准参考采用美国AS TM标准:F601-86《金属外科移植物的荧光渗透剂检查的规程》。F629一86《铸造金属外科移植物的X射线照相图的规程》。177
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
外科金属植入物通用技术条件
The general technological conditions ofsurgical metal implant
GB 12417 -~ 90
本标准参照采用[国际标准ISO5832《外科植人物一金属材料》第:部分:锻造不锈钢(1987年)、第部分:钛(1978年)、第二部分:钛、6铝、4钒可锻合金(1978年)、第四部分:钻-饹销铸合金(1978年)。标记、包装部分等效采用国际标准1SO6018--1987《骨科植人物印记、包装和标签的·-般规定》。
1主题内容与适用范围
本标准规定了外科金属植人物的技术要求、试验方法、捡验规则、标记、包装和使用要求等内容。本标准适用于外科金属植人物。2引用标准
ZBJ04 004射线照相探伤方法
ZBJ04005渗透探伤方法
Z.BC35005接骨板、接骨螺钉耐腐蚀性能试验方法3技术要求
3.1外科金属植人物应选用超低碳不锈钢、纯钛、钛合金、钴基合金四个种类的金属材料。3.1.1四个种类材料的化学成分应符合附录A(补充件)的规定。3.1.2四叫个种类材料的力学性能、显微组织、耐腐蚀性能应符合相应的产品标准。3.2外科金属植人物产品表面不应有微裂纹。3.3铸造合金产品高应力部位不应有疏松、裂纹、夹杂物等缺陷。3.4不锈钢类产品应进行钝化处理,具有良好的耐腐蚀性能,经腐蚀试验后产品表面不应有锈蚀。4试验方法此内容来自标准下载网
4.1表面微裂纹检验:按ZBJ04005中的FC-S或VC-S两种探伤方法的要求,应符合第3.2条的规定。
FCS荧光渗透探伤方法采用HB-1型探伤剂。VC-S着色渗透探伤方法采用SM-3R型探伤剂。4.1.外科金属植人物产品表面无损探伤以荧光渗透探伤方法为仲裁依据。4.2内部质量检验:按ZBJ04004的要求,应进行X射线内探伤,射线照相质量采用B级要求,应符合第3.3条的规定。
4.3耐腐蚀性能检验:按ZBC35005的要求,应符合第3.4条的规定。5检验规则
5.1外科金属植人物应符合本标准的规定,由制造厂检验部门进行检验,合格后方可提交验收。5.23.2、3.3、3.4条进行百分之百的检验,且应百分之百合格。国家技术监督局1990-07-17批准172
宽费光
1991-02-01实施
GB 12417-- 90
5.3外科金属植人物产品在下列情况之一时,应进行型式检验:a.
新产品或老产品转厂广生产的试制定型鉴定,正式生产后,如结构、材料、工艺有较大改变,可能影响产品性能时,b.
正常生产时,定期或积累一定产量后,应每年不少于一次检验;c.
产品长期停产后,恢复生产时,d.
出厂检验结果与上次型式检验有较大差异时,e.
f.[家质量监督机构提出进行型式检验的要求时。5.4在验收过程中,双方对产品质量是否合格产生争议时,由技术归叫单位进行仲裁。6标志、包装、运输、贮存
6.1术语
6.1.1无菌:在微生物学中指的是没有任何活的生物体,实际上是指产品经受过有效的灭菌处理并由适当的保护措施维持的状态。
6.1.2经灭菌:指经受过有效的灭菌处理的植人物器械6.1.3单件:规定在相应产品或规范中的单个的装置或器械。6.1.4成套件:在相同的场合,为单一目的而使用的若干个部件。6.1.5小包装:与植人物直接接触的包装物。6.1.6中包装:包装小包装的包装物,它能维持小包装的无菌性和完整性。6.1.7
外包装:包装中包装的包装物。6.2-般要求
6.2.1在每件外科金属植人物上选择低应力区标上永久性标志,不得损坏植人物的性能。6.2.2
标志应宪整、清晰、整齐。
不能容纳第6.3条的植物,可只打材料标志。无法容纳材料标志的应在小包装上注明。标志的字符高度不小于1mm,标志本身不得和钻孔周界、埋头部分或植人物边缘相交。字符高度按表1的规定:
字体号数
学高H
字宽B
笔划宽8
6.3外科金属植人物的标志
标志由三部分组成见表2,并按下列顺序排列:表2
材料代号
6.3.1材料代号
材料代号应按表3的规定:
广名代号
6.3.2」名代号
不锈钢
钛合金
钻基合金
GB 12417 90
6.3.2.1广名代号采用两个大写拉了学过。6.3.2.2打印时!名代号或商标任选一-种。6.3.3年份
用公年号最后两位阿拉伯数字表示。产品标志示例:
厂名代号
材料代号
6.4外科金属植人物的包装
6.4.1每:-植人物供货时必须洁净,并且装在密封的中性塑料袋内。重要部位和所有尖端或锐边须用包装材料妥善保护。
6.4.2格两个或更多的间-规格或成套件植人物,包装在同袋内,须用合适的材料将每·一植入物与其他植人物隔开。
注:对装后的植人物可以以火阐状态供货,在此情况下,必须按6.5.1条规定,也可以以不菌状态供货。6.4.3外包装必须在运输和贮存时保护其包装物。6.4.4每个小包装应易于用手开启。灭菌产品应保持无菌,并随时可用,中包装一-旦开启就不能重封,如果中包装能重封,则必须使人清楚地看出中包装曾被开启过,并且已作了重封。6.4.5小包装里应附使用说明书和检验合格证,合格证上应有\下列内容:理。制造广“名称;
b.检验员代号:
检验日期。
外科金属植人物的标签
标签应有下列内容:
制造名称、地址、商标,
材料标志,
产品名称、型号
规格、数量;
产品标准号:
植人物如经公认的方法灭菌处理。应注“灭菌除非包装破损”字样或相应的首训以及所用灭奇克市卖
GB12417—90
菌方法的标志,必须出现在被包装物的标签上。6.5.2同一规格或成套件植人物应装人同一盒内,盒上标志同6.5.1条。6.5.8盒上应有封签,封签上应有下列内容:8.封贴日期,
b.包装员代号。
6.6外包装和运输要求按许货合同规定。6.7包装后的植人物应贮存在相对湿度不大于80%、无腐蚀性气体和通风良好的室内。7使用要求
7.1产品在使用前必须确认其材料成分,无标志或标签的产品不能使用。7.2不同牌号的不锈钢植人物产品,不得配伍使用,且不得与其他材料的植人物配伍使用。7.3外科植人物产品不允许二次使用。注:在使用说明书中应写人使用要求。175
GB 12417-90
附录A
外科金属植入物化学成分要求
(补充件)
本附录参照采用国际标准ISO5832《外科植人物A1外科植入用不锈钢材料化学成分要求素
成分极限,%(质量比)
成分极限,%(质比)
17.0~19.0
外科植入用钛材料化学成分要求A2
成分极限,%(质比)
A3外科植入用钛合金材料化学成分要求素
成分极限、%(质量比)
5.50~6.753.50~4.50
钼铸合金成分要求
外科植入用钴、铬、
成分极限、%(质量比)
26.5~30.0
下装装
金属材料》第1~4部分。
13.0~15.0
附加说明:
GB12417—90
本标准由国家医药管理局提出。本标准由全国外科植人物和矫形器械标准化技术委员会归口。本标准由天津医疗器械研究所负责起草。本标准主要起草人王圣荣、周玉华。本标准参考采用美国AS TM标准:F601-86《金属外科移植物的荧光渗透剂检查的规程》。F629一86《铸造金属外科移植物的X射线照相图的规程》。177
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 热门标准
- 国家标准(GB)
- GB/T12053-1989 光学识别用字母数字字符集 第一部分:OCR-A字符集印刷图象的形状和尺寸
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB/T23892.3-2009 滑动轴承 稳态条件下流体动压可倾瓦块止推轴承 第3部分:可倾瓦块止推轴承计算的许用值
- GB/T11839-1989 二氧化铀芯块中硼的测定 姜黄素萃取光度法
- GB/T6122.1-2002 圆角铣刀 第1部分:型式和尺寸
- GB50209-2002 建筑地面工程施工质量验收规范
- GB/T7433-1987 对称电缆载波通信系统抗无线电广播和通信干扰的指标
- GB/T21238-2007 玻璃纤维增强塑料夹砂管
- GB17945-2024 消防应急照明和疏散指示系统
- GB/T24974—2010 收费用手动栏杆
- GB/T9239-1988 刚性转子平衡品质 许用不平衡的确定
- GB/T15917.3-1995 金属镝及氧化镝化学分析方法 对氯苯基荧光酮--溴化十六烷基三甲基胺分光光度法测定钽量
- GB/T13985-1992 照相机操作力和强度
- GB17378.4-2007 海洋监测规范 第4部分:海水分析
- GB/T11813-2008 压水堆燃料棒氦质谱检漏
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2