- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0321.1-2000 一次性使用麻醉穿刺包
标准号:
YY 0321.1-2000
标准名称:
一次性使用麻醉穿刺包
标准类别:
医药行业标准(YY)
标准状态:
现行-
发布日期:
2000-09-06 -
实施日期:
2000-12-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
294.96 KB
中标分类号:
医药、卫生、劳动保护>>医疗器械>>C31一般与显微外科器械
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了一次性使用麻醉穿刺包的分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存。本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)、蛛网膜下腔阻滞(简称腰椎麻醉)、神经阻滞等各种麻醉方法进行穿刺、注射药物的一次性使用麻醉穿刺包。 YY 0321.1-2000 一次性使用麻醉穿刺包 YY0321.1-2000
部分标准内容:
备案号:8055—2001
中华人民共和国医药行业标准
.YY0321.1—2000
一次性使用麻醉穿刺包
Single-use puncture set for local anaesthesia2000-09-06发布
国家药品监督管理局发布
2000-12-01实施
YY0321.1—2000
一次性使用麻醉穿刺包由基本配置器械和其他配置器械、辅料组成。其主要技术指标生物和化学性能均参照有关国家标准或行业标准,并结合了临床使用要求制定,与其同时制定的标准有YY0321.2-2000《一次性使用麻醉用针》、YY0321.3—2000&一次性使用麻醉用过滤器》。
本标准的附录A、附录B都是标准的附录,附录C是提示的附录。本标准由国家药品监督管理局提出。本标准由全国医用注射器(针)标准化技术委员会归口。本标准起草单位:上海埃斯埃医械塑料制品有限公司、国家药品监督管理局上海医疗器械质量监督检验中心、北京伏尔特技术有限公司、江苏宁泰医疗设备厂。本标准主要起草人:曹贤明、张锦生、傅国宝、赵静、张培林。1范围
中华人民共和国医药行业标准
一次性使用麻醉穿刺包
Single-use puncture set for local anaesthesiaYY0321.1-2000
本标准规定了一次性使用麻醇穿刺包的分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存。
本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)、蛛网膜下腔阻滞(简称腰椎麻醉)、神经阻滞等各种麻醉方法进行穿刺、注射药物的一次性使用麻醉穿刺包(以下简称麻醉包)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191—2000包装储运图示标志
GB1962—1995注射器、注射针及其他医疗器械6:100圆锥接头GB2828—1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB9969.1—1998工业产品使用说明书总则GB/T14233.1—1998医用输液、输血注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993E
医用输液、输血注射器具检验方法第2部分:生物试验方法GB/T14436—1993工业产品保证文件总则YY/T0313—1998医用高分子制品包装、标志、运输和贮存YY0321.2—2000一次性使用麻醉用针YY0321.3—2000一次性使用麻醉用过滤器ISO594-2:1998注射器,注射针和其他医疗器械6%(替尔)圆锥接头第2部分:锁定接头ISO96261991制造医疗器械用不锈钢针管3分类与命名
3.1产品型号
3.1.1产品型号由产品名称代号和分类代号组成。3.1.2一次性使用麻醉穿刺包以AS表示,分类代号:硬膜外麻醉以E表示,腰椎麻醉以S表示;神经阻滞以N表示,硬膜外和腰椎联合麻醉以E/S表示。标记示例:硬膜外麻醉用的一次性使用麻酵穿刺包一次性使用麻醉穿刺包——硬膜外麻醇AS-EYY0321.1—20003.2麻醉包的基本配置按表1规定。国家药品监督管理局2000-09-06批准2000-12-01实施
YY0321.1—2000
表1麻醉包基本组成
配置器械名称
一次性使用麻醇用针
一次性使用麻醉用针
一次性使用麻醇用针
一次性使用麻醇用针
一硬膜外穿刺针
一腰椎穿刺针1型
腰椎穿刺针【型
神经阻灌穿刺针
一次性使用麻醉用过滤器
一次性使用麻醇用过滤器
药液过滤器
空气过滤器
硬膜外麻薪导管(以下简称导管)导管接头
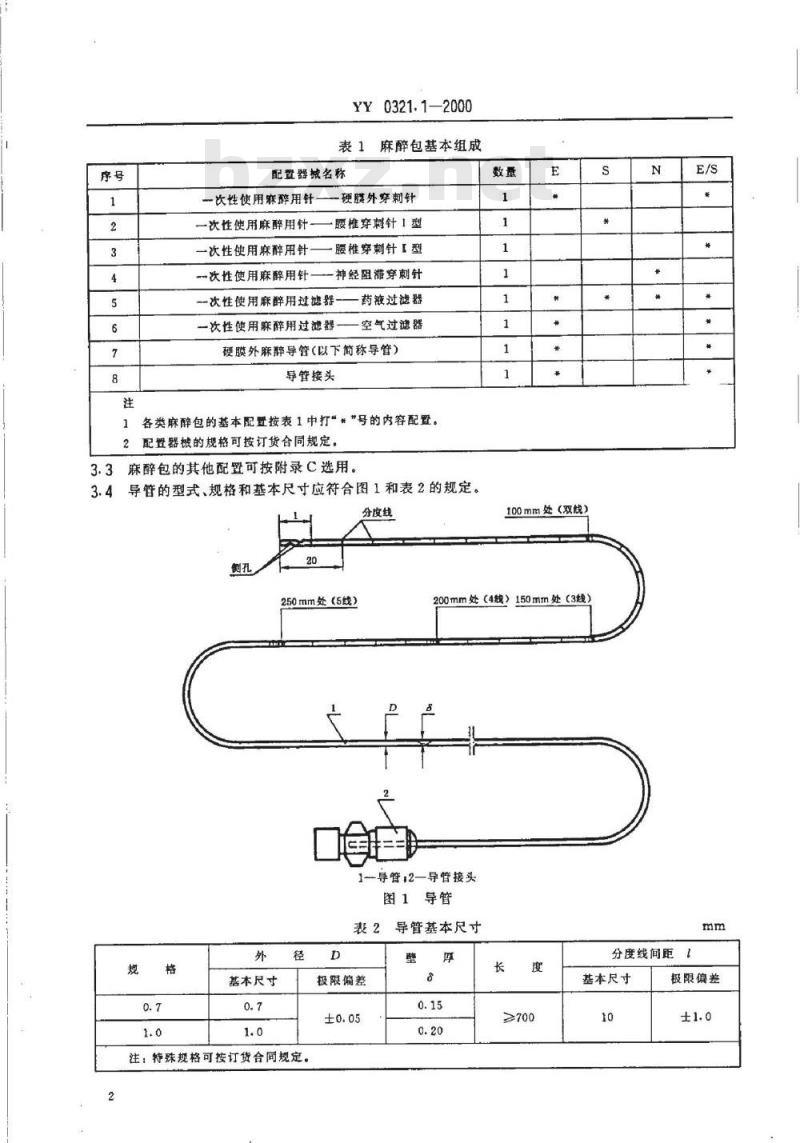
各类麻醉包的基本配置按表1中打“*”号的内容配置。2配置器械的规格可按订货合同规定。3.3麻醉包的其他配置可按附录C选用3.4导管的型式、规格和基本尺寸应符合图1和表2的规定。分度线
基本尺寸
250mm处(5线)
100mm处(双线)
200mm处(4线)150mm处(3线)1—导管:2—导管接头
图1导管
表2导管基本尺寸
注:特殊规格可按订货合同规定。D
极限偏差
分度线间距【
基本尺寸
≥700
极限偏差
YY0321.1—2000
3.5导管和导管接头应采用对人体无毒和无副作用的高分子材料制成。3.6导管接头的圆锥接头尺寸应符合GB1962或ISO594-2的规定。3.7导管侧孔位置应在头端至20mm范围内。侧孔可为1孔、2孔或3孔,孔的截面积应不小于导管内孔截面积。
4要求
4.1使用要求
4.1.1麻醉包的基本配置应符合表1的规定。其他选用配置应符合7.2.1中d)器械配置明细表的规定。
4.1.2一次性使用麻醉用针的尺寸应符合YY0321.2—2000中4.1的规定。4.1.3一次性使用麻醉用过滤器的尺寸应符合YY0321.3-2000中4.1的规定。4.1.4导管的外径、长度和分度线间距尺寸应符合表2的规定。4.1.5导管接头的圆锥接头尺寸应符合GB1962或ISO594-2的规定。4.2物理性能要求
4.2.1一次性使用麻醉用针应符合YY0321.2—2000中4.2的规定。4.2.2一次性使用麻醉用过滤器应符合YY0321.3—2000中4.2的规定。4.2.3导管和导管接头应符合下列要求:4.2.3.1导管内腔应洁净,在60mL洗脱液中大于5μm的微粒数不得超过100个/mL。4.2.3.2导管断裂力:当按照附录B给出的方法试验时,断裂力应符合表3的规定。表3导管试验段断裂力
最小断裂力
4.2.3.3导管接头的圆锥接头应符合GB1962或ISO594-2中的有关规定。4.2.3.4导管与导管接头连接后,流量应畅通,流出水呈喷射状。4.2.3.5导管与导管接头连接应牢固,在承受5N的拉力下,两者不得分离。N
4.2.3.6导管与导管接头连接应有良好的密封性,在承受200kPa水压,持续30s,连接处不得有水滴下。
4.2.3.7导管分度线按5.2.8规定的方法进行试验,应不褪色。4.3生物性能要求
4.3.1麻醇包应无菌。
4.3.2麻醇包应无致热原。
4.3.3麻醉包内与药液接触的器械还应符合下列要求:4.3.3.1应无细胞毒性。
4.3.3.2应无皮内刺激反应。
4.3.3.3应无皮肤致敏反应。
4.4化学性能要求
麻醉包的化学性能应符合下列要求:4.4.1还原物质(易氧化物)
检验液和空白液消耗高锰酸钾溶液Le(KMnO.)=0.002mol/LJ的体积之差应不超过2.0mL。4.4.2金属离子
检验液中锁、铬、铜、铅、锡的总含量应不超过5μg/mL,镉的含量应不超过0.1μg/mL。3
4.4.3酸碱度
YY0321.1-2000
检验液与空白液的pH值之差不得超过1.0。4.4.4麻醉包经环氧乙烷灭菌后,其残留量应不大于10μg/g。4.5外观要求
4.5.1麻醉包包装应无破损,包内应清洁无杂质。4.5.2—次性使用麻醉用针应符合YY0321.2-2000中4.5的规定。4.5.3次性使用麻醛用过滤器应符合YY0321.3—2000中4.5的规定。4.5.4导管接头应无明显的毛边、毛刺、塑流及气泡等注塑缺陷。4.5.5导管表面应平整、光滑、头端应圆整,无毛刺。4.5.6导管的分度线应清晰、不重叠,并环绕管身一周。4.6其他选用配置器械的使用、外观、物理和化学性能要求应符合相应标准的规定。5试验方法
5.1使用要求
5.1.1麻醉包的配置以目视计数检查应符合4.1.1的规定。5.1.2尺寸以通用量具或专用具检验应符合4.1.2~4.1.5的规定。5.2物理性能
5.2.1一次性使用麻醉用针应按YY0321.2一2000中5.2的方法进行,应符合4.2.1的规定。5.2.2-次性使用麻醛用过滤器应按YY0321.3—2000中5.2的方法进行,应符合4.2.2的规定。5.2.3导管洁净
按附录A规定的方法进行,应符合4.2.3.1的规定。5.2.4导管断裂力
按附录B规定的方法进行,应符合4.2.3.2的规定。5.2.5圆锥接头
按GB1962中规定的方法进行,应符合4.2.3.3的规定。5.2.6导管锁紧连接力及畅通性
将导管后端插人导管接头内旋紧,再将吸入半容量水的5mL注射器装于导管接头圆锥接口上,用手推动注射器芯杆,检验导管畅通性应符合4.2.3.4的规定。取下注射器,然后在导管前段施加5N的拉力应符合4.2..3.5的规定。
5.2.7导管连接密封性
导管和导管接头锁紧后,将导管头端孔封闭,从导管接头的圆锥孔内注人200kPa的水压,持续30s,应符合4.2.3.6的规定。
5.2.8分度线褪色
将导管浸人18℃~28℃C的水中,放置24h,然后用纱布擦拭分度线,应符合4.2.3.7的规定。5.3生物性能
5.3.1无菌
按GB/T14233.2中小型配件或实体类器具的无菌试验法进行,应符合4.3.1的规定。5.3.2热原
麻醇醉包中与药液接触器械按GB/T14233.2中小型配件或实体类器具的热原试验方法进行,应符合4.3.2的规定。bzxZ.net
5.3.3麻醉包生物学评价检验液制备方法:将与药液接触的各器械分别按GB14233.2的方法制备试样液后,按药液接触器械的面积之比,分别吸取各试样液,混合后即为检验液。5.3.3.1细胞毒性:按GB/T14233.2—1993中第7章规定的方法进行,应符合4.3.3.1的规定。4
YY0321.1-2000
5.3.3.2皮内刺激:按GB/T14233.2-1993中第8章规定的方法进行,应符合4.3.3.2的规定。5.3.3.3皮肤致敏:按GB/T14233.2—1993中第9章规定的方法进行,应符合4.3.3.3的规定。5.4化学性能
检验液制备:将5支麻醉用针、5只麻醉用过滤器及5支麻醉导管,剪成1cm长的小段,没入250mL新制成的无热原的蒸馅水(去离子水、注射用水)中,在37℃士1℃温度条件下,恒温1h,将样品与液体分离,冷至室温作为检验液,同时制备空白对照液。5.4.1还原物质(易氧化物)
按GB/T14233.1中规定的方法进行,应符合4.4.1的规定。5.4.2金属离子
按GB/T14233.1中规定的方法进行,应符合4.4.2的规定。5.4.3酸碱度
按GB/T14233.1中规定的方法进行,应符合4.4.3的规定。5.4.4环氧乙烷残留量
按GB/T14233.1中规定的方法进行,应符合4.4.4的规定。5.5外观
以目力观察,应符合4.5的规定。5.6其他选用配置器械的试验方法按相应标准规定的方法进行,应符合相应条款的规定。6检验规则
6.1麻醇包由制造厂质母检验部门进行检查,合格后方可提交验收。6.2麻醉包应成批提交检查,检查分逐批检查(出厂检验)和型式检验,一生产批组成一检查批。6.3逐批检查(出厂检验)
6.3.1逐批检查按GB2828的规定进行。6.3.2抽样方案采用一次抽样,抽样方案严格性从正常检查方案开始,不合格品分类、检查项目、检查水平和AQL(合格质水平)按表4的规定。表4遂批检查(出厂检验)
不合格品分类
不合格品分类组
检查项目
检查水平
全部合格
1每一灭菌批应提供无菌试验报告,2每一生产批应提供热原试验报告。B
4.2.3.YY0321.2中
4.2.1、4.2.2、4.2. 5
YY0321.3中4.2
3灭菌后,环氧乙烷残留盘控制在低于4.4.4的规定值后,方可出厂S-2
6.3.3其他选用配置器械,应按相应标准规定的检验规则进行验收检验。6.4型式检验
6.4.1在下列情况下应进行型式检验。a)新产品投产前(包括老产品转产生产);b)连续生产中每年不少于一次:1
YY0321.2中
c)间隔半年以上再投产时,
YY0321.1--2000
d)在设计、工艺或材料有重大改变时;e)国家质量监督检查机构对产品质量进行监督检查时。6.4.2检验项目:第4章全部性能要求。6.4.3抽样方法:从出厂检验合格批中随机抽样,样品抽取数量按表5规定。表5样品抽取数量
使用要求
物理性能要求
生物性能要求
化学性能要求
外观要求
检验项目
本标准条号
4.3.1、4.3.2
4.5.7.1.1
样品抽取数量
6.4.4判定规则与复验规则:所有检验项目均合格,则通过型式检验;检验中若生物性能、化学性能、标志项目全部合格,其他项目出现不合格项时,允许再次按表5抽样,对不合格项目进行复验,复验仍不合格,则型式检验不通过。
6.4.5其他选用配置器械应按6.4.3和6.4.4的规定进行抽样检验和判定。6.5在下列任一情况下,应按GB/T16886.1一1997中4.6的规定,考虑对最终产品重新进行生物学评价:
a)制造产品所用材料来源或技术条件改变时,b)产品配方、工艺、初级包装或灭菌改变时;c)储存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时会产生副作用。注,按GB/T16886.1一1997中A2第4.6条的说明,评价可以包括有关经验研究和实际试验。如果材料确实具有使用史,且其使用方式与设计中的器械相同,采取这样的评价,其结果可能是不必再进行试验。评价应考虑材料与组织之间是否接触。6.6按GB/T16886.1一1997中4.7的规定,进行生物学评价应对生产器械所用材料成分的性质及其变动性、其他非临床试验、临床研究及有关信息和市场情况进行综合考虑。注:按GB/T16886.1一1997中A2第4.7条的说明,该条的自的是,当从其他方面可获取到有关材料和/或器械的信息时,避免多余的重复实验。6.7生物学评价试验项目:
a)细胞毒性,
b)皮内刺激;
c)皮肤致敏。
7标志、使用说明书
7.1标志
7.1.1单包装
a)制造厂名称、地址和商标,
b)产品名称、型号或代号,
c)生产批号或日期;
d)一次性使用说明和/或图形符号,e)无菌字样和/或无菌图形符号:YY 0321.1-2000
f)“包装破损,禁止使用”,“用后销毁”等字样,g)产品注册号、卫生许可证号:h)无菌有效期。
7.1.2外包装
a)制造厂名称、地址和商标,
b)产品名称、型号和数量,
c)生产批号或日期,
d)灭菌批号或日期;
e)毛重和体积(长×宽×高):f)本产品执行标准号、产品注册号、卫生许可证号:g)“次性使用”“无菌”字样或图形符号;h)“小心轻放”怕湿”等字样和标志,应符合GB191中的有关规定。7.2使用说明书
7.2.1使用说明书应有下列内容:a)产品注册号、本标准号:
b)产品特点及用途,
c)使用方法及注意事项;
d)器械配置明细表:
e)器械内麻醉药液残留趾;
f)企业名称、地址和电话。
7.2.2使用说明书的编写和有关内容应符合GB9969.1中的有关规定。8包装、运输、存
8.1包装
8.1.1单包装应采用对人体无毒副作用的材料制成。8.1.2单包装应密封,保持在规定失效日期内无菌,且有利于内装物的灭菌。8.1.3单包装内应有器械存放槽,以防止配置器械相互碰撞。8.1.4单包装应有使用说明书和产品合格证。8.1.5产品合格证的编写和有关内容,应符合GB/T14436的有关规定。8.1.6其他要求应符合YY/T0313的规定。8.2运输和贮存
应符合YY/T0313-一1998中第7章的规定。9其他
无菌有效期不少于2年。
A7原理
YY 0321.1--2000
附录A
(标准的附录)
微粒含盘测定方法
通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A2试验仪器
A2.1电阻式粒子计数器:有搅拌系统,一次取样量为2mL可同时对4μm~6μm、≥5μm的微粒计数。
A2.2冲洗液:质量浓度为9g/L的氧化钠溶液。A2.3100mL注射器。
A3步骤
A3.1用注射器吸取60mL冲洗液,注入计数器的取样杯中即得本底液,测定60mL本底液中的微粒数。
注:试验应避免环境污染。
A3.2重复A3.1步骤,以三次计数的平均值为60mL本底液中的微粒含量。A3.3用注射器吸取60mL冲洗液,装上被测的已连接好导管接头的导管,注人计数器的取样杯中即得洗脱液,测定60mL洗脱液中的微粒数。A4结果表示
洗脱液与本底液微粒读数之差除以2为洗脱液中的微粒含量(个/mL)。附录B
(标准的附录)
测定断裂力的方法
B1原理
选定导管—向试验段施加一拉力直到导管断裂。B2仪器
B2.1拉力试验仪,能施加一大于15N的力。B3步骤
B3.1从被测导管中选定一段进行试验,不应将导管前端长度小于20mm者包括在试验段内。B3.2将试验段固定在拉力试验仪上。B3.3测量试验段的标距,即试验段在拉力试验仪夹具间的距离。B3.4以每毫米标距20mm/min的应变速率(见表B1)进行拉伸,直至试验段分离成两段或多段,记录其发生分离时的力为断裂力(单位牛顿)。8
B4试验报告
YY 0321.1—2000
表B1每毫米标距20mm/min的应变速率条件示例距.mm
试验报告至少应包括以下信息:a)导管规格:
b)试验段标距:
c)应变速率
d)测试结果,断裂力(单位牛顿)。c1
附录C
(提示的附录)
麻醉包选用器械配置表
试验速度,mm/min
麻醉包除标准中规定的基本配置的器械外,其他配置的器械和辅料可按表C1进行选用。表C1
麻醇醉包选用器械配置表
配置器械
配蟹附件与轴料
一次性使用无菌注射器
一次性使用无菌注射针
一次性使用低阻力注射器
导引针
负压管
消毒液刷
橡胶医用手套
敷料巾
手术巾
脱脂纱布
创可贴
选用配置器械的规格、数量或其他特殊配置可按订货合同规定。所选用的器械和辅料均为一次性使用,不得重复使用,亦不可回收后再使用。C3
所选用的器械和辅料必须采用有产品注册号企业的产品,并提供质保书,数量
中华人民共和国医药
行业标准
一次性使用麻醉穿刺包
YY0321.1-2000
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社泰皇岛印刷厂印剧新华书店北京发行所发行
各地新华书店经售
开本880×12301/16印张1字数19千字2001年4月第一版2001年4月第一次印别印数1-1000
书号:1550662-13638
网址bzcbs.com
科目566-516
版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
.YY0321.1—2000
一次性使用麻醉穿刺包
Single-use puncture set for local anaesthesia2000-09-06发布
国家药品监督管理局发布
2000-12-01实施
YY0321.1—2000
一次性使用麻醉穿刺包由基本配置器械和其他配置器械、辅料组成。其主要技术指标生物和化学性能均参照有关国家标准或行业标准,并结合了临床使用要求制定,与其同时制定的标准有YY0321.2-2000《一次性使用麻醉用针》、YY0321.3—2000&一次性使用麻醉用过滤器》。
本标准的附录A、附录B都是标准的附录,附录C是提示的附录。本标准由国家药品监督管理局提出。本标准由全国医用注射器(针)标准化技术委员会归口。本标准起草单位:上海埃斯埃医械塑料制品有限公司、国家药品监督管理局上海医疗器械质量监督检验中心、北京伏尔特技术有限公司、江苏宁泰医疗设备厂。本标准主要起草人:曹贤明、张锦生、傅国宝、赵静、张培林。1范围
中华人民共和国医药行业标准
一次性使用麻醉穿刺包
Single-use puncture set for local anaesthesiaYY0321.1-2000
本标准规定了一次性使用麻醇穿刺包的分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存。
本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)、蛛网膜下腔阻滞(简称腰椎麻醉)、神经阻滞等各种麻醉方法进行穿刺、注射药物的一次性使用麻醉穿刺包(以下简称麻醉包)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191—2000包装储运图示标志
GB1962—1995注射器、注射针及其他医疗器械6:100圆锥接头GB2828—1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB9969.1—1998工业产品使用说明书总则GB/T14233.1—1998医用输液、输血注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993E
医用输液、输血注射器具检验方法第2部分:生物试验方法GB/T14436—1993工业产品保证文件总则YY/T0313—1998医用高分子制品包装、标志、运输和贮存YY0321.2—2000一次性使用麻醉用针YY0321.3—2000一次性使用麻醉用过滤器ISO594-2:1998注射器,注射针和其他医疗器械6%(替尔)圆锥接头第2部分:锁定接头ISO96261991制造医疗器械用不锈钢针管3分类与命名
3.1产品型号
3.1.1产品型号由产品名称代号和分类代号组成。3.1.2一次性使用麻醉穿刺包以AS表示,分类代号:硬膜外麻醉以E表示,腰椎麻醉以S表示;神经阻滞以N表示,硬膜外和腰椎联合麻醉以E/S表示。标记示例:硬膜外麻醉用的一次性使用麻酵穿刺包一次性使用麻醉穿刺包——硬膜外麻醇AS-EYY0321.1—20003.2麻醉包的基本配置按表1规定。国家药品监督管理局2000-09-06批准2000-12-01实施
YY0321.1—2000
表1麻醉包基本组成
配置器械名称
一次性使用麻醇用针
一次性使用麻醉用针
一次性使用麻醇用针
一次性使用麻醇用针
一硬膜外穿刺针
一腰椎穿刺针1型
腰椎穿刺针【型
神经阻灌穿刺针
一次性使用麻醉用过滤器
一次性使用麻醇用过滤器
药液过滤器
空气过滤器
硬膜外麻薪导管(以下简称导管)导管接头
各类麻醉包的基本配置按表1中打“*”号的内容配置。2配置器械的规格可按订货合同规定。3.3麻醉包的其他配置可按附录C选用3.4导管的型式、规格和基本尺寸应符合图1和表2的规定。分度线
基本尺寸
250mm处(5线)
100mm处(双线)
200mm处(4线)150mm处(3线)1—导管:2—导管接头
图1导管
表2导管基本尺寸
注:特殊规格可按订货合同规定。D
极限偏差
分度线间距【
基本尺寸
≥700
极限偏差
YY0321.1—2000
3.5导管和导管接头应采用对人体无毒和无副作用的高分子材料制成。3.6导管接头的圆锥接头尺寸应符合GB1962或ISO594-2的规定。3.7导管侧孔位置应在头端至20mm范围内。侧孔可为1孔、2孔或3孔,孔的截面积应不小于导管内孔截面积。
4要求
4.1使用要求
4.1.1麻醉包的基本配置应符合表1的规定。其他选用配置应符合7.2.1中d)器械配置明细表的规定。
4.1.2一次性使用麻醉用针的尺寸应符合YY0321.2—2000中4.1的规定。4.1.3一次性使用麻醉用过滤器的尺寸应符合YY0321.3-2000中4.1的规定。4.1.4导管的外径、长度和分度线间距尺寸应符合表2的规定。4.1.5导管接头的圆锥接头尺寸应符合GB1962或ISO594-2的规定。4.2物理性能要求
4.2.1一次性使用麻醉用针应符合YY0321.2—2000中4.2的规定。4.2.2一次性使用麻醉用过滤器应符合YY0321.3—2000中4.2的规定。4.2.3导管和导管接头应符合下列要求:4.2.3.1导管内腔应洁净,在60mL洗脱液中大于5μm的微粒数不得超过100个/mL。4.2.3.2导管断裂力:当按照附录B给出的方法试验时,断裂力应符合表3的规定。表3导管试验段断裂力
最小断裂力
4.2.3.3导管接头的圆锥接头应符合GB1962或ISO594-2中的有关规定。4.2.3.4导管与导管接头连接后,流量应畅通,流出水呈喷射状。4.2.3.5导管与导管接头连接应牢固,在承受5N的拉力下,两者不得分离。N
4.2.3.6导管与导管接头连接应有良好的密封性,在承受200kPa水压,持续30s,连接处不得有水滴下。
4.2.3.7导管分度线按5.2.8规定的方法进行试验,应不褪色。4.3生物性能要求
4.3.1麻醇包应无菌。
4.3.2麻醇包应无致热原。
4.3.3麻醉包内与药液接触的器械还应符合下列要求:4.3.3.1应无细胞毒性。
4.3.3.2应无皮内刺激反应。
4.3.3.3应无皮肤致敏反应。
4.4化学性能要求
麻醉包的化学性能应符合下列要求:4.4.1还原物质(易氧化物)
检验液和空白液消耗高锰酸钾溶液Le(KMnO.)=0.002mol/LJ的体积之差应不超过2.0mL。4.4.2金属离子
检验液中锁、铬、铜、铅、锡的总含量应不超过5μg/mL,镉的含量应不超过0.1μg/mL。3
4.4.3酸碱度
YY0321.1-2000
检验液与空白液的pH值之差不得超过1.0。4.4.4麻醉包经环氧乙烷灭菌后,其残留量应不大于10μg/g。4.5外观要求
4.5.1麻醉包包装应无破损,包内应清洁无杂质。4.5.2—次性使用麻醉用针应符合YY0321.2-2000中4.5的规定。4.5.3次性使用麻醛用过滤器应符合YY0321.3—2000中4.5的规定。4.5.4导管接头应无明显的毛边、毛刺、塑流及气泡等注塑缺陷。4.5.5导管表面应平整、光滑、头端应圆整,无毛刺。4.5.6导管的分度线应清晰、不重叠,并环绕管身一周。4.6其他选用配置器械的使用、外观、物理和化学性能要求应符合相应标准的规定。5试验方法
5.1使用要求
5.1.1麻醉包的配置以目视计数检查应符合4.1.1的规定。5.1.2尺寸以通用量具或专用具检验应符合4.1.2~4.1.5的规定。5.2物理性能
5.2.1一次性使用麻醉用针应按YY0321.2一2000中5.2的方法进行,应符合4.2.1的规定。5.2.2-次性使用麻醛用过滤器应按YY0321.3—2000中5.2的方法进行,应符合4.2.2的规定。5.2.3导管洁净
按附录A规定的方法进行,应符合4.2.3.1的规定。5.2.4导管断裂力
按附录B规定的方法进行,应符合4.2.3.2的规定。5.2.5圆锥接头
按GB1962中规定的方法进行,应符合4.2.3.3的规定。5.2.6导管锁紧连接力及畅通性
将导管后端插人导管接头内旋紧,再将吸入半容量水的5mL注射器装于导管接头圆锥接口上,用手推动注射器芯杆,检验导管畅通性应符合4.2.3.4的规定。取下注射器,然后在导管前段施加5N的拉力应符合4.2..3.5的规定。
5.2.7导管连接密封性
导管和导管接头锁紧后,将导管头端孔封闭,从导管接头的圆锥孔内注人200kPa的水压,持续30s,应符合4.2.3.6的规定。
5.2.8分度线褪色
将导管浸人18℃~28℃C的水中,放置24h,然后用纱布擦拭分度线,应符合4.2.3.7的规定。5.3生物性能
5.3.1无菌
按GB/T14233.2中小型配件或实体类器具的无菌试验法进行,应符合4.3.1的规定。5.3.2热原
麻醇醉包中与药液接触器械按GB/T14233.2中小型配件或实体类器具的热原试验方法进行,应符合4.3.2的规定。bzxZ.net
5.3.3麻醉包生物学评价检验液制备方法:将与药液接触的各器械分别按GB14233.2的方法制备试样液后,按药液接触器械的面积之比,分别吸取各试样液,混合后即为检验液。5.3.3.1细胞毒性:按GB/T14233.2—1993中第7章规定的方法进行,应符合4.3.3.1的规定。4
YY0321.1-2000
5.3.3.2皮内刺激:按GB/T14233.2-1993中第8章规定的方法进行,应符合4.3.3.2的规定。5.3.3.3皮肤致敏:按GB/T14233.2—1993中第9章规定的方法进行,应符合4.3.3.3的规定。5.4化学性能
检验液制备:将5支麻醉用针、5只麻醉用过滤器及5支麻醉导管,剪成1cm长的小段,没入250mL新制成的无热原的蒸馅水(去离子水、注射用水)中,在37℃士1℃温度条件下,恒温1h,将样品与液体分离,冷至室温作为检验液,同时制备空白对照液。5.4.1还原物质(易氧化物)
按GB/T14233.1中规定的方法进行,应符合4.4.1的规定。5.4.2金属离子
按GB/T14233.1中规定的方法进行,应符合4.4.2的规定。5.4.3酸碱度
按GB/T14233.1中规定的方法进行,应符合4.4.3的规定。5.4.4环氧乙烷残留量
按GB/T14233.1中规定的方法进行,应符合4.4.4的规定。5.5外观
以目力观察,应符合4.5的规定。5.6其他选用配置器械的试验方法按相应标准规定的方法进行,应符合相应条款的规定。6检验规则
6.1麻醇包由制造厂质母检验部门进行检查,合格后方可提交验收。6.2麻醉包应成批提交检查,检查分逐批检查(出厂检验)和型式检验,一生产批组成一检查批。6.3逐批检查(出厂检验)
6.3.1逐批检查按GB2828的规定进行。6.3.2抽样方案采用一次抽样,抽样方案严格性从正常检查方案开始,不合格品分类、检查项目、检查水平和AQL(合格质水平)按表4的规定。表4遂批检查(出厂检验)
不合格品分类
不合格品分类组
检查项目
检查水平
全部合格
1每一灭菌批应提供无菌试验报告,2每一生产批应提供热原试验报告。B
4.2.3.YY0321.2中
4.2.1、4.2.2、4.2. 5
YY0321.3中4.2
3灭菌后,环氧乙烷残留盘控制在低于4.4.4的规定值后,方可出厂S-2
6.3.3其他选用配置器械,应按相应标准规定的检验规则进行验收检验。6.4型式检验
6.4.1在下列情况下应进行型式检验。a)新产品投产前(包括老产品转产生产);b)连续生产中每年不少于一次:1
YY0321.2中
c)间隔半年以上再投产时,
YY0321.1--2000
d)在设计、工艺或材料有重大改变时;e)国家质量监督检查机构对产品质量进行监督检查时。6.4.2检验项目:第4章全部性能要求。6.4.3抽样方法:从出厂检验合格批中随机抽样,样品抽取数量按表5规定。表5样品抽取数量
使用要求
物理性能要求
生物性能要求
化学性能要求
外观要求
检验项目
本标准条号
4.3.1、4.3.2
4.5.7.1.1
样品抽取数量
6.4.4判定规则与复验规则:所有检验项目均合格,则通过型式检验;检验中若生物性能、化学性能、标志项目全部合格,其他项目出现不合格项时,允许再次按表5抽样,对不合格项目进行复验,复验仍不合格,则型式检验不通过。
6.4.5其他选用配置器械应按6.4.3和6.4.4的规定进行抽样检验和判定。6.5在下列任一情况下,应按GB/T16886.1一1997中4.6的规定,考虑对最终产品重新进行生物学评价:
a)制造产品所用材料来源或技术条件改变时,b)产品配方、工艺、初级包装或灭菌改变时;c)储存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时会产生副作用。注,按GB/T16886.1一1997中A2第4.6条的说明,评价可以包括有关经验研究和实际试验。如果材料确实具有使用史,且其使用方式与设计中的器械相同,采取这样的评价,其结果可能是不必再进行试验。评价应考虑材料与组织之间是否接触。6.6按GB/T16886.1一1997中4.7的规定,进行生物学评价应对生产器械所用材料成分的性质及其变动性、其他非临床试验、临床研究及有关信息和市场情况进行综合考虑。注:按GB/T16886.1一1997中A2第4.7条的说明,该条的自的是,当从其他方面可获取到有关材料和/或器械的信息时,避免多余的重复实验。6.7生物学评价试验项目:
a)细胞毒性,
b)皮内刺激;
c)皮肤致敏。
7标志、使用说明书
7.1标志
7.1.1单包装
a)制造厂名称、地址和商标,
b)产品名称、型号或代号,
c)生产批号或日期;
d)一次性使用说明和/或图形符号,e)无菌字样和/或无菌图形符号:YY 0321.1-2000
f)“包装破损,禁止使用”,“用后销毁”等字样,g)产品注册号、卫生许可证号:h)无菌有效期。
7.1.2外包装
a)制造厂名称、地址和商标,
b)产品名称、型号和数量,
c)生产批号或日期,
d)灭菌批号或日期;
e)毛重和体积(长×宽×高):f)本产品执行标准号、产品注册号、卫生许可证号:g)“次性使用”“无菌”字样或图形符号;h)“小心轻放”怕湿”等字样和标志,应符合GB191中的有关规定。7.2使用说明书
7.2.1使用说明书应有下列内容:a)产品注册号、本标准号:
b)产品特点及用途,
c)使用方法及注意事项;
d)器械配置明细表:
e)器械内麻醉药液残留趾;
f)企业名称、地址和电话。
7.2.2使用说明书的编写和有关内容应符合GB9969.1中的有关规定。8包装、运输、存
8.1包装
8.1.1单包装应采用对人体无毒副作用的材料制成。8.1.2单包装应密封,保持在规定失效日期内无菌,且有利于内装物的灭菌。8.1.3单包装内应有器械存放槽,以防止配置器械相互碰撞。8.1.4单包装应有使用说明书和产品合格证。8.1.5产品合格证的编写和有关内容,应符合GB/T14436的有关规定。8.1.6其他要求应符合YY/T0313的规定。8.2运输和贮存
应符合YY/T0313-一1998中第7章的规定。9其他
无菌有效期不少于2年。
A7原理
YY 0321.1--2000
附录A
(标准的附录)
微粒含盘测定方法
通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A2试验仪器
A2.1电阻式粒子计数器:有搅拌系统,一次取样量为2mL可同时对4μm~6μm、≥5μm的微粒计数。
A2.2冲洗液:质量浓度为9g/L的氧化钠溶液。A2.3100mL注射器。
A3步骤
A3.1用注射器吸取60mL冲洗液,注入计数器的取样杯中即得本底液,测定60mL本底液中的微粒数。
注:试验应避免环境污染。
A3.2重复A3.1步骤,以三次计数的平均值为60mL本底液中的微粒含量。A3.3用注射器吸取60mL冲洗液,装上被测的已连接好导管接头的导管,注人计数器的取样杯中即得洗脱液,测定60mL洗脱液中的微粒数。A4结果表示
洗脱液与本底液微粒读数之差除以2为洗脱液中的微粒含量(个/mL)。附录B
(标准的附录)
测定断裂力的方法
B1原理
选定导管—向试验段施加一拉力直到导管断裂。B2仪器
B2.1拉力试验仪,能施加一大于15N的力。B3步骤
B3.1从被测导管中选定一段进行试验,不应将导管前端长度小于20mm者包括在试验段内。B3.2将试验段固定在拉力试验仪上。B3.3测量试验段的标距,即试验段在拉力试验仪夹具间的距离。B3.4以每毫米标距20mm/min的应变速率(见表B1)进行拉伸,直至试验段分离成两段或多段,记录其发生分离时的力为断裂力(单位牛顿)。8
B4试验报告
YY 0321.1—2000
表B1每毫米标距20mm/min的应变速率条件示例距.mm
试验报告至少应包括以下信息:a)导管规格:
b)试验段标距:
c)应变速率
d)测试结果,断裂力(单位牛顿)。c1
附录C
(提示的附录)
麻醉包选用器械配置表
试验速度,mm/min
麻醉包除标准中规定的基本配置的器械外,其他配置的器械和辅料可按表C1进行选用。表C1
麻醇醉包选用器械配置表
配置器械
配蟹附件与轴料
一次性使用无菌注射器
一次性使用无菌注射针
一次性使用低阻力注射器
导引针
负压管
消毒液刷
橡胶医用手套
敷料巾
手术巾
脱脂纱布
创可贴
选用配置器械的规格、数量或其他特殊配置可按订货合同规定。所选用的器械和辅料均为一次性使用,不得重复使用,亦不可回收后再使用。C3
所选用的器械和辅料必须采用有产品注册号企业的产品,并提供质保书,数量
中华人民共和国医药
行业标准
一次性使用麻醉穿刺包
YY0321.1-2000
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社泰皇岛印刷厂印剧新华书店北京发行所发行
各地新华书店经售
开本880×12301/16印张1字数19千字2001年4月第一版2001年4月第一次印别印数1-1000
书号:1550662-13638
网址bzcbs.com
科目566-516
版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 上一篇: YY 0321.2-2000 一次性使用麻醉用针
- 下一篇: YY 0320-2000 麻醉机
- 热门标准
- 医药行业标准(YY)
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T1574-2017 组织工程医疗器械产品海藻酸盐凝胶固定或微囊化指南
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY0476-2004 眼内冲洗灌注液
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0781-2010 血压传感器
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T1268-2015 环氧乙烷灭菌的产品追加和过程等效
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2