- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0321.2-2000 一次性使用麻醉用针
标准号:
YY 0321.2-2000
标准名称:
一次性使用麻醉用针
标准类别:
医药行业标准(YY)
标准状态:
现行-
发布日期:
2000-09-06 -
实施日期:
2000-12-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
229.77 KB
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了一次性使用麻醉用针的分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存。本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)、蛛网膜下腔阻滞(简称腰椎麻醉)、神经阻滞等各种麻醉方法进行穿刺、注射药物的一次性使用麻醉用针。 YY 0321.2-2000 一次性使用麻醉用针 YY0321.2-2000
部分标准内容:
备案号:8056—2001
中华人民共和国医药行业标准
YY 0321.2—2000
一次性使用麻醉用针
Single-use needle for anaesthesia2000-09-06发布
国家药品监督管理局发布
2000-12-01实施
中华人民共和国医药
行业标准
一次性使用麻醉用针
YY0321.2—2000
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷厅各地新华书店经售
新华书店北京发行所发行
开本880×12301/16
字数17千字
印张3/4
2001年4月第一次印刷
2001年4月第一版
印数1-1000
书号:155066-2-13639
网址bzcbs.com
科目566-517
版权专有
傻权必究
举报电话:(010)68533533
YY0321.2—2000
一次性使用麻酵用针是医疗单位为患者进行麻醇时使用。其主要技术指标生物、化学和物理性能均参照有关国家标准或行业标准,并结合了临床使用要求制定。与其同时制定的标准有YY0321.1—2000《次性使用麻醉穿刺包》YY.0321.3—2000《—次性使用麻醉用过滤器》。
本标准的附录A是标准的附录。
本标准由国家药品监督管理局提出。本标准由全国医用注射器(针)标准化技术委员会归口。本标准起草单位,上海埃斯埃医械塑料制品有限公司。本标准主要起草人:曹贤明、张锦生。1范围
中华人民共和国医药行业标准
一次性使用麻醉用针
Single-use needle for anaesthesiaYY0321.2—2000
本标准规定了一次性使用麻醉用针的分类与命名、要求、试验方法,检验规则、标志、使用说明书及包装、运输、贮存。
本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)蛛网膜下腔阻滞(简称腰椎麻醇)、神经阻滞等各种麻醉方法进行穿刺,注射药物用的一次性使用麻醉用针(以下筒称麻醉用针)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191—2000包装储运图示标志
GB1962—1995注射器、注射针及其他医疗器械6:100圆锥接头GB2828—1987
逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB2829-1987周期检查计数抽样程序及抽样表(适用于生产过程稳定性检查)GB9969.1-1998工业产品使用说明书总GB/T14233.1-1998医用输液、输血注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993医用输液、输血注射器具检验方法第2部分:生物试验方法GB/T14436—1993工业产品保证文件总则YY/T0313—1998医用高分子制品包装、标志、运输和贮存ISO594-2:1998注射器、注射针和其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头ISO9626:1991
3分类与命名
制造医疗器械用不锈钢针管
3.1麻醉用针的型式、规格和基本尺寸应符合图1~图3及表1的规定。3
L,=nX10±1.0
斜度线
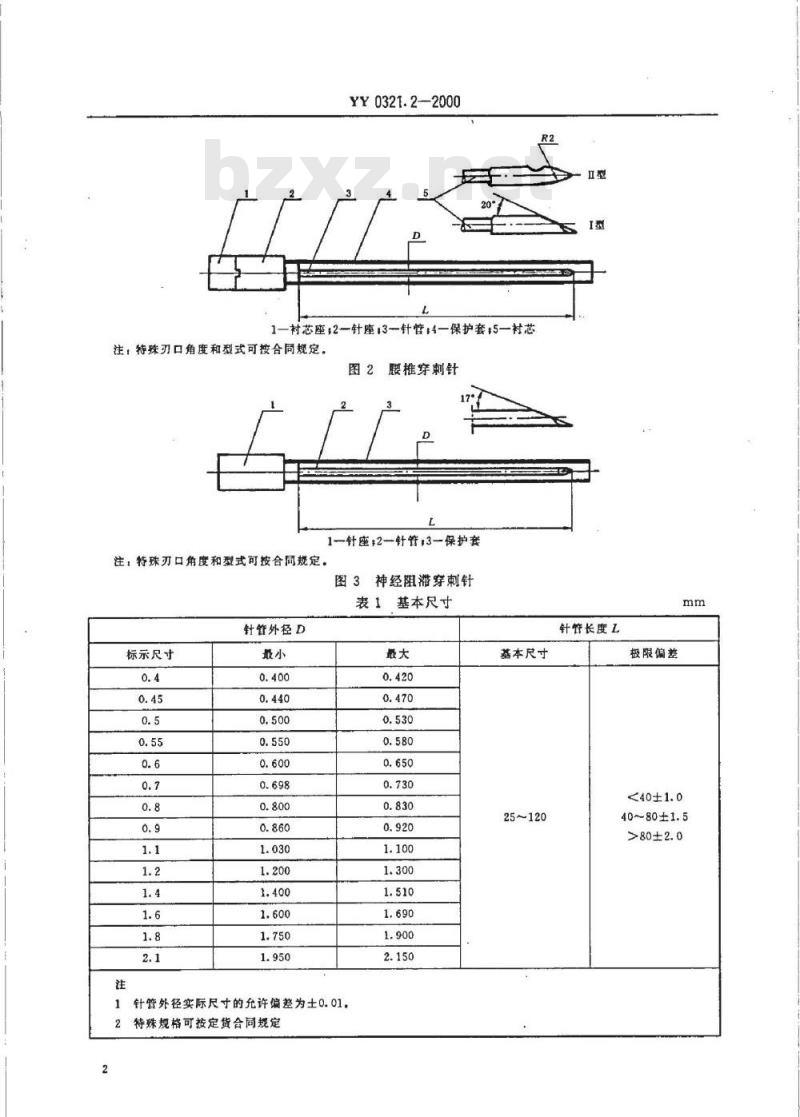
1一村芯座:2一针座13一针管;4保护套;5一村芯注:特殊刃口角度和型式可按合同规定。图1
硬膜外穿刺针
国家药品监督管理局2000-09-06批准2000-12-01实施
YY0321.2—2000
1村芯座,2一针座:3一针管:4一保护套15一村芯注:待殊刃口角度和型式可按合同规定。腰椎穿刺针
1一针座+2针管,3一保护套
注,特殊刃口角度和型式可按合同规定。3神经阻滞穿刺针
表1基本尺寸
针管外径D
标示尺寸
针管外径实际尺寸的允许偏差为士0.01,2特殊规格可按定货合同规定
基本尺寸
25~120
针管长度L
极限偏差
40~80±1.5
3.2产品型号
YY0321.2—2000
3.2.1产品型号由总代号加分类代号和刃口型号及规格组成。3.2.2型号的表示方法:
其中总代号以AN表示一次性使用麻酵用针。针管长度
针管外径
一刃口型号
分类代号
总代号
分类代号以E表示硬膜外穿刺针、以S表示腰椎穿刺针、以N表示神经阻滞穿刺针。刃口型号适用于腰椎穿刺针,分别以1型或1型表示(见图2)。规格以针管公称外径×针管长度表示。标记示例:针管外径为0.5mm,针管长度为90mm,1型刃口的-次性使用麻醉用针一腰椎穿刺针
一次性使用麻醉用针-
腰椎穿刺针AN-SI0.5×90YY0321.2—20003.3针座圆锥接头的尺寸应符合GB1962或ISO594-2的规定。3.4麻醉用针的针座、衬芯座应采用对人体无毒副作用的聚丙烯或其他高分子材料制成。3.5麻醉用针的针管应以0Cr18Ni11Ti或ISO9626中规定的奥氏体不锈钢制成。4要求
4.1使用要求
4.1.1麻醉用针的基本尺寸D和L应符合3.1的规定。4.1.2硬膜外穿刺针的针管刻度线尺寸,应符合图1的规定。4.2物理性能要求
4.2.1麻醇醉用针针座圆锥接头应符合GB1962或1SO594-2的有关规定。4.2.2麻醛用针针管与针座、衬芯与衬芯座连接应牢固,在表2规定的拉力下,作拉拔试验,二者不得分离。
表2连接牢固度
针管与针座
针管外径,mm
4.2.3麻静用针刃口
村芯外径,mm
0.15~0.45
0.55~1.65
衬芯与衬芯座
拉力,N
4.2.3.1腰椎穿刺针和神经阻滞穿刺针针尖应锋利,用3倍放大镜检查时,针尖应无平头、毛刺和弯钩。
4.2.3.2硬膜外穿刺针刃口内外应光滑无毛刺、毛边。内孔用导管检查时,不应损伤导管。3
YY0321.2—2000
4.2.4麻酵用针的针管刚性、韧性和耐腐蚀性能应符合ISO9626中的相应规定。4.2.5麻醉用针的内腔应洁净,在60mL洗脱液中,大于5μm的微粒数不得超过100个/mL。4.3生物性能要求
4.3.1麻醉用针应无菌。
4.3.2麻薛用针应无致热原。
4.4化学性能要求
4.4.1酸碱度
检验液与空白液pH值之差不得超过1.0。4.4.2金属离子
检验液中钡、铬、铅、铜、锡的总量不超过5μg/mL,锰的含量应不超过0.1pg/mL。4.4.3麻醉用针经环氧乙烷灭菌后,其残留量应不大于10μg/g4.5外观要求
4.5.1针管与针座连接应正直,不应有明显的歪斜。4.5.2针尖刃口斜面与针座标记应在同一方向,不应有显著的偏转。带衬芯的麻醇用针,衬芯插人针管应顺畅,定位后,其头部面与针尖刃口斜面应在同一平面,不应有明显的偏侧或高低。4.5.3针座、衬芯座应无明显毛边、毛刺、塑流及气泡等注塑缺陷。4.5.4
针管外表面的表面粗糙度应不大于Ral.6μm。麻醉用针以颜色表示针管公称外径,其识别色标应符合表3的规定。表3识别色标
针管外径,mm
5试验方法
5.1使用要求
尺寸以通用量具或专用量具检验应符合4.1的规定。颜色
红-紫
蓝-灰
5.2物理性能
5.2.1圆锥接头
YY 0321.2—2000
按GB1962或ISO594-2的规定方法进行试验,应符合4.2.1的规定。5.2.2连接牢固度
将针管或衬芯固定在专用仪器上,沿针座或衬芯座轴向作无冲击的拉拔,应符合4.2.2的规定。5.2.3刃口毛刺
5.2.3.1将腰椎穿刺针、神经阻滞穿刺针针尖在脱脂棉上拖拉,不得拉出纤维,并用3倍放大镜检查,应符合4.2.3.1的规定。
5.2.3.2将硬膜外穿刺针刃口在脱脂棉上拖拉,不得拉出纤维,然后用小于针管内径0.2mm的塑料导管从针座锥孔方向插人针管,穿出刃口10mm左右后,将塑料导管向后拉回,应符合4.2.3.2的规定。
5.2.4针管性能
麻醉用针针管的刚性、韧性和耐腐蚀性能按ISO9626中规定的方法进行试验,应符合4.2.4的规定。
5.2.5内腔洁净
按附录A微粒含盘测定方法进行试验,应符合4.2.5的规定。5.3生物性能
5.3.1无菌
按GB/T14233.2中无菌试验法中小型配件或实体类器具进行试验,应符合4.3.1的规定。5.3.2热原
按GB/T14233.2热原试验中小型配件或实体类器具进行试验,应符合4.3.2的规定。5.4化学性能
检验液制备:将20支麻醉用针浸人250mL新制成的无热原蒸馏水(去离子水、注射用水)中,在37℃士1℃温度条件下恒温1h,将样品与液体分离冷却至室温,作为检验液,同时制备空白液。5.4.1酸碱度
按GB/T14233.1中规定的分析方祛试验,应符合4.4.1的规定。5.4.2金属离子
按GB/T14233.1中规定的分析方法试验,应符合4.4.2的规定。5.5外观
5.5.1以目力观察,应符合4.5.1、4.5.2、4.5.3、4.5.5的规定。5.5.2表面粗髓度:用表面粗糙度标准块对比应符合4.5.4的规定。6检验规则
6.1麻酵用针由制造厂质量检验部门进行检验,合格后方可提交验收。6.2麻醉用针应成批提交检查,检查分逐批检查(出厂检验)和周期检查(型式检验)。6.2.1组批规则
生产批是由材料、工艺、设备和生产时间基本相同的条件下制造的产品组成,每一生产批组成一检查批。
6.3逐批检查(出厂检验)
6.3.1逐批检查按GB2828的规定进行。6.3.2抽样方案采用一次抽样,抽样方案严格性从正常检查开始,其不合格品分类、检查项目、检查水平和AQL(合格质量水平)按表4规定。不合格品分类
不合格品分类组
检查项目
检查水平
全部合格
每一灭苗批应作无菌试验。
2每一生产批应作热原试验。
YY0321.2—2000
表4逐批检查(出厂检验)
3灭菌后,环氧乙烷残留册控制在低于4.4.3的规定值后,方可出厂。6.4周期检查(型式检验)
6.4.1在下列情况下应作周期检查a)新产品投产前(包括老产品转厂生产);b)连续生产中每年不少于一次;c)间隔半年以上再生产时,
d)在设计、工艺或材料有重大改变时;e)国家质盘监督检验机构对产品质量进行监督检查时。6.4.2周期检查应按GB2829的规定进行。6.4.3
抽样方案、不合格品分类、试验组、检查项目、判别水平、RQL(不合格质量水平)按表5规定。表5周期检查(型式检验)
不合格品分类
试验组
检查项目
判别水平
执样方案
7标志、使用说明书
7.1标志
7.1.1单包装
全部合格
a)制造厂名称、地址和商标;
5[0,1]
b)产品名称、型号或规格、产品注册号、卫生许可证号;c)“无菌”“无致热原”字样,d)“一次性使用”“用后销毁”字样:e)“包装破损禁止使用”字样;f)生产批号或日期:
g)无菌有效期。
7.1.2、外包装
a)制造厂名称、商标和地址;
12[3,4]
YY0321.2—2000
b)产品名称、型号或规格、本标准号、产品注册号、卫生许可证号;c)数置、毛重、体积(长×宽×高)d)生产批号或日期:
e)灭菌批号或日期,
)无菌有效期;
g)“一次性使用”、“无菌”字样或图形符号,h)“小心轻放”、“怕湿”等字样和标志,应符合GB191中的有关规定。7.2使用说明书wwW.bzxz.Net
7.2.1使用说明书应有下列内容:a)产品注册号、本标准号:
b)产品特点及用途:
c)使用方法及注意事项;
d)企业名称和电话、地址。
7.2.2使用说明书的编写和有关内容应符合GB9969.1中的有关规定。8包装、运输、贮存
8.1包装
8.1.1每支麻醉用针应用无毒材料密封包装。8.1.2若于数量的单包装应装入一中包装盒内。8.1.3中包装内应有使用说明书和产品合格证。8.1.4产品合格证的编写和有关内容,应符合GB/T14436中的有关规定。8.1.5若干数的中包装应装入一瓦榜纸箱内,箱内应有防潮纸或塑料袋。8.1.6其他要求应符合YY/T0313的规定。8.2运输和贮存
应符合YY/T0313—1998中第7章的规定。9其他
无菌有效期不少于2年。
A1原理
YY0321.2—2000
附录A
(标准的附录)
微粒含量测定方法
通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A2试验仪器
A2.1电阻式粒子计数器:有搅拌系统,一次取样量为2mL可同时对4μm~6μm、≥5jμm的微粒计数。
A2.2冲洗液:质盘浓度为9g/L的氯化钠溶液。A2.3100mL注射器。
A3步骤
用注射器吸取60mL冲洗液,注人计数器的取样杯中即得本底液,测定60mL本底液中的微粒A3.1
注,试验应避免环境污染。
A3.2重复A3.1步骤,以三次计数的平均值为60mL本底液中的微粒含盘。A3.3用注射器吸取60mL冲洗液,装上被测的穿刺针,注人计数器的取样杯中即得洗脱液,测定60mL洗脱液中的微粒数。
A4结果表示
洗脱液与本底液微粒读数之差除以2为洗脱液中的微粒含量(个/mL)。版权专有侵权必究
书号:155066:2-13639
科日566-517
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY 0321.2—2000
一次性使用麻醉用针
Single-use needle for anaesthesia2000-09-06发布
国家药品监督管理局发布
2000-12-01实施
中华人民共和国医药
行业标准
一次性使用麻醉用针
YY0321.2—2000
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷厅各地新华书店经售
新华书店北京发行所发行
开本880×12301/16
字数17千字
印张3/4
2001年4月第一次印刷
2001年4月第一版
印数1-1000
书号:155066-2-13639
网址bzcbs.com
科目566-517
版权专有
傻权必究
举报电话:(010)68533533
YY0321.2—2000
一次性使用麻酵用针是医疗单位为患者进行麻醇时使用。其主要技术指标生物、化学和物理性能均参照有关国家标准或行业标准,并结合了临床使用要求制定。与其同时制定的标准有YY0321.1—2000《次性使用麻醉穿刺包》YY.0321.3—2000《—次性使用麻醉用过滤器》。
本标准的附录A是标准的附录。
本标准由国家药品监督管理局提出。本标准由全国医用注射器(针)标准化技术委员会归口。本标准起草单位,上海埃斯埃医械塑料制品有限公司。本标准主要起草人:曹贤明、张锦生。1范围
中华人民共和国医药行业标准
一次性使用麻醉用针
Single-use needle for anaesthesiaYY0321.2—2000
本标准规定了一次性使用麻醉用针的分类与命名、要求、试验方法,检验规则、标志、使用说明书及包装、运输、贮存。
本标准适用于对人体做硬脊膜外腔神经阻滞(简称硬膜外麻醉)蛛网膜下腔阻滞(简称腰椎麻醇)、神经阻滞等各种麻醉方法进行穿刺,注射药物用的一次性使用麻醉用针(以下筒称麻醉用针)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191—2000包装储运图示标志
GB1962—1995注射器、注射针及其他医疗器械6:100圆锥接头GB2828—1987
逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB2829-1987周期检查计数抽样程序及抽样表(适用于生产过程稳定性检查)GB9969.1-1998工业产品使用说明书总GB/T14233.1-1998医用输液、输血注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993医用输液、输血注射器具检验方法第2部分:生物试验方法GB/T14436—1993工业产品保证文件总则YY/T0313—1998医用高分子制品包装、标志、运输和贮存ISO594-2:1998注射器、注射针和其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头ISO9626:1991
3分类与命名
制造医疗器械用不锈钢针管
3.1麻醉用针的型式、规格和基本尺寸应符合图1~图3及表1的规定。3
L,=nX10±1.0
斜度线
1一村芯座:2一针座13一针管;4保护套;5一村芯注:特殊刃口角度和型式可按合同规定。图1
硬膜外穿刺针
国家药品监督管理局2000-09-06批准2000-12-01实施
YY0321.2—2000
1村芯座,2一针座:3一针管:4一保护套15一村芯注:待殊刃口角度和型式可按合同规定。腰椎穿刺针
1一针座+2针管,3一保护套
注,特殊刃口角度和型式可按合同规定。3神经阻滞穿刺针
表1基本尺寸
针管外径D
标示尺寸
针管外径实际尺寸的允许偏差为士0.01,2特殊规格可按定货合同规定
基本尺寸
25~120
针管长度L
极限偏差
40~80±1.5
3.2产品型号
YY0321.2—2000
3.2.1产品型号由总代号加分类代号和刃口型号及规格组成。3.2.2型号的表示方法:
其中总代号以AN表示一次性使用麻酵用针。针管长度
针管外径
一刃口型号
分类代号
总代号
分类代号以E表示硬膜外穿刺针、以S表示腰椎穿刺针、以N表示神经阻滞穿刺针。刃口型号适用于腰椎穿刺针,分别以1型或1型表示(见图2)。规格以针管公称外径×针管长度表示。标记示例:针管外径为0.5mm,针管长度为90mm,1型刃口的-次性使用麻醉用针一腰椎穿刺针
一次性使用麻醉用针-
腰椎穿刺针AN-SI0.5×90YY0321.2—20003.3针座圆锥接头的尺寸应符合GB1962或ISO594-2的规定。3.4麻醉用针的针座、衬芯座应采用对人体无毒副作用的聚丙烯或其他高分子材料制成。3.5麻醉用针的针管应以0Cr18Ni11Ti或ISO9626中规定的奥氏体不锈钢制成。4要求
4.1使用要求
4.1.1麻醉用针的基本尺寸D和L应符合3.1的规定。4.1.2硬膜外穿刺针的针管刻度线尺寸,应符合图1的规定。4.2物理性能要求
4.2.1麻醇醉用针针座圆锥接头应符合GB1962或1SO594-2的有关规定。4.2.2麻醛用针针管与针座、衬芯与衬芯座连接应牢固,在表2规定的拉力下,作拉拔试验,二者不得分离。
表2连接牢固度
针管与针座
针管外径,mm
4.2.3麻静用针刃口
村芯外径,mm
0.15~0.45
0.55~1.65
衬芯与衬芯座
拉力,N
4.2.3.1腰椎穿刺针和神经阻滞穿刺针针尖应锋利,用3倍放大镜检查时,针尖应无平头、毛刺和弯钩。
4.2.3.2硬膜外穿刺针刃口内外应光滑无毛刺、毛边。内孔用导管检查时,不应损伤导管。3
YY0321.2—2000
4.2.4麻酵用针的针管刚性、韧性和耐腐蚀性能应符合ISO9626中的相应规定。4.2.5麻醉用针的内腔应洁净,在60mL洗脱液中,大于5μm的微粒数不得超过100个/mL。4.3生物性能要求
4.3.1麻醉用针应无菌。
4.3.2麻薛用针应无致热原。
4.4化学性能要求
4.4.1酸碱度
检验液与空白液pH值之差不得超过1.0。4.4.2金属离子
检验液中钡、铬、铅、铜、锡的总量不超过5μg/mL,锰的含量应不超过0.1pg/mL。4.4.3麻醉用针经环氧乙烷灭菌后,其残留量应不大于10μg/g4.5外观要求
4.5.1针管与针座连接应正直,不应有明显的歪斜。4.5.2针尖刃口斜面与针座标记应在同一方向,不应有显著的偏转。带衬芯的麻醇用针,衬芯插人针管应顺畅,定位后,其头部面与针尖刃口斜面应在同一平面,不应有明显的偏侧或高低。4.5.3针座、衬芯座应无明显毛边、毛刺、塑流及气泡等注塑缺陷。4.5.4
针管外表面的表面粗糙度应不大于Ral.6μm。麻醉用针以颜色表示针管公称外径,其识别色标应符合表3的规定。表3识别色标
针管外径,mm
5试验方法
5.1使用要求
尺寸以通用量具或专用量具检验应符合4.1的规定。颜色
红-紫
蓝-灰
5.2物理性能
5.2.1圆锥接头
YY 0321.2—2000
按GB1962或ISO594-2的规定方法进行试验,应符合4.2.1的规定。5.2.2连接牢固度
将针管或衬芯固定在专用仪器上,沿针座或衬芯座轴向作无冲击的拉拔,应符合4.2.2的规定。5.2.3刃口毛刺
5.2.3.1将腰椎穿刺针、神经阻滞穿刺针针尖在脱脂棉上拖拉,不得拉出纤维,并用3倍放大镜检查,应符合4.2.3.1的规定。
5.2.3.2将硬膜外穿刺针刃口在脱脂棉上拖拉,不得拉出纤维,然后用小于针管内径0.2mm的塑料导管从针座锥孔方向插人针管,穿出刃口10mm左右后,将塑料导管向后拉回,应符合4.2.3.2的规定。
5.2.4针管性能
麻醉用针针管的刚性、韧性和耐腐蚀性能按ISO9626中规定的方法进行试验,应符合4.2.4的规定。
5.2.5内腔洁净
按附录A微粒含盘测定方法进行试验,应符合4.2.5的规定。5.3生物性能
5.3.1无菌
按GB/T14233.2中无菌试验法中小型配件或实体类器具进行试验,应符合4.3.1的规定。5.3.2热原
按GB/T14233.2热原试验中小型配件或实体类器具进行试验,应符合4.3.2的规定。5.4化学性能
检验液制备:将20支麻醉用针浸人250mL新制成的无热原蒸馏水(去离子水、注射用水)中,在37℃士1℃温度条件下恒温1h,将样品与液体分离冷却至室温,作为检验液,同时制备空白液。5.4.1酸碱度
按GB/T14233.1中规定的分析方祛试验,应符合4.4.1的规定。5.4.2金属离子
按GB/T14233.1中规定的分析方法试验,应符合4.4.2的规定。5.5外观
5.5.1以目力观察,应符合4.5.1、4.5.2、4.5.3、4.5.5的规定。5.5.2表面粗髓度:用表面粗糙度标准块对比应符合4.5.4的规定。6检验规则
6.1麻酵用针由制造厂质量检验部门进行检验,合格后方可提交验收。6.2麻醉用针应成批提交检查,检查分逐批检查(出厂检验)和周期检查(型式检验)。6.2.1组批规则
生产批是由材料、工艺、设备和生产时间基本相同的条件下制造的产品组成,每一生产批组成一检查批。
6.3逐批检查(出厂检验)
6.3.1逐批检查按GB2828的规定进行。6.3.2抽样方案采用一次抽样,抽样方案严格性从正常检查开始,其不合格品分类、检查项目、检查水平和AQL(合格质量水平)按表4规定。不合格品分类
不合格品分类组
检查项目
检查水平
全部合格
每一灭苗批应作无菌试验。
2每一生产批应作热原试验。
YY0321.2—2000
表4逐批检查(出厂检验)
3灭菌后,环氧乙烷残留册控制在低于4.4.3的规定值后,方可出厂。6.4周期检查(型式检验)
6.4.1在下列情况下应作周期检查a)新产品投产前(包括老产品转厂生产);b)连续生产中每年不少于一次;c)间隔半年以上再生产时,
d)在设计、工艺或材料有重大改变时;e)国家质盘监督检验机构对产品质量进行监督检查时。6.4.2周期检查应按GB2829的规定进行。6.4.3
抽样方案、不合格品分类、试验组、检查项目、判别水平、RQL(不合格质量水平)按表5规定。表5周期检查(型式检验)
不合格品分类
试验组
检查项目
判别水平
执样方案
7标志、使用说明书
7.1标志
7.1.1单包装
全部合格
a)制造厂名称、地址和商标;
5[0,1]
b)产品名称、型号或规格、产品注册号、卫生许可证号;c)“无菌”“无致热原”字样,d)“一次性使用”“用后销毁”字样:e)“包装破损禁止使用”字样;f)生产批号或日期:
g)无菌有效期。
7.1.2、外包装
a)制造厂名称、商标和地址;
12[3,4]
YY0321.2—2000
b)产品名称、型号或规格、本标准号、产品注册号、卫生许可证号;c)数置、毛重、体积(长×宽×高)d)生产批号或日期:
e)灭菌批号或日期,
)无菌有效期;
g)“一次性使用”、“无菌”字样或图形符号,h)“小心轻放”、“怕湿”等字样和标志,应符合GB191中的有关规定。7.2使用说明书wwW.bzxz.Net
7.2.1使用说明书应有下列内容:a)产品注册号、本标准号:
b)产品特点及用途:
c)使用方法及注意事项;
d)企业名称和电话、地址。
7.2.2使用说明书的编写和有关内容应符合GB9969.1中的有关规定。8包装、运输、贮存
8.1包装
8.1.1每支麻醉用针应用无毒材料密封包装。8.1.2若于数量的单包装应装入一中包装盒内。8.1.3中包装内应有使用说明书和产品合格证。8.1.4产品合格证的编写和有关内容,应符合GB/T14436中的有关规定。8.1.5若干数的中包装应装入一瓦榜纸箱内,箱内应有防潮纸或塑料袋。8.1.6其他要求应符合YY/T0313的规定。8.2运输和贮存
应符合YY/T0313—1998中第7章的规定。9其他
无菌有效期不少于2年。
A1原理
YY0321.2—2000
附录A
(标准的附录)
微粒含量测定方法
通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A2试验仪器
A2.1电阻式粒子计数器:有搅拌系统,一次取样量为2mL可同时对4μm~6μm、≥5jμm的微粒计数。
A2.2冲洗液:质盘浓度为9g/L的氯化钠溶液。A2.3100mL注射器。
A3步骤
用注射器吸取60mL冲洗液,注人计数器的取样杯中即得本底液,测定60mL本底液中的微粒A3.1
注,试验应避免环境污染。
A3.2重复A3.1步骤,以三次计数的平均值为60mL本底液中的微粒含盘。A3.3用注射器吸取60mL冲洗液,装上被测的穿刺针,注人计数器的取样杯中即得洗脱液,测定60mL洗脱液中的微粒数。
A4结果表示
洗脱液与本底液微粒读数之差除以2为洗脱液中的微粒含量(个/mL)。版权专有侵权必究
书号:155066:2-13639
科日566-517
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 医药行业标准(YY)
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0475-2011 干化学尿液分析仪
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY0476-2004 眼内冲洗灌注液
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0781-2010 血压传感器
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T1574-2017 组织工程医疗器械产品海藻酸盐凝胶固定或微囊化指南
- YY/T1268-2015 环氧乙烷灭菌的产品追加和过程等效
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2