- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0167-1998 非吸收性外科缝线
标准号:
YY 0167-1998
标准名称:
非吸收性外科缝线
标准类别:
医药行业标准(YY)
标准状态:
已作废-
实施日期:
2002-05-01 -
作废日期:
2006-06-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
237.46 KB
中标分类号:
医药、卫生、劳动保护>>医疗器械>>C48医用卫生用品
部分标准内容:
备案号:2024—1998
中华人民共和国医药行业标准
YY 0167—1998
技五安
系迎#Q7990585
非吸收性外科缝线
Nonabsorbablesurgicalsuture
1998-08-27发布
国家药品监督管理局发布
1998-10-01实施
YY0167--1998
本标准参照了美国药典23版中的相关内容。对非吸收性外科缝线的线径、抗张强度、针线连接强度及褪色试验的规定等同于美国药典23版。与美国药典23版相比,增加了外观的要求,并对缝线规定了生物学评价试验
本标准与YY0167-94相比,扩大了标准的适用范围,按照美国药典23版,对非吸收外科缝线重新进行了分类,增加了针线连接强度及无菌检查的要求。本标准从实施之日起,同时代替YY0167—94。本标准由国家药品监督管理局医疗器械标准化技术归口单位归口。本标准起草单位:强生(中国)医疗器材有限公司。本标准主要起草人,马文忠、陈华。本标准于1989年6月首次发布,1994年11月第一次修订。1范围
中华人民共和国医药行业标准
非吸收性外科缝线
Nonabsorbable surgical sutureYY0167-1998
代替YY0167-94
本标准规定了非吸收性外科缝线的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输、贮存。
本标准适用于在医疗手术中用于人体组织缝合、结扎的非吸收性外科缝线(以下简称缝线)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-90包装储运图示标志
GB9737--88化学试剂易碳化物质测定通则GB9969.1-1998工业产品使用说明书总则GB/T14436—93工业产品保证文件总则GB/T16175--1996医用有机硅材料生物学评价试验方法GB/T16886.1-1997医疗器械生物学评价第1部分:试验选择指南GB/T16886.3—1997医疗器械生物学评价第3部分:遗传毒性,致癌性和生殖毒性试验中华人民共和国药典1995年版
3分类
缝线的分类见表1。
表1缝线的分类
蚕丝、合成纤维
单股/多股
无涂层/有涂层
(涂层不影响粗细度)
天然纤维、合成纤维
单股/多股
有涂层
(涂层影响粗细度,不影响强度)注:合成纤维是指聚酯、桑酰胺6、酰胺6/6及丙烯类材料。3.2缝线规格与线径见表2。
3.3缝线分带缝针与不带缝针两种。国家药品监督管理局1998-08-27批准类
单股/多股
1998-10-01实施
4要求
4.1外观
YY0167-1998
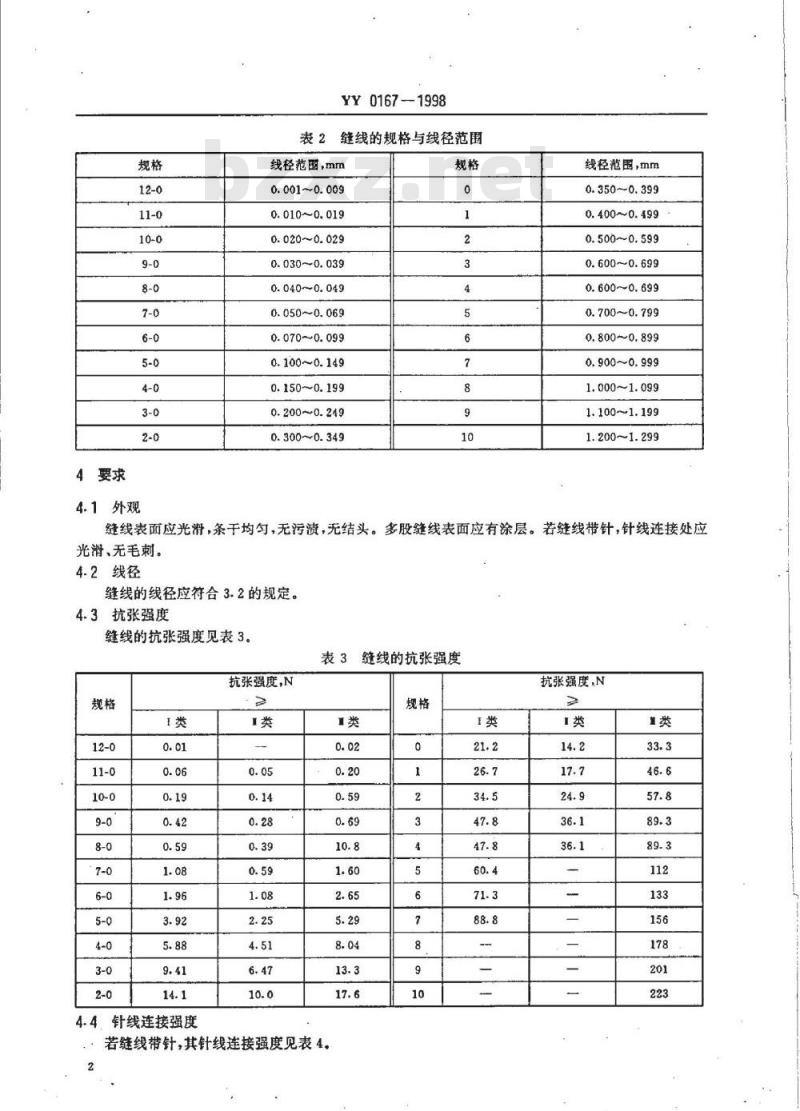
表2缝线的规格与线径范围
线径范围,mm
0.001~0.009
0.010~0.019
0.020~0.029
0.030~0.039
0.040~0.049
0.050~0.069
0.0700.099
0.100~0.149
0.150~0.199
0.200~0.249
0.300~0.349
线径范围,mm
0.350~0.399
0.400~0.499
0.500~0.599
0.600~0.699
0.600~0.699
0.700~0.799
0.800~0.899
0.900~0.999
1.000~1.099
1.100~1.199
1.200~1.299
缝线表面应光滑,条干均匀,无污溃,无结头。多股缝线表面应有涂层。若缝线带针,针线连接处应光滑、无毛刺。
4-2线径
缝线的线径应符合3.2的规定。
4.3抗张强度
缝线的抗张强度见表3。
表3缝线的抗张强度
抗张强度,N
4.4针线连接强度
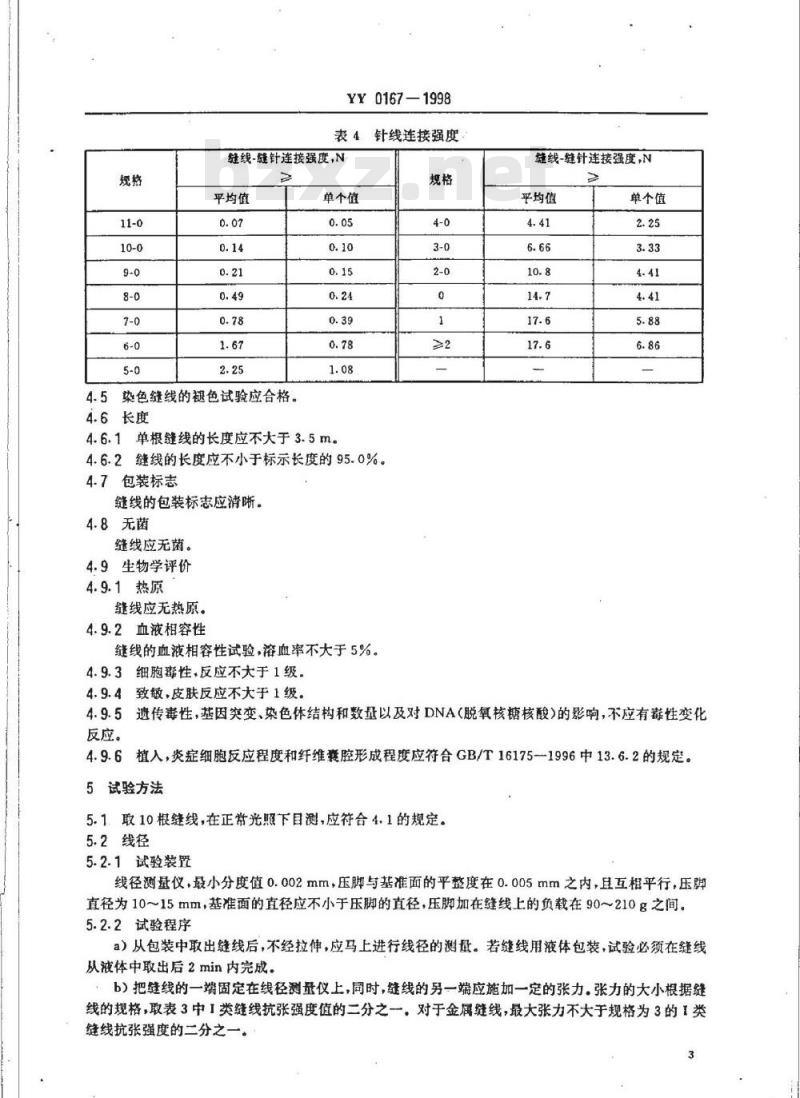
若缝线带针,其针线连接强度见表4。1类
抗张强度,N
YY 0167—1998
针线连接强度
缝线-缝针连接强度,N
平均值
4.5染色缝线的褪色试验应合格。4.6长度
单个值
4.6.1单根缝线的长度应不大于3.5m。4.6.2缝线的长度应不小于标示长度的95.0%。4.7包装标志
缝线的包装标志应清晰。
4.8无菌
缝线应无菌。
4.9生物学评价
4.9.1热原
缝线应无热原。
4.9.2血液相容性
缝线的血液相容性试验,溶血率不大于5%。4.9.3细胞毒性,反应不大于1级。4.9.4致敏,皮肤反应不大于1级。规格
缝线-缝针连接强度,N
平均值
单个值
4.9.5遗传毒性,基因突变、染色体结构和数量以及对DNA(脱氧核糖核酸)的影响,不应有毒性变化反应。
4.9.6植人,炎定细胞反应程度和纤维囊腔形成程度应符合GB/T16175--1996中13.6.2的规定。5试验方法
5.1取10根缝线,在正常光照下目测,应符合4.1的规定。5.2线径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的平整度在0.005mm之内,且互相平行,压脚直径为10~15mm,基准面的直径应不小于压脚的直径,压脚加在缝线上的负载在90~210g之间5.2.2试验程序
a)从包装中取出缝线后,不经拉伸,应马上进行线径的测量。若缝线用液体包装,试验必须在缝线从液体中取出后2min内完成。
b)把缝线的一端固定在线径测量仪上,同时,缝线的另一端应施加一定的张力。张力的大小根据缝线的规格,取表3中1类缝线抗张强度值的二分之一。对于金属缝线,最大张力不大于规格为3的1类缝线抗张强度的二分之一。
YY0167--1998
c)使线径测量仪的压脚,轻轻地落在缝线上,测量每根缝线约四分之一、二分之一,四分之三长度的三个点处的线径。如果测量的缝线是规格大于3-0的编织缝线,应把缝线转过90°,再次测量这三个点,对每一点取两次测量的平均值,作为该点的线径,d)取10根缝线,按a)、b)、c)的程序测定。5.2.3试验结果说明
比较缝线每一点的线径,应不小于上一个较小规格线径范围的中间值,不大于下一个较大规格线径范围的中间值,线径的平均值应符合4.2的规定。5.3抗张强度
5.3.1试验设备
材料试验机。
5.3.2试验条件
拉伸速度为300mm/min,试验标距为100mm。5.3.3试验程序
取长约200mm的样品,打一个自由结,将样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧。对于规格小于8-0的缝线以及规格大于2-0的类缝线应不打结,直接进行试验。共取10根缝线,进行试验。
5.3.4试验结果说明
比较单根缝线的抗张强度,应不小于表3中规定值的二分之一。抗张强度的平均值应符合4.3的规5.4针线连接强度
5.4.1试验设备及条件
同5.3.1、5.3.2。
5.4.2试验程序
把带有缝针的缝线的针端和线端分别夹于材料试验机的两个夹具上,并使夹具间的缝线绷紧,进行试验。共取5根缝线进行针线连接强度的试验。5.4.3试验结果说明
针线连接强度的单个值及平均值应符合4.4的规定。5.5褪色试验
5.5.1标准比色液的配制
按照GB9737-88中4.2、4.3、4.4的规定,配制氰化钻、硫酸铜、氟化铁三种溶液,然后按照表5的规定配制各种颜色的标准比色液。表5标准比色液
黄棕色
粉红色
蓝绿色
紫红色
每10mL标准比色液中含有
硫酸铜(CuSO,)溶液氯化钻(CoCl)溶液0
氨化铁(FeCl)溶液
蒸馏水
5.5.2称取0.25g缝线,置于100mL锥形瓶,加25mL蒸馅水,用三角漏斗盖住瓶口,加热,并使其沸腾15min,在加热时,应防止水分烧干。冷却后,取出缝线,把溶液补充到25mL。5.5.3取10mL溶液,倒入比色管中,根据溶液颜色选取对应的标准比色液,在相同条件下比较。试验溶液颜色应不深于相应标准比色液的颜色,则符合4.5的规定。5.6长度
YY0167--1998
将缝线平稳地放置在平坦的平面上,缝线不带张力时,用通用长度量具,测量5根缝线的长,应符合4.6的规定。
5.7包装标志
目力观察中包装及小包装的标志,应符合4.7的规定。5.8无菌检查
按照《中华人民共和国药典》1995年版“无菌检查法”规定执行。无菌检查应符合4.8的规定。5.9生物学评价
5.9.1热原试验
按照GB/T16175—1996中第12章的要求进行试验,应符合4.9.1的规定。5.9.2血液相容性试验
按照GB/T16175-1996中第11章的要求进行试验,应符合4.9.2的规定。5.9.3细胞毒性试验
按照GB/T16175—1996中第4章的要求进行试验,应符合4.9.3的规定。5.9.4致敏试验
按照GB/T16175一1996中第5章的要求进行试验,应符合4.9.4的规定。5.9.5遗传毒性试验
按照GB/T16886.3—1997中第4章的要求进行试验,应符合4.9.5的规定,5.9.6植入试验
按照GB/T16175—1996中第13章的要求进行试验,应符合4.9.6的规定。6检验规则
6.1缝线应由制造厂技术检验部门进行检查,并保证产品质量符合本标准的要求。6.2组批
一个检验批可由一个生产批构成:这些生产批是在基本相同的材料、工艺、设备等条件下制造出来的,若干个生产批构成一个检验批时,必须是在同一次灭菌条件下生产的产品。6.3出厂检验
6.3.1产品出厂时的检验项目及抽样方法见表6。表6检验项目及抽样量
检验项目
样品盘
1共应抽取30根、0.25g及7个小包装的样品。2在检查其他项目时,同时检查4.7。6.3.2判定规则
7个小包装
检验中,每一个检验项目均应合格。若出现不合格,则抽取不合格项目的双倍样品,进行重复检验,应全部合格。若发现一项检验不合格,则判为该批产品不合格。6-4型式检验
6.4.1在下列情况下应进行型式检验:a)新产品投产前(包括老产品转厂生产);b)连续生产中每年不少于一次;c)间隔半年以上再投产时,
d)在设计、工艺或材料有重大改变时,YY0167-1998
e)国家质量监督检验机构对产品质量进行监督检查时。6.4.2型式检验的检验项目及抽样方法同出厂检验。在下列任一情况下,应增加4.9的规定,进行生物学评价(无下列情况可以豁免)。a)制造产品所用材料来源或技术条件改变时;b)产品配方、工艺、初级包装或灭菌改变时:c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时产生副作用。6.4.3型式检验的判定规则同6.3.2。7标志、使用说明书
7.1标志
7.1.1小包装应有下列标志:
a)产品名称、制造材料和规格、结构、数量,如果使用液体包装,注明包装液的组分;b)灭菌方法及有效日期;
c)生产日期
d)制造厂名称和商标,
e)产品有关批准文号;
f)使用说明。
7.1.2中包装应有下列标志:
a)制造厂商、包装商或经销商的名称、地址,b)产品名称、商标、规格和数量:c)产品有关批准文号,bzxZ.net
d)注明灭菌方法,
e)生产日期或有效日期。
7.1.3大包装应有下列标志:
a)产品名称、商标、规格和数量;b)制造厂商、包装商或经销商名称和地址;c)产品有关批准文号、产品标准号d)出厂批号:
e)注明灭菌方法和灭菌日期、灭菌合格证和有效期,f)“怕湿”“怕热”字样或标志。7.1.4包装、贮运图示标志应符合GB191的有关规定。7.2使用说明书
7.2.1使用说明书中应包含有下列内容:a)生产厂名称及地址,缝线有关批准文号:b)缝线的使用范围及有关注意事项特殊操作说明和特殊贮存、管理要求,c)应注明“次性使用”、“不可重复灭菌”、灭菌方法和有效期;d)缝线的性能、制造材料和构造,可能带来的副作用,e)保证缝线正确、安全使用的要求,丢弃的缝线的处理要求;f)缝线与其他器械配套使用时的注意事项;6
YY 0167-1998
名)应注明“在最小包装破损时,即丢弃不得使用”;h)用液体包装的缝线应注明液体组分;i)缝线在使用过程中出现意外,如断裂时,应采取的措施及注意事项;i)产品标准中规定的应具有的内容说明。7.2.2使用说明书的编写应符合GB9969.1的规定。8包装、运输、贮存
8.1包装
8.1.1小包装应是供一次性使用的最小包装。经过灭菌处理的产品可以用干法贮存,也可用液体包装,所存放的包装容器、盒子应当设计合理,能够保持产品的无菌性,直至包装开封。8.1.2中包装是提供检验和销售的最小包装单位。8.1.3产品的包装中,应有下列文件:a)使用说明书;
b)产品合格证或质保证书,产品合格证的编写应符合GB/T14436的规定。8.2运输
产品在运输时应防止重压、阳光直射和雨水淋湿,或应按照订货合同规定。8.3贮存
产品应贮存在阴凉、干燥、清洁、通风良好、无腐蚀性气体的环境中。8.4有效期
在正常存条件下,灭菌缝线有效期应不小于3年。中华人民共和国医药
行业标准
非吸收性外科缝线
YY0167—1998
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:68522112
中国标准出版社皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16印张3/4字数14千字1999年1月第一版1999年1月第一次印刷印数1-800
标目360—53
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY 0167—1998
技五安
系迎#Q7990585
非吸收性外科缝线
Nonabsorbablesurgicalsuture
1998-08-27发布
国家药品监督管理局发布
1998-10-01实施
YY0167--1998
本标准参照了美国药典23版中的相关内容。对非吸收性外科缝线的线径、抗张强度、针线连接强度及褪色试验的规定等同于美国药典23版。与美国药典23版相比,增加了外观的要求,并对缝线规定了生物学评价试验
本标准与YY0167-94相比,扩大了标准的适用范围,按照美国药典23版,对非吸收外科缝线重新进行了分类,增加了针线连接强度及无菌检查的要求。本标准从实施之日起,同时代替YY0167—94。本标准由国家药品监督管理局医疗器械标准化技术归口单位归口。本标准起草单位:强生(中国)医疗器材有限公司。本标准主要起草人,马文忠、陈华。本标准于1989年6月首次发布,1994年11月第一次修订。1范围
中华人民共和国医药行业标准
非吸收性外科缝线
Nonabsorbable surgical sutureYY0167-1998
代替YY0167-94
本标准规定了非吸收性外科缝线的分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输、贮存。
本标准适用于在医疗手术中用于人体组织缝合、结扎的非吸收性外科缝线(以下简称缝线)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-90包装储运图示标志
GB9737--88化学试剂易碳化物质测定通则GB9969.1-1998工业产品使用说明书总则GB/T14436—93工业产品保证文件总则GB/T16175--1996医用有机硅材料生物学评价试验方法GB/T16886.1-1997医疗器械生物学评价第1部分:试验选择指南GB/T16886.3—1997医疗器械生物学评价第3部分:遗传毒性,致癌性和生殖毒性试验中华人民共和国药典1995年版
3分类
缝线的分类见表1。
表1缝线的分类
蚕丝、合成纤维
单股/多股
无涂层/有涂层
(涂层不影响粗细度)
天然纤维、合成纤维
单股/多股
有涂层
(涂层影响粗细度,不影响强度)注:合成纤维是指聚酯、桑酰胺6、酰胺6/6及丙烯类材料。3.2缝线规格与线径见表2。
3.3缝线分带缝针与不带缝针两种。国家药品监督管理局1998-08-27批准类
单股/多股
1998-10-01实施
4要求
4.1外观
YY0167-1998
表2缝线的规格与线径范围
线径范围,mm
0.001~0.009
0.010~0.019
0.020~0.029
0.030~0.039
0.040~0.049
0.050~0.069
0.0700.099
0.100~0.149
0.150~0.199
0.200~0.249
0.300~0.349
线径范围,mm
0.350~0.399
0.400~0.499
0.500~0.599
0.600~0.699
0.600~0.699
0.700~0.799
0.800~0.899
0.900~0.999
1.000~1.099
1.100~1.199
1.200~1.299
缝线表面应光滑,条干均匀,无污溃,无结头。多股缝线表面应有涂层。若缝线带针,针线连接处应光滑、无毛刺。
4-2线径
缝线的线径应符合3.2的规定。
4.3抗张强度
缝线的抗张强度见表3。
表3缝线的抗张强度
抗张强度,N
4.4针线连接强度
若缝线带针,其针线连接强度见表4。1类
抗张强度,N
YY 0167—1998
针线连接强度
缝线-缝针连接强度,N
平均值
4.5染色缝线的褪色试验应合格。4.6长度
单个值
4.6.1单根缝线的长度应不大于3.5m。4.6.2缝线的长度应不小于标示长度的95.0%。4.7包装标志
缝线的包装标志应清晰。
4.8无菌
缝线应无菌。
4.9生物学评价
4.9.1热原
缝线应无热原。
4.9.2血液相容性
缝线的血液相容性试验,溶血率不大于5%。4.9.3细胞毒性,反应不大于1级。4.9.4致敏,皮肤反应不大于1级。规格
缝线-缝针连接强度,N
平均值
单个值
4.9.5遗传毒性,基因突变、染色体结构和数量以及对DNA(脱氧核糖核酸)的影响,不应有毒性变化反应。
4.9.6植人,炎定细胞反应程度和纤维囊腔形成程度应符合GB/T16175--1996中13.6.2的规定。5试验方法
5.1取10根缝线,在正常光照下目测,应符合4.1的规定。5.2线径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的平整度在0.005mm之内,且互相平行,压脚直径为10~15mm,基准面的直径应不小于压脚的直径,压脚加在缝线上的负载在90~210g之间5.2.2试验程序
a)从包装中取出缝线后,不经拉伸,应马上进行线径的测量。若缝线用液体包装,试验必须在缝线从液体中取出后2min内完成。
b)把缝线的一端固定在线径测量仪上,同时,缝线的另一端应施加一定的张力。张力的大小根据缝线的规格,取表3中1类缝线抗张强度值的二分之一。对于金属缝线,最大张力不大于规格为3的1类缝线抗张强度的二分之一。
YY0167--1998
c)使线径测量仪的压脚,轻轻地落在缝线上,测量每根缝线约四分之一、二分之一,四分之三长度的三个点处的线径。如果测量的缝线是规格大于3-0的编织缝线,应把缝线转过90°,再次测量这三个点,对每一点取两次测量的平均值,作为该点的线径,d)取10根缝线,按a)、b)、c)的程序测定。5.2.3试验结果说明
比较缝线每一点的线径,应不小于上一个较小规格线径范围的中间值,不大于下一个较大规格线径范围的中间值,线径的平均值应符合4.2的规定。5.3抗张强度
5.3.1试验设备
材料试验机。
5.3.2试验条件
拉伸速度为300mm/min,试验标距为100mm。5.3.3试验程序
取长约200mm的样品,打一个自由结,将样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧。对于规格小于8-0的缝线以及规格大于2-0的类缝线应不打结,直接进行试验。共取10根缝线,进行试验。
5.3.4试验结果说明
比较单根缝线的抗张强度,应不小于表3中规定值的二分之一。抗张强度的平均值应符合4.3的规5.4针线连接强度
5.4.1试验设备及条件
同5.3.1、5.3.2。
5.4.2试验程序
把带有缝针的缝线的针端和线端分别夹于材料试验机的两个夹具上,并使夹具间的缝线绷紧,进行试验。共取5根缝线进行针线连接强度的试验。5.4.3试验结果说明
针线连接强度的单个值及平均值应符合4.4的规定。5.5褪色试验
5.5.1标准比色液的配制
按照GB9737-88中4.2、4.3、4.4的规定,配制氰化钻、硫酸铜、氟化铁三种溶液,然后按照表5的规定配制各种颜色的标准比色液。表5标准比色液
黄棕色
粉红色
蓝绿色
紫红色
每10mL标准比色液中含有
硫酸铜(CuSO,)溶液氯化钻(CoCl)溶液0
氨化铁(FeCl)溶液
蒸馏水
5.5.2称取0.25g缝线,置于100mL锥形瓶,加25mL蒸馅水,用三角漏斗盖住瓶口,加热,并使其沸腾15min,在加热时,应防止水分烧干。冷却后,取出缝线,把溶液补充到25mL。5.5.3取10mL溶液,倒入比色管中,根据溶液颜色选取对应的标准比色液,在相同条件下比较。试验溶液颜色应不深于相应标准比色液的颜色,则符合4.5的规定。5.6长度
YY0167--1998
将缝线平稳地放置在平坦的平面上,缝线不带张力时,用通用长度量具,测量5根缝线的长,应符合4.6的规定。
5.7包装标志
目力观察中包装及小包装的标志,应符合4.7的规定。5.8无菌检查
按照《中华人民共和国药典》1995年版“无菌检查法”规定执行。无菌检查应符合4.8的规定。5.9生物学评价
5.9.1热原试验
按照GB/T16175—1996中第12章的要求进行试验,应符合4.9.1的规定。5.9.2血液相容性试验
按照GB/T16175-1996中第11章的要求进行试验,应符合4.9.2的规定。5.9.3细胞毒性试验
按照GB/T16175—1996中第4章的要求进行试验,应符合4.9.3的规定。5.9.4致敏试验
按照GB/T16175一1996中第5章的要求进行试验,应符合4.9.4的规定。5.9.5遗传毒性试验
按照GB/T16886.3—1997中第4章的要求进行试验,应符合4.9.5的规定,5.9.6植入试验
按照GB/T16175—1996中第13章的要求进行试验,应符合4.9.6的规定。6检验规则
6.1缝线应由制造厂技术检验部门进行检查,并保证产品质量符合本标准的要求。6.2组批
一个检验批可由一个生产批构成:这些生产批是在基本相同的材料、工艺、设备等条件下制造出来的,若干个生产批构成一个检验批时,必须是在同一次灭菌条件下生产的产品。6.3出厂检验
6.3.1产品出厂时的检验项目及抽样方法见表6。表6检验项目及抽样量
检验项目
样品盘
1共应抽取30根、0.25g及7个小包装的样品。2在检查其他项目时,同时检查4.7。6.3.2判定规则
7个小包装
检验中,每一个检验项目均应合格。若出现不合格,则抽取不合格项目的双倍样品,进行重复检验,应全部合格。若发现一项检验不合格,则判为该批产品不合格。6-4型式检验
6.4.1在下列情况下应进行型式检验:a)新产品投产前(包括老产品转厂生产);b)连续生产中每年不少于一次;c)间隔半年以上再投产时,
d)在设计、工艺或材料有重大改变时,YY0167-1998
e)国家质量监督检验机构对产品质量进行监督检查时。6.4.2型式检验的检验项目及抽样方法同出厂检验。在下列任一情况下,应增加4.9的规定,进行生物学评价(无下列情况可以豁免)。a)制造产品所用材料来源或技术条件改变时;b)产品配方、工艺、初级包装或灭菌改变时:c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时产生副作用。6.4.3型式检验的判定规则同6.3.2。7标志、使用说明书
7.1标志
7.1.1小包装应有下列标志:
a)产品名称、制造材料和规格、结构、数量,如果使用液体包装,注明包装液的组分;b)灭菌方法及有效日期;
c)生产日期
d)制造厂名称和商标,
e)产品有关批准文号;
f)使用说明。
7.1.2中包装应有下列标志:
a)制造厂商、包装商或经销商的名称、地址,b)产品名称、商标、规格和数量:c)产品有关批准文号,bzxZ.net
d)注明灭菌方法,
e)生产日期或有效日期。
7.1.3大包装应有下列标志:
a)产品名称、商标、规格和数量;b)制造厂商、包装商或经销商名称和地址;c)产品有关批准文号、产品标准号d)出厂批号:
e)注明灭菌方法和灭菌日期、灭菌合格证和有效期,f)“怕湿”“怕热”字样或标志。7.1.4包装、贮运图示标志应符合GB191的有关规定。7.2使用说明书
7.2.1使用说明书中应包含有下列内容:a)生产厂名称及地址,缝线有关批准文号:b)缝线的使用范围及有关注意事项特殊操作说明和特殊贮存、管理要求,c)应注明“次性使用”、“不可重复灭菌”、灭菌方法和有效期;d)缝线的性能、制造材料和构造,可能带来的副作用,e)保证缝线正确、安全使用的要求,丢弃的缝线的处理要求;f)缝线与其他器械配套使用时的注意事项;6
YY 0167-1998
名)应注明“在最小包装破损时,即丢弃不得使用”;h)用液体包装的缝线应注明液体组分;i)缝线在使用过程中出现意外,如断裂时,应采取的措施及注意事项;i)产品标准中规定的应具有的内容说明。7.2.2使用说明书的编写应符合GB9969.1的规定。8包装、运输、贮存
8.1包装
8.1.1小包装应是供一次性使用的最小包装。经过灭菌处理的产品可以用干法贮存,也可用液体包装,所存放的包装容器、盒子应当设计合理,能够保持产品的无菌性,直至包装开封。8.1.2中包装是提供检验和销售的最小包装单位。8.1.3产品的包装中,应有下列文件:a)使用说明书;
b)产品合格证或质保证书,产品合格证的编写应符合GB/T14436的规定。8.2运输
产品在运输时应防止重压、阳光直射和雨水淋湿,或应按照订货合同规定。8.3贮存
产品应贮存在阴凉、干燥、清洁、通风良好、无腐蚀性气体的环境中。8.4有效期
在正常存条件下,灭菌缝线有效期应不小于3年。中华人民共和国医药
行业标准
非吸收性外科缝线
YY0167—1998
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:68522112
中国标准出版社皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16印张3/4字数14千字1999年1月第一版1999年1月第一次印刷印数1-800
标目360—53
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:


- 其它标准
- 上一篇: YY 0165-1994 热垫式治疗仪
- 下一篇: YY 0168-1994 血液冷藏箱
- 热门标准
- 医药行业标准(YY)
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0345-2002 骨接合植入物金属骨针
- YY/T0452-2003 止血钳
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY0838-2011 微波热凝设备
- YY/T0456.5-2014 血液分析仪用试剂 第5部分:网织红细胞检测试剂
- YY0672.2-2011 内镜器械 第2部分 腹腔镜用剪
- YY0062-1991 X射线管组件固有滤过
- YY/T0457.6-2003 医用电气设备 光电X射线影像增强器特性 第6部分:对比度及炫光系数的测定
- YY0476-2004 眼内冲洗灌注液
- YY0781-2010 血压传感器
- YY/T1533-2017 全自动时间分辨荧光免疫分析仪
- YY/T0179-2005 丁字式开口器
- YY0345-2002 骨接合植入物 金属骨针
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2