【YY医药标准】 ISO 14730 :2000 眼科光学接触镜护理产品 第4部分:抗微生物防腐有效性试验及测定抛弃日期指南
- YY0719.4-2009
- 现行
- 点击下载此标准
标准号:
YY 0719.4-2009
标准名称:
ISO 14730 :2000 眼科光学接触镜护理产品 第4部分:抗微生物防腐有效性试验及测定抛弃日期指南
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
2.40 MB
点击下载
标准简介:
YY 0719.4-2009/ISO 14730 :2000.Ophthalmic optics- Contact lens care products-Part 4 :Antimicrobial preservative efficacy testing and determining discard date.
YY0719的本部分规定了用于评价所有多次最防腐接触镜护理产品的抗微生物防腐作用的操作程序,并且给出了用于测定抛弃日期的指南,参见资料性附录B、附录C.附录D和附录E.
YY 0719.4可用于抛弃日期为28 d的产品。
YY 0719.4不适用于一次性使用的一次量包装无菌产品或采用物理屏障抗微生物污染的多次量容器(如气溶胶容器)。
注1:本试验的原理可用于超过28d的抛弃日期。参见附录B.附录C.附录D和附录E.
注2:多个或混合微生物和(或)接触镜内含物或其他有机物的使用能影响特殊产晶的表观抗微生物活性。对量
微生物的试验及抽取使用容器中部分样品的试验来评价其变化对发展接触镜护理产品可能是有价值的,但不在本标准的范围之内。
2规范性引用文件
下列规范性文件中的条款通过YY 0719本部分的引用而成为本部分的条款。凡是注日期的引用文件.其随后所有的更改或修订不适用于本部分。然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本部分。
YY 0719.1眼科光学接触镜护理产品 术语
YY 0719.2眼科光学接触镜护理产品 基本要求
3术语和定义
YY 0719.1中确立的术语和定义适用于YY 0719的本部分。
4原理
4.1本试验包括试验开始时用指定的微生物接入样品,14d时再接种,在规定的温度存放接种样品,在规定的时间从接种样品中取样、培养来测定活菌数。通过较长时期的活菌计数来确定产品抑制微生物再生长的能力。
4.2本试验中所用的试验菌的量并不代表实际中可能的微生物量,而是提供可计数的量来估算微生物活性降低率和程度。
4.3在试验规定的温度条件下,经数次试验后,如果接种样品中的细菌明显减少,而酵母菌和霉菌不增加,则产品的抗微生物防腐性符合要求。性能标准见5.6。
4.4在培养和计数存活菌的过程中,应采取合适的方法除去残留的抗微生物剂或使其失效,该方法的有效性应经过验证。
5试验方法
5.1 材料和试剂
5.1.1试验菌
部分标准内容:
中华人民共和国医药行业标准
YY0719.4—2009/IS014730:2000眼科光学
接触镜护理产品
第4部分:抗微生物防腐有效性试验及测定抛弃日期指南
Ophthalmic optics-Contact lens careproducts-Part 4:Antimicrobial preservative efficacy testing anddeterminingdiscarddate
(ISO 14730:2000Ophthalmicoptics-Contact lens care productsAntimicrobial preservative efficacy testing and determining discard date,IDT)2009-06-16发布
数码防信
国家食品药品监督管理局
2010-12-01实施
规范性引用文件
术语和定义
试验方法
附录A(资料性附录)
附录B(资料性附录)
附录C(资料性附录)
附录D(资料性附录)
附录E(资料性附录)
附录F(资料性附录)
膜过滤法操作程序实例
抛弃日期操作程序1
抛弃日期操作程序Ⅱ
抛弃日期操作程序Ⅲ
抛弃口期操作程序IV
其他菌种保藏机构的试验菌
TKANYKACa
YY0719.4—2009/IS014730.200012
YY0719《眼科光学接触镜护理产品》分为7个部分:第1部分:术语;
第2部分:基本要求;
第3部分:微生物要求和试验方法及接触镜护理系统;第4部分:抗微生物防腐有效性试验及测定抛弃日期指南;第5部分:接触镜和接触镜护理产品物理相容性的测定;第6部分:有效期测定指南;
第7部分:生物学评价试验方法。本部分为YY0719的第4部分。
YY0719.4—2009/IS014730:2000本部分等同采用ISO14730:2000《眼科光学接触镜护理产品抗微生物防腐有效性试验及测定抛弃日期指南》。
本部分的附录A、附录B、附录C、附录D、附录E、附录F为资料性附录。本部分由全国医用光学和仪器标准化分技术委员会(SACTC103/SC1)提出并归口。本部分起草单位:国家食品药品监督管理局杭州医疗器械质量监督检验中心。本部分主要起草人:陈靖云、虞海蓉、李家忠、马莉、何涛、齐伟明。Ⅲ
1范围
YY0719.4—2009/ISO14730:2000眼科光学接触镜护理产品
第4部分:抗微生物防腐有效性试验及测定抛弃日期指南
YYC719的本部分规定了用于评价所有多次量防腐接触镜护理产品的抗微生物防腐作用的操作程序,并且给出了用于测定抛弃日期的指南,参见资料性附录B、附录C、附录D和附录E。本部分可用于抛弃日期为28d的产品。本部分不适用于一次性使用的一次量包装无菌产品或采用物理屏障抗微生物污染的多次量容器(如气溶胶容器)。
注1:本试验的原理可用于超过28d的抛弃日期。参见附录B、附录C、附录D和附录E。注2:多个或混合微生物和(或)接触镜内含物或其他有机物的使用能影响特殊产品的表观抗微生物活性,对大量微生物的试验及抽取使用容器中部分样品的试验来评价其变化对发展接触镜护理产品可能是有价值的,但不在本标准的范围之内。
2规范性引用文件
下列规范性文件中的条款通过YY0719本部分的引用而成为本部分的条款。凡是注日期的引用文件,其随后所有的更改或修订不适用于本部分。然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本部分。YY0719.1眼科光学接触镜护理产品术语YY0719.2眼科光学接触镜护理产品基本要求3术语和定义
YY0719.1中确立的术语和定义适用于YY0719的本部分。4原理
4.1本试验包括试验开始时用指定的微生物接人样品,14d时再接种,在规定的温度存放接种样品,在规定的时间从接种样品中取样、培养来测定活菌数。通过较长时期的活菌计数来确定产品抑制微生物再生长的能力。
4.2本试验中所用的试验菌的量并不代表实际中可能的微生物量,而是提供可计数的量来估算微生物活性降低率和程度。
4.3在试验规定的温度条件下,经数次试验后,如果接种样品中的细菌明显减少,而酵母菌和霉菌不增加,则产品的抗微生物防腐性符合要求。性能标准见5.6。4.4在培养和计数存活菌的过程中,应采取合适的方法除去残留的抗微生物剂或使其失效,该方法的有效性应经过验证。
5试验方法
5.1材料和试剂
5.1.1试验菌
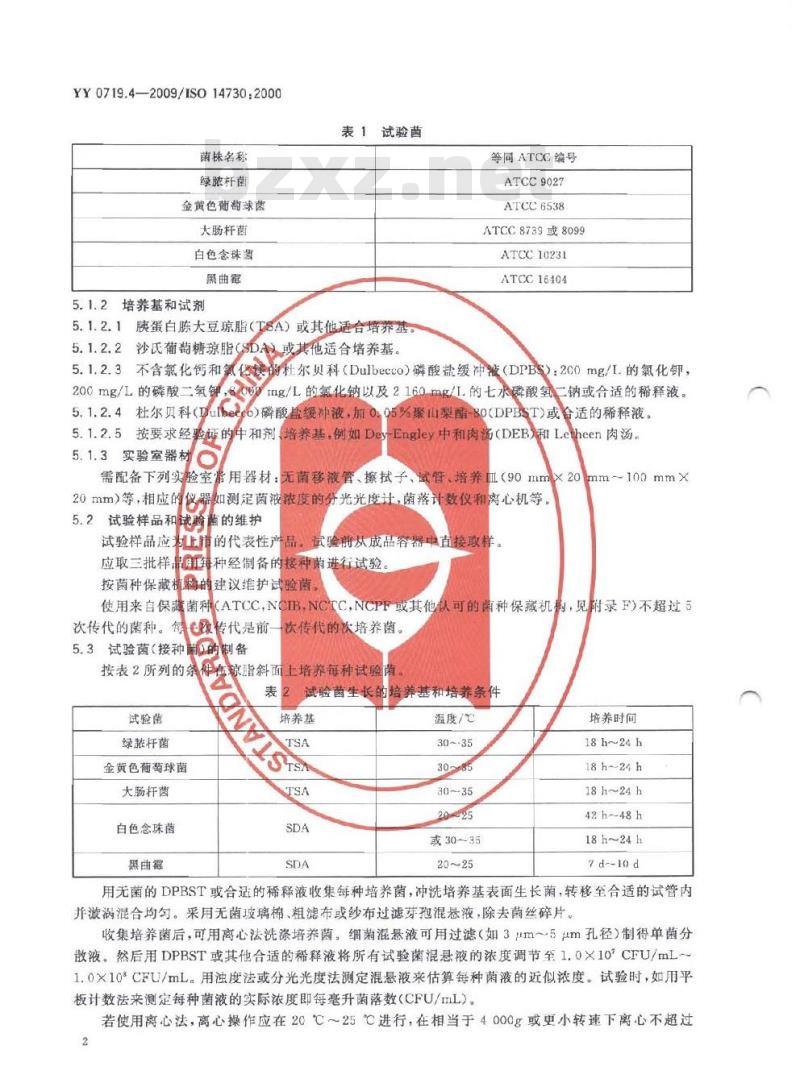
用表1所列菌株进行试验。bZxz.net
注:可使用附录F中其他菌种保藏蔽机构的试验菌。1
TKANYKACa
YY0719.4—2009/ISO14730.2000菌株名称
绿脓杆菌
金黄色葡萄辣球菌
大肠杆菌
白色念珠菌
黑曲霉
5.1.2培养基和试剂
表1试验菌
5.1.2.1胰蛋白陈大豆琼脂(T8A)或其他适合培养基5.1.2.2沙氏葡萄糖琼脂(SDA
或其他适合培养基。
等同ATCC编号
ATCC9027
ATCC6538
ATCC8739或8099
ATCC10231
ATCC16404
5.1.2.3不含氯化钙和氟化杜尔贝科(Dulbecco)磷酸盐缓冲液(DPB):200mg/L的氯化钾,200mg/L的磷酸二氢钾,800g
img/L的氯化钠以及2160mg/L的七水磷酸氢二钠或合适的稀释液。
5.1.2.4杜尔贝科(Tur%))磷酸盐缓冲液,加05%聚山梨醋8
80(DPBST)或全适的稀释液。
5.1.2.5按要求经证的中和剂、培养基,例如Dey-Engley中利肉荡(DEB)和Leheen肉汤。5.1.3实验室器材
需配备下列实验室常用器材:无菌移液管擦拭子、试管、培养皿(90mm×20mm100mm×20mm)等,相应的仪器
如测定菌校浓度的分光光度计,菌落计数仪和离心机等。5.2试验样品和比间
菌的维护
试验样品应的代表性产品。武验前从成品容器电直接取样。种经制备的接种菌进行试验。
应取三批样
按菌种保藏机的建议维护试验菌,使用来自保意菌种(ATCC,NCB,NCTC,NCPF或其他认可的菌种保藏机构,见附录F)不超过5次传代的菌种。
每专代是前
次传代的次培养菌
5.3试验菌(接种制备
按表2所列的系家脂斜面上培养每种试验菌试验菌
绿嵌杆菌
金黄色葡萄球苗
大肠杆菌
白色念珠菌
黑由霖
试验菌生长的培养基和培养条件培养基
温度/℃
30~-35
或30~35
培养时间
18h~24h
18h-24h
18h~24h
42h-48h
18h~24h
7d--10 d
用无菌的DPBST或合适的稀释液收集每种培养菌,冲洗培养基表面生长菌,转移至合适的试管内并漩涡混合均勾。采用无菌玻璃棉、粗滤布或纱布过滤芽孢混悬液,除去菌丝碎片。收集培养菌后,可用离心法洗涤培养菌。细菌混悬液可用过滤(如3μm~5um孔径)制得单菌分散液。然后用DPBST或其他合适的稀释液将所有试验菌混悬液的浓度调节至1.0×10?CFU/mL~1.0×10°CFU/mL。用浊度法或分光光度法测定混悬液来估算每种菌液的近似浓度。试验时,如用平板计数法来测定每种菌液的实际浓度即每毫升菌落数(CFU/mL)。若使用离心法,离心操作应在20℃~25℃进行,在相当于4000g或更小转速下离心不超过2
10min。
细菊和酵母菌混悬液应在制备当天使用。注1:离心时间延长要求转速更低。注2:在冷藏(2℃~8)条件下储存孢子混悬液可使用至制备后7d5.4接种试验程序
YY0719.4—2009/IS014730:20005.4.1对每批样品、每种试验菌,准备一个或多个可加入至少10mL试验溶液的试管。注:用试管而不用镜片盒,以便试验的有效技术操作。由于样品落液成分和试管材料之间可能存在不相容性,宜考患使用与落液成分相容的试管。将试验菌接入样品管,使其菌液浓度在1.0X105CFU/mL~1.0X10°CFU/mL之间。保证接种菌的体积不超过样品体积的1%。充分混合使接种菌完全分散。5.4.2在2025℃存放接种样品。监测存放温度并作记录。若产品对光敏感,试验过程宜避光操作。5.4.3在7d和14d时,取1.0mL接种样品测定活菌数。5.4.414d取样后,按5.4.1步骤,对每个样品进行再接种,使菌液浓度为1.0X10CFU/mL~1.0×10CFU/mL.
5.4.5在21d和28d时,取1.0mL接种样品测定活菌数。5.4.6在规定的时间,吸取1.0mL样品,移人经验证的中和培养基中进行系列10倍稀释。用漩涡方式使混基液充分混匀,然后静置使中和完全。中和条件基于恢复生长培养基对照试验(见5.5.2)。若样品中的抗微生物剂未充分失效或被中和,则用经验证的膜过滤法除去(见附录A)。5.4.7对合适的稀释液,用恢复生长培养基(如细菌用TSA,霉菌和酵母菌用SDA)制备的平板来测定活菌数,重复3次(除另有规定)。如果用膜过滤方法除去或中和抗微生物剂,将滤膜放置在相应的培养基上进行培养。如果用倾倒平板的方法,保持倾倒前的琼脂低于50℃。注:必要时,用于测定活菌数的琼脂培养基也可含有抗菌失效剂或中和剂。5.4.8在30~35℃培养细菌恢复生长平板;在20℃~25℃或30℃~35℃培养酵母菌恢复生长平板;在20~25培养霉菌恢复生长平板。细菌、酵母菌和霉菌的最佳恢复生长的培养时间应确定。最短培养时间基于恢复生长培养基对照试验(见5.5.2),记录在平板上观察到的活菌数(CFU)培养期间应定时地观察平板以防出现由于过度生长而无法计数的现象。5.4.9确定可计数平板上的平均菌落数。计算在规定时间点的微生物减少值。注:可计数平板指细菌和酵母菌为30CFU/皿~300CFU/皿,霉菌为8CFU/血~80CFU/m,仅在100或10-的稀释级平板上观察到的除外。
5.4.10在某一试验时间点,当所有样品稀释级的平板上没有菌落生长时,如用“0\或“NR\(没有恢复生长来记录微生物没有生长。
5.4.11计算每个时间点存活菌的浓度。14d再接种后的活菌浓度为再接人的菌浓度和14d时存活菌浓度之和。
5.5对照试验
5.5.1接种菌对照
通过将等量的接种菌接人如5.4.1所用的相同体积的适当的稀释液中,使菌液浓度达到:初次接种时为1.0×10CFU/mL~1.0×10°CFU/mL,再接种时为1.0×10*CFU/mL~1.0×10sCFU/mL,来计算初次和再接种时接种菌浓度。接种菌的体积不超过溶液体积的1%。充分混合使接种菌完全分散。在试验开始时估算对照溶液的每毫升菌落数(CFU/mL)为了证明用于试验菌生长的培养基的适用性,并用来推算初始接种菌浓度。从每个试管中吸取适量涂布在恢复生长琼脂平板上,重复三次(除另有规定)。
TYKANTKAc
YY0719.4—2009/ISO14730:20005.5.2恢复生长培养基对照
将防腐产品以1/10比例稀释至验证过的中和肉汤中混匀(1mL防腐产品加人9mL中和肉汤中)。将混合液静置,使中和作用完全。准备第二支对照管,加入10mL适合的稀释液(如DPBST)。将适量试验菌接入上述试管中使每个平板接种菌为10CFU~100CFU。在环境温度下培养适当时间。从每个试管中吸取适量溶液涂布至恢复生长琼脂平板上,重复三次(除另有规定)。在30℃~35℃培养细菌恢复生长平板:在20℃~25℃或30℃~35℃培养酵母菌恢复生长平板:在20℃~25℃培养霉菌恢复生长平板。确定细菌,酵母菌和霉菌的最佳恢复生长的最短培养时间。
检查中和肉汤中的恢复生长菌数至少是第二支对照管恢复生长菌数的50%。对每种试验菌均应进行此对照试验。
如果中和作用所需的稀释比例大于1/10,则应使用膜过滤法。试验开始和必要时,用每种试验菌验证样品的中和作用。5.6性能标准
5.6.1概要
产品在其标示的有效期和弃日期内应能符合该标准。符合5.6.2和5.6.3标准的产品,证明其开封后使用28d是有效的(抛弃日期)注:若抛弃日期超过28d,参考附录B、附录C、附录D和附录E建议的方法。5.6.2细菌
在14d,每种试验菌每毫升恢复生长菌数平均减少值不少于3.Clog5。14d再接种后,在28d,每种试验菌的浓度应再减少,平均减少值至少3.0log5。5.6.3霉菌和酵母菌
在14天,每种试验菌每毫升恢复生长菌数应保持或低于其初始浓度(实验误差在士0.5logs内):在28天,每种试验菌的浓度应保持或低于再接种后各试验菌的浓度(实验误差在士0.51ogs内)。5.7试验报告
试验报告应包括:
a)标准名称;
b)产品信息,包括:
——产品名称;
—批号;
有效期;
—制造商;
一储存条件:
一活性物质及其浓度(若可用的);操作者姓名:
试验方案的偏离;
培养日期和时间;
接种样品的存放时间;
试验结果,包括每个试验时间点微生物恢复生长数。g)
A.1材料和试剂
A.1.1培养基和试剂
稀释液,含或不含中和剂。
附录A
(资料性附录)
膜过滤法操作程序实例
A.1.1.2胰蛋白陈大豆琼脂(TSA)或其他适合培养基。YY0719.4—2009/IS014730.2000A.1.1.3不含氟化钙和氯化镁的杜尔贝科(Dulbecco)磷酸盐缓冲液(DPBS):200mg/LKCl200mg/LKH,PO,8000mg/LNaCl和2160mg/LNazHPO,-7H,O或合适的稀释液。A.1.1.4杜尔贝科(Dulbecco)磷酸盐缓冲液,加0.05%聚山梨酯-80(DPBST)或合适的稀释液。A.1.1.5按要求经验证的中和剂、培养基,例如Dey-Engley中和肉汤(DEB)和Letheen肉汤。A.1.2试验器材
常用的实验室器材(如无菌移液管、培养血和容器等)和下列装备。A.1.2.1、无菌滤膜。
A.1.2.2带无菌滤膜和过滤器的无菌装置。A,1.2.3相应的真空或压力装置,使接种试验溶液无菌地通过滤膜。滤膜的孔径不大于0.45um,滤膜直径至少47mm,且不含对微生物有毒的化学物质,A.2试验方法和结果
A.2.1用无菌DPBST(A.1.1.4)或合适的稀释液,将无菌过滤器装置(A.1.2.2)内的无菌德膜(A,1.2.1)湿润。
A.2.2无菌地将一定体积的接种试验溶液移人无菌DPBST(A,1.1.4)或稀释液中。A.2.3将稀释液转移至滤器,借助真空或压力立即过滤。用50ml~100mL稀释液稀释滤膜上的样品,充分混匀确保样品在整个滤膜上均匀分布。注:本步骤可减少多个菌落聚集在滤膜同一位置上的可能性。A.2.4用稀释液的数倍体积冲洗滤膜,必要时稀释液中可添加中和剂。对每种试验菌每个配方可凭经验决定实际体积。
注:通常,稀释敏的三倍体积(每次100mL)对除去和(或)稀释抗微生物剂是足够的。A.2.5用合适的培养基培养滤膜,使菌落生长在滤膜表面。注:从滤过装置上无菌地转移滤膜,并将滤膜放置在表面无明显液体的无菌琼脂平板上,或将滤膜封人琼脂层中。或者,将无菌培养基添加到封闭的过滤器中的滤膜上,原位培养滤膜。试验时使用适合试验菌生长的培养基。培养时间应确定。
A.2.6测定可计数滤膜上的平均菌落数(细菌和酵母菌:3CFU/47mm~100CFU/47mm;菌:3CFU/47mm~10CFU/47mm)。计算并记录接种液的每毫升菌落数(CFU/mL)。A.3对照试验
将一定量未接种的试验溶液移入50mL100mL的无菌稀释液中,试验溶液和稀释液之间的体积比与上述相同,来验证中和剂的有效性。用真空或压力对所有溶液进行过滤。用稀释液的数倍体积冲洗滤膜,稀释液的体积与上述试验步骤所用的相同。将5CFU~100CFU试验菌(每个滤膜一种菌)转人100mL稀释液中并过滤。按试验步骤(见A.2.5)用接触培养基的方法培养滤膜。5
TKANTKACa
YY0719.4—2009/1S014730.2000用不含试验溶液的稀释液重复该步骤。用合适的稀释液(例如DPBST)代替试验溶液,用相同方法,比较其菌落数。用相应培养基来确定接种菌数,重复三次(除另有规定)。保证中和肉汤滤膜上恢复生长菌数至少为接种菌数的50%。B.1原理
附录B
(资料性附录)
抛弃日期操作程序I
YY0719.4--2009/IS014730.2000B.1.1本试验包括在试验开始(0d)时用高浓度试验菌(约10\CFU/mL)接种试验样品,之后用低浓度试验菌(大约10°CFU/mL)再接种试验样品。B.1.2接种次数为:试验开始、2周、建议的抛弃日期的25%.50%、75%和100%。B.1.3取样次数包括:1周、2周、3周、4周,建议的抛弃日期的25%、50%、75%和100%,及建议的抛弃日期后的14d。
B.1.4在28d,试验样品应符合多次量防魔接触镜护理产品的防腐有效性的试验标准。B.1.5再接种后出现生长停滞。
B.2试验方法
B.2.1材料和试剂
B.2.1.1试验菌
试验菌详见5.1.1。
B.2.1.2试验培养基
试验培养基详见5.1.2。
B.2.1.3实验室器材
实验室器材详见5.1.3。
B.2.1.4试验样品
用三批上市的代表性的接触镜护理溶液进行试验,用以验证开封后的抛弃日期。试验菌的维护详见5.2。
B.2.2试验菌(接种菌)的制备
试验菌的培养和收集详见5.3。
B.2.3接种试验程序
B.2.3.1从单个样品中取样,准备一个体积大于250mL的混合样。B.2.3.2每种试验菌分别准备50mL样品,将样品移至250mL的合适的容器中。B.2.3.3准备50mL稀释液的容器用以细菌、酵母菌和霉菌的对照试验B.2.3.4用0.5mL浓度为10*CFU/mL试验菌液接人样品和对照中,使菌液浓度达到约10°CFUmL。充分混合确保接种菌完全分散。B.2.3.5在20℃~25℃存放接种样品。监测存放温度并作记录。若产品对光敏感,试验过程宜避光操作。
B.2.3.6分别在试验的1周、2周、3周、4周,抛弃日期的25%,50%、75%和100%及抛弃日期后的14d,取1.0mL接种样品来测定活菌数。B.2.3.7在试验的2周,抛弃日期的25%、50%、75%和100%,按0.05mL/50mL的比例,用浓度为10°CFU/mL的试验菌液再接种样品,使菌液浓度大约为10°CFU/mL。在每个试验时间点再接种前,测定活菌数。
B.2.3.8在规定的时间,吸取1.0mL样品,移入经验证的中和培养基中进行系列10倍稀释。用漩涡方式使混悬液充分混匀,然后静置使中和完全。7
TKANTKACa
YYD719.4—2009/IS014730:2000如果配方中的抗微生物剂未充分失效或被中和,则用经验证的膜过滤法除去(见附录A)。B.2.3.9对合适的稀释液,用恢复生长培养基(如细菌用TSA,霉菌和醉母菌用SDA)制备的平板来测定活菌数,重复三次(除另有规定)。如果用膜过滤方法除去或中和抗微生物剂,将滤膜放置在相应的培养基上进行培养。如果用倾倒平板的方法,保持倾倒前的琼脂低于50℃。注:必要时,用于测定活菌数的琼胎培养基也可含有抗菌失效剂或中和剂。B.2.3.10在30℃~35℃培养细菌恢复生长平板:在20℃~25℃或30℃~35℃培养酵母菌恢复生长平板;在20℃~25℃培养霍菌恢复生长平板。细菌、酵母菌和菌的最佳恢复生长的培养时间应确定。最短培养时间基手恢复培养基对照试验(见B.2.4.2)。B.2.3.11确定可计数平板上的平均菌落数。计算在规定时间点的微生物减少值。注:可计数平板指细菌和酵母菌为90CFU/Ⅲ~300CFU/Ⅱ,霉菌为8CFU/Ⅲ~80CFU/皿,仅在10°或10-的稀释级平板上观察到的除外。
B.2.3.12在某一试验时间点,当所有样品稀释级的平板上没有微生物生长时,应作记录。B.2.3.13计算每个时间点存活菌的浓度。B.2.4对照试验
B.2.4.1接种菌对照
每次接种样品时,都要重新进行对照试验,用试验菌液接人盐溶液(对细菌和酵母菌)或盐/Twccn1>80溶液(对等菌),与样品接种方法相同,用最近一次接种菌数和样品中存活菌数之和算出样品中的理论菌数。
B.2.4.2恢复生长培养基对照
将防腐产品以1/10比例稀释至验证过的中和肉汤中混匀(1mL防腐产品加入9mL中和肉汤中)。将混合液静置,使中和作用完全。准备第二支对照管,加人10mL适合的稀释液(如DPBST)。将适量试验菌接人上述试管中使每个平板接种菌为10CFU~1C0CFU。在环境温度下培养适当时间。从每个试管中吸取适量溶液涂布至恢复生长琼脂平板上,重复三次(除另有规定)。在30℃~35C培养细菌恢复生长平板:在20C~25C或30℃~35℃培养醇母菌恢复生长平板,在20℃~25℃培养霉菌恢复生长平板。确定细菌、酵母菌和霉菌的最佳恢复生长的最短培养时间。
检查中和肉汤中的恢复生长菌数至少是第二支对照管恢复生长菌数的50%。对每种试验菌均应进行此对照试验。
如果中和作用所需的稀释比例大于1/10,则应使用膜过滤法。试验开始和定期地验证样品的中和作用。B.2.5性能标准
在14d,若细菌的存活数减少3log5。14d之后的每个试验时间点,细菌和真菌的存活数不增加,则该产品的抛弃日期合格。
B.2.6试验报告
试验报告详见5.7。
1)Tween是适用商品的例子,该信息为本标准使用者提供方便并不对该产品进行规定。2)在土0.5log偏差范围内,试验样品中恢复生长的菌数不超过接种菌数与接种前存活菌数之和(即未出现微生物增殖)。
附录C
(资料性附录)
抛弃日期操作程序Ⅱ
YY0719.4—2009/IS014730.2000C.1.1本试验包括用指定的微生物接人样品,在规定的温度存放接种样品,在规定的时间取样并对其进行活菌计数。通过较长时期的活菌计数来确定产品抑制微生物再生长的能力。C.1.2本试验中所用的试验菌的量并不代表实际中可能的微生物量,而是提供可计数的量来估算微生物活性降低率和程度
C.1.3样品在开始时和经预期的施弃日期模拟使用后应符合防腐接触镜护理产品的要求(性能标准见C.2.7)。
C.1.4在培养和计数存活菌的过程中,应采取合适的方法除去留的抗微生物剂或使其失效,该方法的有效性应经过验证。试验时应进行相应的对照试验。C.2试验方法
C.2.1材料和试剂
C.2.1.1试验菌
试验菌详见5.1.1。
C.2.1.2试验培养基
试验培养基详见5.1.2。
C.2.1.3实验室器材
实验室器材详见5.1.3。
C.2.1.4试验样品
取上市的具有代表性的三批样品,试验前从成品容器中直接取样。应取一定数量的样品确保模拟使用后有足够的样品用于接种试验(即:几个样品可以共用以提供足够的样品用于试验)。试验菌的维护详见5.2。
C.2.2试验菌(接种菌)的制备
试验菌的培养和收集详见5.3。
C.2.3接种试验程序
C.2.3.1对每种试验菌,准备一个可加人至少10mL试验溶液的试管。将试验菌接入样品管,使其菌液浓度在1.0×105CFU/mL~1.0×10°CFU/mL之间。保证接种菌的体积不超过样品体积的1%。充分混合使接种菌完全分散。
C.2.3.220℃~25℃存放接种样品。监测存放温度并作记录。若产品对光敏感,试验过程宜避光操作。C.2.3.3在7d和14d时,取1.0mL接种样品测定活菌数。C.2.3.414d取样后,按C.2.3.1步骤,对每个样品进行再接种,使菌液浓度为1.0×10CFU/mL~1.0X10CFU/mL.
C.2.3.5在21d和28d时,取1.0mL接种样品测定活菌数。C.2.3.6规定的时间,吸取1.0mL样品,移人经验证的中和培养基中进行系列10倍稀释。用漩涡方式使混悬液充分混匀,然后静置使中和完全。中和条件基于恢复生长培养基对照试验。若样品中的抗微生物剂未充分失效或被中和,则用经验证的膜过滤法除去(见附录A)。9
TKANTKACa
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY/T1096-2007 温度生物反馈仪
- YY0778-2010 射频消融导管
- YY/T0915-2015 ISO 27020:2010 牙科学正畸用托槽和颊面管
- YY0165-1994 热垫式治疗仪
- YY/T0609-2018 医用诊断X射线管组件通用技术条件
- YY/T0606.14-2014 组织工程医疗产品 第14部分:评价基质及支架免疫反应的试验方法:ELISA法
- YY/T0591-2011 骨接合植入物 金属带锁髓内钉
- YY/T0890-2013 放射治疗中电子射野成像装置性能和试验方法
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0708-2009 IEC 60601-1-4 :2000 医用电气设备 第1-4部分:安全通用要求并列标准:可编程医用电气系统
- YY/T0454-2003 无菌塑柄手术刀
- YY0053-2008 心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器
- YY/T1137-2017 骨锯通用技术条件
- YY/T1555.1-2017 硅凝胶填充乳房植入物专用要求硅凝胶填充物性能要求 第1部分:易挥发性物质限量要求
- YY/T0859-2011 均匀径向载荷下金属血管支架有限元分析方法指南
- 行业新闻
网站备案号:湘ICP备2025141790号-2