- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0256-1997 湿法混合制粒机
标准号:
YY 0256-1997
标准名称:
湿法混合制粒机
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
4.50 MB
相关标签:
混合
点击下载
标准简介:
YY 0256-1997.Wet type mixing granulator.
4.4.5制粒机缸体内搅拌桨叶和切制刀旋转体不得有油污渗出。
4.4.6制粒机出 料装置关闭时应密闭,不允许漏粉。
4.4.7凡采用水冷 却结构的制粒机,其冷却系统不应渗漏。
4.5 电气安全性能要求
4.5.1制粒机电气系统安全可靠,操作时应灵敏正确,且应有醒目的安全标志及可靠的接地装置。
4.5.2固 定缸式制粒机缸盖开启后应锁定良好,不得倾覆。电气开关应自锁,机器不能启动。
4.5.3移动缸式制粒 机缸体不在工作位置时,电气开关应自锁,桨叶不能启动。
4.5.4电气系统的保护接地电路的连续性应符合GB/T5226.1-1996中20.2的规定。
4.5.5电 气系统的绝缘电阻应符合GB/T 5226. 1- 1996中20.3的规定。
4.5.6电气系统的耐压应符合 GB/T 5226. 1-1996中20.4的规定。
4.6 外观质量
4.6.1制粒机外观应平整 ,光洁,符合药品生产条件。
4.6.2制粒机操作件和外露紧固件金属镀层应符合YY 0076- -92 中3. 1.2的规定。
4.6.3制粒机零件未加工表面涂漆应符合 ZB J50 011-89中第7章的规定。
4.6.4制粒机缸体 内壁应平整光滑,不允许有明显凹痕,表面粗糙度R,值应不大于0. 8 pm。
4.6.5 制粒机搅拌桨、切制刀的表面粗糙度R.值应不大于0.8 pum。
5试验方法
试验方法分空载试验和负载试验。负载试验只在型式检验时进行(见6. 2. 2)。
5.1 空载试验
制粒机通电开机,空载运转60min后测试。
a)应符合4.2.1.4.2. 4.4.4.1的规定。
b)用通用量具或专用量具测量其装配质量应符合4.2.2或4. 2.3的规定。
c)用数字式温度计或点温计测试轴承座外壳表面温升、温度,其结果应符合4.4.2的规定。
d)用声级计按ZB J50 004的测试方法测试空载噪声,其结果应符合4.4.3的规定。
e)检查缸体内情况,其结果应符合4.4.5的规定。
f)将压力不低于0.2MPa的冷却水输入制粒机的水冷却管,堵塞另一端,检查水冷却系统,其结果应符合4.4.7的规定。
g)检查制粒机开关自锁装置,其结果应符合4.5.2或4.5. 3的规定。
h)保护接地电路连续性检验、绝缘电阻检验、耐压试验分别按GB5226.1--1996中20.2.20.3.20.4的试验方法进行测定,其结果应符合4.5.4.4.5.5.4.5.6的规定。
i)目测制粒机外观及操作件、外露紧固件的金属镀层和油漆涂层,应符合4.6:1.4.6.2.4.6.3的规
部分标准内容:
中华人民共和国医药行业标准
YY0256—1997
湿法混合制粒机
Wettypemixinggranulator
1997-12-16发布
国家医药管理局发布
1998-03-01实施
YY0256-1997
为了使本标准具有较广泛的适用性和可操作性,本标准不对机器的系列参数作出规定。本标准由国家医药管理局提出。本标准由国家医药管理局制药机械设计技术中心站归口。本标准负责起草单位:上海天祥·健台制药机械有限公司。本标准主要起草人:陈露真、李华强。1
中华人民共和国医药行业标准
湿法混
合制粒机
Wettypemixinggranulator
YY0256—1997
本标准规定了湿法混合制粒机产品分类、要求、试验方法、检验规则和标志、包装、贮存。本标准适用于湿法混合制粒机(以下简称制粒机)。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191—91包装储运图示标志
GB/T5226.1—1996工业机械电气设备第1部分:通用技术条件GB6388—86运输包装收发货标志GB10111一88利用随机数子进行随机抽样的方法GB/T13306-91标牌
GB/T13384—92机电产品包装通用技术条件YY0076--92金属制件的镀层分类技术条件YY/T0216-1995制药机械产品型号编制方法ZBJ50004—88
金属切削机床噪声声压级的测定ZBJ50008.2—88金属切削机床焊接件通用技术条件ZBJ50011-89机床涂漆技术条件
3产品分类
3.1型式
粉状物料和一定量的液体辅料,通过搅拌混合及旋转制粒刀切割成湿颗粒的装置。按其结构型式分为固定缸式和移动缸式二种。
3.2型号
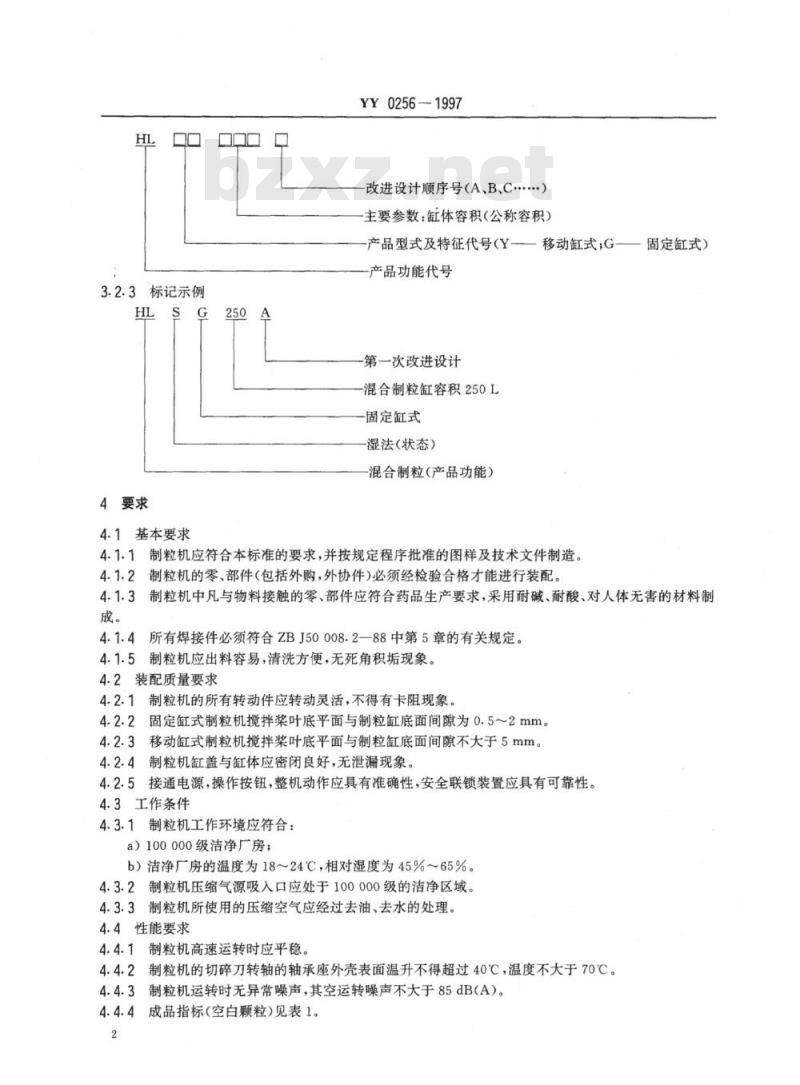
3.2.1制粒机型号应符合YY/T0216的规定。3.2.2型号标记
国家医药管理局1997-12-16批准1998-03-01实施
3.2.3标记示例
4要求
4.1基本要求
YY0256-1997
改进设计顺序号(A、B、C....)主要参数:缸体容积(公称容积)产品型式及特征代号(Y——
移动缸式;G-
产品功能代号
第一次改进设计
混合制粒缸容积250L
固定缸式
湿法(状态)
混合制粒(产品功能)
4.1.1制粒机应符合本标准的要求,并按规定程序批准的图样及技术文件制造。4.1.2制粒机的零、部件(包括外购,外协件)必须经检验合格才能进行装配固定缸式)
4.1.3制粒机中凡与物料接触的零、部件应符合药品生产要求,采用耐碱、耐酸、对人体无害的材料制成。
所有焊接件必须符合ZBJ50008.2一88中第5章的有关规定。4.1.5制粒机应出料容易,清洗方便,无死角积垢现象。4.2装配质量要求
4.2.1制粒机的所有转动件应转动灵活,不得有卡阻现象。4.2.2固定缸式制粒机搅拌浆叶底平面与制粒缸底面间隙为0.5~2mm。4.2.3移动缸式制粒机搅拌桨叶底平面与制粒缸底面间隙不大于5mm。4.2.4制粒机缸盖与缸体应密闭良好,无泄漏现象。4.2.5接通电源,操作按钮,整机动作应具有准确性,安全联锁装置应具有可靠性。4.3工作条件
4.3.1制粒机工作环境应符合:
a)100000级洁净厂房;
b)洁净厂房的温度为18~24℃,相对湿度为45%~65%。4.3.2制粒机压缩气源吸入口应处于100000级的洁净区域。4.3.3制粒机所使用的压缩空气应经过去油、去水的处理。4.4性能要求
4.4.1制粒机高速运转时应平稳。4.4.2制粒机的切碎刀转轴的轴承座外壳表面温升不得超过40℃,温度不大于70℃。4.4.3制粒机运转时无异常噪声,其空运转噪声不大于85dB(A)。4.4.4成品指标(空白颗粒)见表1。2
颗粒尺寸,mm
细粉含量,%
(颗粒小于0.15mm的)
YY0256-1997
表1成品指标(空白颗粒)
0.85~0.15
相当英制目数
20~100
4.4.5制粒机缸体内搅拌桨叶和切制刀旋转体不得有油污渗出。4.4.6制粒机出料装置关闭时应密闭,不允许漏粉。4.4.7凡采用水冷却结构的制粒机,其冷却系统不应渗漏。4.5电气安全性能要求
成品状态
干燥后
干燥后
4.5.1制粒机电气系统安全可靠,操作时应灵敏正确,且应有醒目的安全标志及可靠的接地装置。4.5.2固定缸式制粒机缸盖开启后应锁定良好,不得倾覆。电气开关应自锁,机器不能启动。4.5.3
移动缸式制粒机缸体不在工作位置时,电气开关应自锁,浆叶不能启动。4.5.4
电气系统的保护接地电路的连续性应符合GB/T5226.1一1996中20.2的规定。电气系统的绝缘电阻应符合GB/T5226.1-1996中20.3的规定。电气系统的耐压应符合GB/T5226.1—1996中20.4的规定。4.6外观质量
4.6.1制粒机外观应平整,光洁,符合药品生产条件。制粒机操作件和外露紧固件金属镀层应符合YY0076—92中3.1.2的规定。4.6.2
制粒机零件未加工表面涂漆应符合ZBJ50011-—89中第7章的规定。4.6.3
制粒机缸体内壁应平整光滑,不允许有明显凹痕,表面粗糙度R,值应不大于0.8μum。4.6.5制粒机搅拌浆、切制刀的表面粗糙度R.值应不大于0.8μm。5试验方法
试验方法分空载试验和负载试验。负载试验只在型式检验时进行(见6.2.2)。5.1空载试验
制粒机通电开机,空载运转60min后测试。a)应符合4.2.1、4.2.4、4.4.1的规定。b)用通用量具或专用量具测量其装配质量应符合4.2.2或4.2.3的规定。c)用数字式温度计或点温计测试轴承座外壳表面温升、温度,其结果应符合4.4.2的规定。d)用声级计按ZBJ50004的测试方法测试空载噪声,其结果应符合4.4.3的规定。e)检查缸体内情况,其结果应符合4.4.5的规定。f)将压力不低于0.2MPa的冷却水输入制粒机的水冷却管,堵塞另一端,检查水冷却系统,其结果应符合4.4.7的规定。
g)检查制粒机开关自锁装置,其结果应符合4.5.2或4.5.3的规定。h)保护接地电路连续性检验、绝缘电阻检验、耐压试验分别按GB5226.1-1996中20.2、20.3、20.4的试验方法进行测定,其结果应符合4.5.4、4.5.5、4.5.6的规定。i)目测制粒机外观及操作件、外露紧固件的金属镀层和油漆涂层,应符合4.6:1、4.6.2、4.6.3的规定。
i)制粒机缸体内壁、搅拌浆和制粒刀的表面粗糙度用粗糙度比较样块检测,其结果应符合4,6.4和4.6.5的规定。
5.2负载试验
5.2.1负载试验可在用户单位进行。3
YY0256-1997
5.2.2试验物料以药用淀粉按制粒机有效容积加料,并按常规制粒工艺方法进行试验。试验结果应符合下列要求:
a)机器运转平稳,无异常噪声,且符合4.4.6的规定。b)成品指标应符合表1的规定。5.2.3细粉含量的试验方法
任意取五组,每组100g无团状颗粒的湿颗粒。分别均匀摊放在烘盘内,放入烘箱,在70℃温度下干燥(干燥颗粒含水量不大于2%)。然后用六号药筛(筛孔内径0.15mm)过筛,并用秤测定。用式(1)计算出每一组的细粉含量百分比,再用式(2)计算出五组的平均细粉含量百分比。H.
式中:H
一组干颗粒的细粉含量,%;
一组干颗粒的细粉重量,g;
一组干颗粒重量,g;
H-平均细粉含量,%;
n——颗粒组数,n=5;
i——1,2,3,4,5。
6检验规则
6.1每台制粒机应按本标准经制造单位检验部门检验合格后方能出厂,并附有产品合格证。6.2制粒机的检验分出厂检验和型式检验。6.2.1出厂检验
6.2.1.1制粒机出厂前必须按表2的规定逐台检验。表2检验项目
检验内容
一般性能
主要性能
检验项目
4.6.1、4.6.2、4.6.3
4.2、4.4.1、4.4.2、4.4.3、4.4.7、4.5.1、4.5.2、4.5.3、4.6.4、4.6.54.4.5、4.5.4、4.5.5、4.5.6
(1)
(2)
6.2.1.2每台制粒机在检验过程中如发现不合格品,则退回进行整修。如仍不合格,则判定该台产品出厂检验不合格,不予出厂。wwW.bzxz.Net
6.2.2型式检验
6.2.2.1制粒机在下列情况之一时,应进行型式检验。a)新产品试制鉴定时;
b)正式投产后,在设计、工艺或材料上有较大改进可能影响产品性能时;c)停产二年恢复生产时;
d)国家质量监督机构提出进行型式检验要求时。6.2.2.2型式检验项目应对本标准全部要求进行质量考核和判定。6.2.2.3判定规则
型式检验样机应从出厂检验合格的产品中抽取10%,至少抽取三台,测一台,抽样方法按GB10111中有关规定执行。批量不足10台抽测一台。在检验中,如电气安全性能有一项不合格,即不合格。主要4
YY0256-1997
性能有一项不合格,则加倍复检不合格的项目,若仍不合格,则该批产品为不合格。7标志、包装、贮存
7.1标志
7.1.1每台制粒机应有产品铭牌和指示安全铭牌等标志。铭牌应固定在机器的明显部位。铭牌的尺寸及技术要求应符合GB/T13306的规定。铭牌的内容包括:a)产品名称:
b)产品型号:
c)额定电压、频率;
d)产品出厂编号和日期;
e)制造单位名称;
f)产品标准号。
7.1.2制粒机包装箱上的标志图案应符合GB191和GB6388的规定。7.2包装
7.2.1制粒机在包装前须对机器裸露的加工表面作防锈处理,并罩上塑料薄膜保护罩。7.2.2制粒机的包装应符合GB/T13384的规定。7.2.3每台制粒机包装箱内应附有产品合格证、使用说明书及装箱单各份,用防潮袋包装。7.3贮存
制粒机应存放在干燥、通风、无腐蚀性气体的室内或有遮蔽的场所。中华人民共和国医药
行业标准
湿法混合制粒机
YY0256—1997
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
话:68522112
中国标准出版社皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16
印张3/4
字数10千字
1998年5月第一版
1998年5月第一次印刷
印数1-1000
书号:155066·2-12088
定价8.00元
标目337-64
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY1122-2005 咬骨钳(剪)通用技术条件
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY0345-2002 骨接合植入物金属骨针
- YY/T0452-2003 止血钳
- YY0320-2000 麻醉机
- YY0003-1990 病床
- 行业新闻
网站备案号:湘ICP备2025141790号-2