- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0242-1996 医用输液、输血、注射器用聚丙烯专用料
标准号:
YY 0242-1996
标准名称:
医用输液、输血、注射器用聚丙烯专用料
标准类别:
医药行业标准(YY)
标准状态:
已作废-
发布日期:
1996-08-12 -
实施日期:
1997-02-01 -
作废日期:
2008-03-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
167.17 KB
中标分类号:
医药、卫生、劳动保护>>医疗器械>>C48医用卫生用品
替代情况:
被YY/T 0242-2007替代
部分标准内容:
中华人民共和国医药行业标准
YY0242-1996
医用输液、输血、注射器用聚丙烯专用料1996-08-12发布
国家医药管理局
1997-02-01实施
YY0242—1996
由于没有检索到关于医用输液、输血、注射器用聚丙烯专用料的国际标准及国外标准,本标准是根据GB8368—93—次性使用输液器》、GB8369—93《—次性使用输血器》GB15810—1995《—次性使用无菌注射器》并参照YY0114—93《医用输液、输血、注射器用聚乙烯专用料》制定的。本标准生物性能是依据GB/T14233.2--93《医用输液、输血、注射器具检验方法第二部分:生物试验方法》而确定的。
本标准的化学性能是依据GB15810--1995而确定的。本标准由国家医药管理局医用高分子产品质量检测中心归口。本标准起草单位:齐鲁石化公司树脂加工应用研究所、国家医药管理局医用高分子产品质量检测中心。
本标准主要起草人:滕谋勇、骆红宇、张爱华、王晶。1范围
中华人民共和国医药行业标准
医用输液、输而、注射器用聚丙烯专用料YY0242-1996
本标准规定了医用输液、输血、注射器用聚丙烯专用料(以下简称“医用聚丙烯专用料”)的分类与符号、要求、试验方法、检验规则、标志、包装、运输和贮存。本标准适用于医用输液、输血、注射器用聚丙烯专用料。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB1033—86塑料密度和相对密度试验方法GB1040—92塑料拉伸性能试验方法GB/T1843—1996塑料悬臂梁冲击试验方法GB2409—80
塑料黄色指数试验方法
GB2410—80
透明塑料透光率和雾度试验方法GB2547—81
塑料树脂取样方法
GB2918-—82
塑料试样状态调节和试验的标准环境热塑性塑料熔体流动速率试验方法GB3682--83
GB9341—88
GB9352—88
塑料弯曲性能试验方法
热塑性塑料压塑试样的制备
聚丙烯树脂
GB12670—90
GB/T14233.1一93医用输液,输血、注射器具检验方法第一部分:化学分析方法GB/T14233.2一93医用输液、输血、注射器具检验方法第二部分:生物试验方法3分类与符号
根据一次性使用医疗器具的灭菌方法,医用聚丙烯专用料分为普通级和耐辐射级两类。普通级医用聚丙烯专用料:一种医用聚丙烯专用料,用其制成的医用输液、输血、注射器适合于环氧乙烷灭菌。以\GMPp”(generalmedicalpolypropylene)表示。耐辐射级医用聚丙烯专用料:一种医用聚丙烯专用料,用其制成的医用输液、输血、注射器不仅适合于环氧乙烷灭菌,而且适合于射线灭菌。以“ARPp”(anti-radiationpolypropylene)表示。4要求
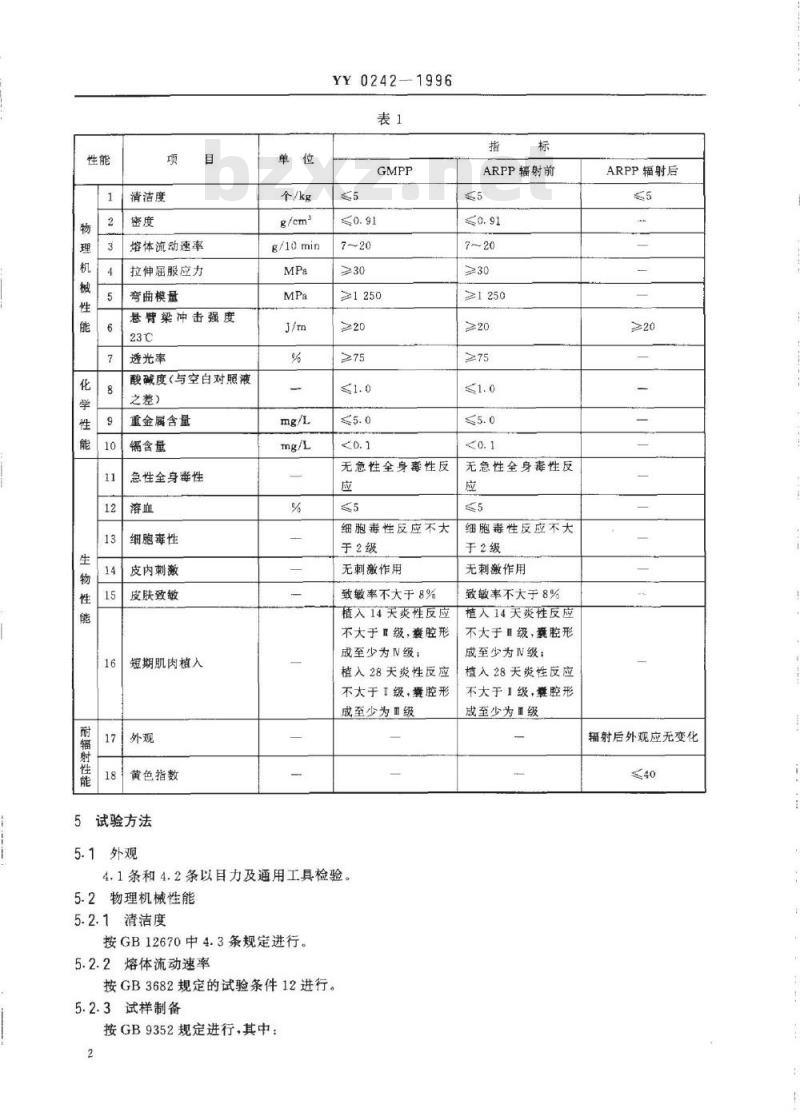
4.1GMPP和ARPP均为颗粒状,颗粒大小应均匀,尺寸在任意方向上应为2~5mm。4.2GMPP和ARPP应干燥,无气泡和机械杂质。4.3GMPP和ARPP物理机械性能、化学性能、生物性能和耐辐射性能应符合表1规定。国家医药管理局1996-08-12批准1997-02-01实施
耐辐射性能
清洁度
熔体流动速率
拉伸屈服应力
弯曲模量
悬臂染冲击强度
透光率
酸碱度(与空白对照液
之差)
重金属含量
镉含量
急性全身毒性
细胞毒性
皮内刺激
皮肤致敏
短期肌肉植入
黄色指数
试验方法
5.1外观
个/kg
g/10min
YY0242—1996
≥1250
无急性全身毒性反
细胞毒性反应不大wwW.bzxz.Net
于2级
无刺激作用
致敏率不大于8%
植入14天炎性反应
不大于Ⅱ级,囊腔形
成至少为N级:
植入28天炎性反应
不大于I级,囊腔形
成至少为Ⅱ级
4.1条和4.2条以目力及通用工具检验。5.2物理机械性能
5.2.1清洁度
按GB12670中4.3条规定进行。
5.2.2熔体流动速率
按GB3682规定的试验条件12进行。5.2.3试样制备
按GB9352规定进行,其中:
ARPP辐射前
≥1250
无急性全身毒性反
细胞毒性反应不大
于2级
无刺激作用
致敏率不大于8%
植人14天炎性反应
不大于级,囊腔形
成至少为V级:
植入28天炎性反应
不大于1级,囊腔形
成至少为级
ARPP辐射后
辐射后外观应无变化
a)预热时间、模塑时间均为5min;b)模塑温度230℃2℃;
c)模塑合模力为15MPa。
5.2.4试样状态调节和试验环境
按GB2918规定进行,其中:
a)温度:23℃±2℃;
b)相对湿度:(50士5)%;
c)试样的状态调节时间:≥24h。5.2.5密度
按GB1033中D法进行。
5.2.6拉伸屈服应力
按GB1040规定进行,其中:
YY0242--1996
a)试验速度为50mm/min士5mm/min;b)采用1型试样。
5.2.7弯曲模量
按GB9341规定进行。
5.2.8悬臂梁冲击强度
按GB/T1843规定进行。
5.2.9透光率
按GB2410规定进行,试样厚度为0.45mm土0.05mm。5.3化学性能
5.3.1试样制备
按5.2.3条制备,试样厚度为0.45mm±0.05mm。5.3.2供试液制备
将按5.3.1条制成的试样冲洗干净,剪成1cm小块,按总面积(cm2)与蒸馏水(mL)比为2:1的比例加水,加盖密封,置压力蒸汽灭菌器中,121℃土1℃饱和蒸汽下30min,将样品与液体分离,冷却至室温即得。取同批蒸馏水以同法制备空白对照液。5.3.3酸碱度
取5.3.2条制备的供试液和对照液,用酸度计分别测定其pH值。5.3.4重金属含量
5.3.4.1铅标准溶液的配制(5mg/L精确称取0.1598g经110C干燥恒重的硝酸铅,溶于5mL硝酸和50mL的蒸馏水中,用蒸馏水稀释至1000mL,摇匀,作为储备液。铅的浓度为100mg/L。铅标准溶液:临用前精确量取储备液5mL,置于100mL容量瓶中,加蒸馏水稀释至刻度.摇匀.铅的浓度为5mg/L。
5.3.4.2氢氧化钠试液的配制
取氢氧化钠4.3g,加蒸馏水溶解稀释至100mL5.3.4.3硫化钠试液的配制
称取硫化钠1g,加水溶解并稀释至10mL(本液在试验前配制)。5.3.4.4试验步骤
取25mL钠氏比色管两支,一支加铅标准溶液2mL,另一支加入5.3.2条制备的供试液2mL,两管各加入氢氧化钠试液5mL,加水稀释至25mL,再加硫化钠试液1mL,摇匀,放置5min,比较颜色深浅。
5.3.5镉含量
YY0242-1996
取5.3.2条制备的供试液,按GB/T14233.1中4.1条规定进行。5.4生物性能
5.4.1试样制备
按5.2.3条制备,试样厚度为0.45mm土0.05mm。5.4.2供试液制备
将按5.4.1条制成的试样冲洗干净,滤纸吸干,切成5mm×30mm条状,按表面积(cm2)与0.9%的生理盐水体积(mL)之比为6:1的比例加入生理盐水,加盖密封,置压力蒸汽灭菌器中,121℃士1℃饱和蒸汽下30min,将样品与液体分离,冷至室温即得。取同批0.9%的生理盐水以同法制备空白对照液。
5.4.3急性全身毒性
按GB/T14233.2中第5章规定进行。5.4.4溶血
按GB/T14233.2中第6章规定进行。5.4.5细胞毒性
按GB/T14233.2中第7章规定进行。5.4.6皮内刺激
按GB/T14233.2中第8章规定进行。5.4.7皮肤致敏
按GB/T14233.2中第9章规定进行5.4.8短期肌肉植入
按GB/T14233.2中第10章规定进行。5.5耐辐射性能
5.5.1按5.2.3条制备试样;
5.5.2辐射剂量:25kGy;
5.5.3辐射两周后按表1规定的项目进行试验。黄色指数按GB2409进行,其中试样的厚度为2.00mm±0.10mm
6检验规则
6.1抽样
6.1.1GMPP和ARPP以批为单位进行检验,原料、配方、生产工艺不变的情况下,规定每24h产量为一批。
6.1.2按GB2547规定进行取样。
6.2检验
检验分为型式检验、周期检验和出厂检验。6.2.1型式检验项目为第4章规定的全部项目。下列情况下进行型式检验:a)新产品投产时;
b)工艺、配方有重大改变时。
6.2.2周期检验每半年一次,检验项目为第4章中除细胞毒性、皮内刺激、皮肤致敏、短期肌肉植入以外的全部项目。
6.2.3出厂检验项目为4.1条、4.2条和表1中清洁度、熔体流动速率、拉伸屈服应力、悬臂梁冲击强度和酸碱度。
6.2.3.1检验合格并附有质量证明书方可出厂。4
YY0242—1996
6.2.3.2若检验结果有一项不符合标准规定时,应重新从该批产品中取双倍采样单元数,对不合格项目进行复验,以复验结果作为检验结果。6.2.3.3当供需双方对产品的性能有异议时,由双方协商解决或请国家仲裁机构评判。7
标志、包装、运输和购存
7.1标志
产品包装袋上应印有生产厂名称、厂址、产品名称、商标、产品牌号、批号、生产日期、标准编号和净重。
7.2包装
包装用内衬塑料袋的纸塑复合袋(或具有相同包装效果的包装),包装袋的封口应保证在运输、赔存时不被污染,包装应能防尘,防潮。7.3运输
运输中应避免雨淋和曝晒,远离污染源。7.4贮存
应贮存在清洁、阴凉、相对湿度不超过80%、通风良好的仓库内。保质期不低于一年5
中华人民共和国医药
行业标准
医用输液、输血、注射器用聚丙烯专用料YY0242--1996
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
话:68522112
中国标准出版社秦皇岛印剃厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×1230
1997年3月第一版
印张3/4
字数10千字
1997年3月第一次印刷
印数1-600
书号:155066·2-11292
标目305-53
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
YY0242-1996
医用输液、输血、注射器用聚丙烯专用料1996-08-12发布
国家医药管理局
1997-02-01实施
YY0242—1996
由于没有检索到关于医用输液、输血、注射器用聚丙烯专用料的国际标准及国外标准,本标准是根据GB8368—93—次性使用输液器》、GB8369—93《—次性使用输血器》GB15810—1995《—次性使用无菌注射器》并参照YY0114—93《医用输液、输血、注射器用聚乙烯专用料》制定的。本标准生物性能是依据GB/T14233.2--93《医用输液、输血、注射器具检验方法第二部分:生物试验方法》而确定的。
本标准的化学性能是依据GB15810--1995而确定的。本标准由国家医药管理局医用高分子产品质量检测中心归口。本标准起草单位:齐鲁石化公司树脂加工应用研究所、国家医药管理局医用高分子产品质量检测中心。
本标准主要起草人:滕谋勇、骆红宇、张爱华、王晶。1范围
中华人民共和国医药行业标准
医用输液、输而、注射器用聚丙烯专用料YY0242-1996
本标准规定了医用输液、输血、注射器用聚丙烯专用料(以下简称“医用聚丙烯专用料”)的分类与符号、要求、试验方法、检验规则、标志、包装、运输和贮存。本标准适用于医用输液、输血、注射器用聚丙烯专用料。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB1033—86塑料密度和相对密度试验方法GB1040—92塑料拉伸性能试验方法GB/T1843—1996塑料悬臂梁冲击试验方法GB2409—80
塑料黄色指数试验方法
GB2410—80
透明塑料透光率和雾度试验方法GB2547—81
塑料树脂取样方法
GB2918-—82
塑料试样状态调节和试验的标准环境热塑性塑料熔体流动速率试验方法GB3682--83
GB9341—88
GB9352—88
塑料弯曲性能试验方法
热塑性塑料压塑试样的制备
聚丙烯树脂
GB12670—90
GB/T14233.1一93医用输液,输血、注射器具检验方法第一部分:化学分析方法GB/T14233.2一93医用输液、输血、注射器具检验方法第二部分:生物试验方法3分类与符号
根据一次性使用医疗器具的灭菌方法,医用聚丙烯专用料分为普通级和耐辐射级两类。普通级医用聚丙烯专用料:一种医用聚丙烯专用料,用其制成的医用输液、输血、注射器适合于环氧乙烷灭菌。以\GMPp”(generalmedicalpolypropylene)表示。耐辐射级医用聚丙烯专用料:一种医用聚丙烯专用料,用其制成的医用输液、输血、注射器不仅适合于环氧乙烷灭菌,而且适合于射线灭菌。以“ARPp”(anti-radiationpolypropylene)表示。4要求
4.1GMPP和ARPP均为颗粒状,颗粒大小应均匀,尺寸在任意方向上应为2~5mm。4.2GMPP和ARPP应干燥,无气泡和机械杂质。4.3GMPP和ARPP物理机械性能、化学性能、生物性能和耐辐射性能应符合表1规定。国家医药管理局1996-08-12批准1997-02-01实施
耐辐射性能
清洁度
熔体流动速率
拉伸屈服应力
弯曲模量
悬臂染冲击强度
透光率
酸碱度(与空白对照液
之差)
重金属含量
镉含量
急性全身毒性
细胞毒性
皮内刺激
皮肤致敏
短期肌肉植入
黄色指数
试验方法
5.1外观
个/kg
g/10min
YY0242—1996
≥1250
无急性全身毒性反
细胞毒性反应不大wwW.bzxz.Net
于2级
无刺激作用
致敏率不大于8%
植入14天炎性反应
不大于Ⅱ级,囊腔形
成至少为N级:
植入28天炎性反应
不大于I级,囊腔形
成至少为Ⅱ级
4.1条和4.2条以目力及通用工具检验。5.2物理机械性能
5.2.1清洁度
按GB12670中4.3条规定进行。
5.2.2熔体流动速率
按GB3682规定的试验条件12进行。5.2.3试样制备
按GB9352规定进行,其中:
ARPP辐射前
≥1250
无急性全身毒性反
细胞毒性反应不大
于2级
无刺激作用
致敏率不大于8%
植人14天炎性反应
不大于级,囊腔形
成至少为V级:
植入28天炎性反应
不大于1级,囊腔形
成至少为级
ARPP辐射后
辐射后外观应无变化
a)预热时间、模塑时间均为5min;b)模塑温度230℃2℃;
c)模塑合模力为15MPa。
5.2.4试样状态调节和试验环境
按GB2918规定进行,其中:
a)温度:23℃±2℃;
b)相对湿度:(50士5)%;
c)试样的状态调节时间:≥24h。5.2.5密度
按GB1033中D法进行。
5.2.6拉伸屈服应力
按GB1040规定进行,其中:
YY0242--1996
a)试验速度为50mm/min士5mm/min;b)采用1型试样。
5.2.7弯曲模量
按GB9341规定进行。
5.2.8悬臂梁冲击强度
按GB/T1843规定进行。
5.2.9透光率
按GB2410规定进行,试样厚度为0.45mm土0.05mm。5.3化学性能
5.3.1试样制备
按5.2.3条制备,试样厚度为0.45mm±0.05mm。5.3.2供试液制备
将按5.3.1条制成的试样冲洗干净,剪成1cm小块,按总面积(cm2)与蒸馏水(mL)比为2:1的比例加水,加盖密封,置压力蒸汽灭菌器中,121℃土1℃饱和蒸汽下30min,将样品与液体分离,冷却至室温即得。取同批蒸馏水以同法制备空白对照液。5.3.3酸碱度
取5.3.2条制备的供试液和对照液,用酸度计分别测定其pH值。5.3.4重金属含量
5.3.4.1铅标准溶液的配制(5mg/L精确称取0.1598g经110C干燥恒重的硝酸铅,溶于5mL硝酸和50mL的蒸馏水中,用蒸馏水稀释至1000mL,摇匀,作为储备液。铅的浓度为100mg/L。铅标准溶液:临用前精确量取储备液5mL,置于100mL容量瓶中,加蒸馏水稀释至刻度.摇匀.铅的浓度为5mg/L。
5.3.4.2氢氧化钠试液的配制
取氢氧化钠4.3g,加蒸馏水溶解稀释至100mL5.3.4.3硫化钠试液的配制
称取硫化钠1g,加水溶解并稀释至10mL(本液在试验前配制)。5.3.4.4试验步骤
取25mL钠氏比色管两支,一支加铅标准溶液2mL,另一支加入5.3.2条制备的供试液2mL,两管各加入氢氧化钠试液5mL,加水稀释至25mL,再加硫化钠试液1mL,摇匀,放置5min,比较颜色深浅。
5.3.5镉含量
YY0242-1996
取5.3.2条制备的供试液,按GB/T14233.1中4.1条规定进行。5.4生物性能
5.4.1试样制备
按5.2.3条制备,试样厚度为0.45mm土0.05mm。5.4.2供试液制备
将按5.4.1条制成的试样冲洗干净,滤纸吸干,切成5mm×30mm条状,按表面积(cm2)与0.9%的生理盐水体积(mL)之比为6:1的比例加入生理盐水,加盖密封,置压力蒸汽灭菌器中,121℃士1℃饱和蒸汽下30min,将样品与液体分离,冷至室温即得。取同批0.9%的生理盐水以同法制备空白对照液。
5.4.3急性全身毒性
按GB/T14233.2中第5章规定进行。5.4.4溶血
按GB/T14233.2中第6章规定进行。5.4.5细胞毒性
按GB/T14233.2中第7章规定进行。5.4.6皮内刺激
按GB/T14233.2中第8章规定进行。5.4.7皮肤致敏
按GB/T14233.2中第9章规定进行5.4.8短期肌肉植入
按GB/T14233.2中第10章规定进行。5.5耐辐射性能
5.5.1按5.2.3条制备试样;
5.5.2辐射剂量:25kGy;
5.5.3辐射两周后按表1规定的项目进行试验。黄色指数按GB2409进行,其中试样的厚度为2.00mm±0.10mm
6检验规则
6.1抽样
6.1.1GMPP和ARPP以批为单位进行检验,原料、配方、生产工艺不变的情况下,规定每24h产量为一批。
6.1.2按GB2547规定进行取样。
6.2检验
检验分为型式检验、周期检验和出厂检验。6.2.1型式检验项目为第4章规定的全部项目。下列情况下进行型式检验:a)新产品投产时;
b)工艺、配方有重大改变时。
6.2.2周期检验每半年一次,检验项目为第4章中除细胞毒性、皮内刺激、皮肤致敏、短期肌肉植入以外的全部项目。
6.2.3出厂检验项目为4.1条、4.2条和表1中清洁度、熔体流动速率、拉伸屈服应力、悬臂梁冲击强度和酸碱度。
6.2.3.1检验合格并附有质量证明书方可出厂。4
YY0242—1996
6.2.3.2若检验结果有一项不符合标准规定时,应重新从该批产品中取双倍采样单元数,对不合格项目进行复验,以复验结果作为检验结果。6.2.3.3当供需双方对产品的性能有异议时,由双方协商解决或请国家仲裁机构评判。7
标志、包装、运输和购存
7.1标志
产品包装袋上应印有生产厂名称、厂址、产品名称、商标、产品牌号、批号、生产日期、标准编号和净重。
7.2包装
包装用内衬塑料袋的纸塑复合袋(或具有相同包装效果的包装),包装袋的封口应保证在运输、赔存时不被污染,包装应能防尘,防潮。7.3运输
运输中应避免雨淋和曝晒,远离污染源。7.4贮存
应贮存在清洁、阴凉、相对湿度不超过80%、通风良好的仓库内。保质期不低于一年5
中华人民共和国医药
行业标准
医用输液、输血、注射器用聚丙烯专用料YY0242--1996
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
话:68522112
中国标准出版社秦皇岛印剃厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×1230
1997年3月第一版
印张3/4
字数10千字
1997年3月第一次印刷
印数1-600
书号:155066·2-11292
标目305-53
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 上一篇: YY 0240-1996 药用辅料 硅酸镁铝
- 下一篇: YY 0249-1996 药用软膏铝管
- 热门标准
- 医药行业标准(YY)
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY/T0452-2003 止血钳
- YY0003-1990 病床
- YY0011-1990 X射线摄影暗匣
- YY0118-1993 髋关节假体
- YY0476-2004 眼内冲洗灌注液
- YY0781-2010 血压传感器
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2