- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 农业行业标准(NY) >>
- NY/T 564-2002 猪巴氏杆菌病诊断技术
标准号:
NY/T 564-2002
标准名称:
猪巴氏杆菌病诊断技术
标准类别:
农业行业标准(NY)
标准状态:
现行-
发布日期:
2002-08-27 -
实施日期:
2002-12-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
263.37 KB
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了猪巴氏杆菌病诊断技术要求。本标准所规定的临床诊断、病理剖检和病原分离鉴定,适用于猪巴氏杆菌病的诊断,间接血凝试验技术和琼脂扩散沉淀试验技术适用于病原血清学分群和定型鉴定。 NY/T 564-2002 猪巴氏杆菌病诊断技术 NY/T564-2002
部分标准内容:
ICS 11. 220
中华人民共和国农业行业标准
NY/T 564—2002
猪巴氏杆菌病诊断技术
Diagnostic techniques for swine pasteurellosis2002-08~27 发布
2002-12-01实施
中华人民共和国农业部发布
NY/T564-2002
猪巴氏杆菌病,又称猪肺疫·是您害我国养猪业的重要疫病之,我因将之楚为类动物疫病。世界动物生织![World Organization for Animal Healih(英),OfficeIntentional desEpizootic(法),OIE]虽无本病的诊断标准,但对牛和禽的巴氏杆菌病的诊断有技术规定,各国多年研究和实践经验表明,由多杀性巴长杆菌(Pusterrllumuliocidu)引起的多种动物疫病其实验室诊断技术基本t是一致的。本标准是参照(IE有关多杀性巴氏杆菌引起的疫病之诊断技术规定和国内外通用方法、依据我国的实践经验制楚的。
本标准的附录八、附求3、附录(是规范性附录。本标准主农业部畜牧兽医局提出。本标准用全国动物检疫标准化技术委员会归山。本标准起草单位:中国兽医药品监察所。本标准主要起草人:关时、毛开荣、钱心元、魏财文、夏业才。311
1范围
猪巴氏杆菌病诊断技术
本标准规定了猪巴氏杆菌病诊断的技术要求。NY/T 564—2002
本标准所规定的临床诊断、病理剖检和病原分离鉴定,适用于猪巴氏杆菌病的诊断,间接血凝试验技术和琼脂扩散沉淀试验技术适用于病原血清学分群和定型鉴定。2临床诊断
猪巴氏杆菌病分流行性和散发性两类。2.1流行性
特点是病程很短,发病快,体温可高达41(以上。分最急性型和急性型两种。最急性型:多发生在流行初期,呼吸困难.心跳加快,于数小时内死广.急性型:病状主要分两种,一种表现为咽炎症状,咽喉部皮肤发红、热痛肿胀、坚硬,延伸可达到耳根及颈部。常犬坐式伸长头颈呼吸。腹侧、耳根和四肢内侧可发现红色斑点。口、眼等可视粘膜呈暗红色。经出现呼吸症状,病情即迅速恶化,口、鼻流出泡沫状分泌物,死亡率达到100%。另种为急性胸膜炎病状,表现为呼吸困难,痊挛性干咳,触诊胸部有疼痛感,鼻流稠粘液。初便秘后腹泻,病后期皮肤有紫斑或点。病程约4d~6d。
2.2散发性
常年都有发生,病程初期体温升高到41C左右。呈现呼吸困难,偶尔表现急促腹式呼吸。间有咳嗽。口、鼻和肛门粘膜及四肢皮肤呈暗紫色,颈部无红肿病状,由于病程长,诸多病例逐渐消瘦死亡。3病理剖检
3.1最急性型
病理变化不明显、常见皮肤、皮下、浆膜、黏膜有大量出血点。3.2急性型
主要表现咽喉部的结缔组织呈出血性浆液性炎。口腔和鼻孔流出红色泡沫状液体。皮下组织有大量出血点,全身淋巴结出血、断面呈红色,颈部淋巴结肿大.有渗出液,全身各脏器浆膜和黏膜及皮肤呈现点状出,脾不肿大。
3.3散发性
颈部不肿胀、喉头充血、出血,气管有大量泡沫,肺脏呈现水肿、气肿、充血、出血,纤维素性胸膜肺炎病变,局部出现红色和灰色肝变,肺叶切面呈大理石状。胸膜常有纤维素状附着物、胸腔及心包时有积液。
4病原分离鉴定
4.1材料
4.1.1改良马丁氏琼脂。
4.1.2了氏肉汤。
4.1.3糖发酵培养基。
NY/T 564---2002
4.1.41%蛋自陈水。
4.1.5吲哚试验试剂(靛基质试验试剂)(Ehelich-Boehme二.氏试剂)。4.1.6氧化酶试验用试剂(1%盐酸四甲基对苯二胺溶液)。4.1.7运动性试验用培养基(半固体培养基)。4.1.8麦康凯琼脂培养基。
以上各种培养基配制方法见附录A。4.2病原分离
将濒死前或死后数小时内以无菌手术采取病死猪的心血、肝脏组织·接种于改度马丁氏琼脂(见第A.4章)斜面,麦康凯琼脂(见第A.11章)平皿,含10%绵羊全血的改良码丁琼脂平Ⅲ,含有0.1%裂解健康动物红细胞的全血、4%健康动物血清的改良马丁氏琼脂平皿及马丁氏肉汤(见第A.5章)小管培养基,置36(~37C培养。
4.3病原鉴定
4.3.1病原形态
病原为多杀性巴氏杆菌,用肝脏组织或心血抹片可见革兰氏染色阴性,瑞氏染色皇两极浓染的球杆菌。
4.3.2培养特性
培养18h~24h后,改良马丁琼脂斜面生长纯粹的培养物,呈微蓝色菌苔或菌落。马丁肉汤培养物生长为均匀混浊,不产生菌膜。麦康凯琼脂平Ⅲ上不生长。10%的血琼脂平耻上生长的菌落不出现溶血。在含有0.1%裂解血球全血、4%健康动物血清的改良马丁氏琼脂平血上,的单个菌落,肉眼观察光滑圆整,直径2mm~3mm,半透明,呈微蓝色。在低倍显微镜45°折光下观察,应有虹彩,为蓝绿色荧光(Fg菌落型),或桔红色荧光(Fo菌落型)。4.3.3生化特性
4.3.3.1糖发酵试验:用1%蛋白陈水(见第A.7章),将改良马丁氏琼脂18h~24h的培养物洗下,接种糖发酵管(见第A.6章),置36℃~37C培养7d~10d,每天记录反应结果。本菌应发酵葡萄糖、果糖、半乳糖,多数发酵蔗糖,不发酵乳糖、肌醇、菊糖、水杨素及鼠李糖。4.3.3.2吲哚试验:用1%蛋白陈培养基的48h培养物加人吲哚试验试剂(见第A.8章)0.5mL,沿管壁流下,覆盖于培养液表面,液面接触处呈玫瑰红色,为阳性反应4.3.3.3氧化酶试验:取白色洁净滤纸一角,蘸取菌落少许,加试剂(见第A,9章)1滴,立即呈粉红色,为阳性反应,并于5s~10s内呈现深紫色。4.3.3.4运动性试验:用铂金耳钩取固体培养物接种运动性培养基(见第A.10章)倒置小试管的套管内,36℃~37(3d,在套管内生长,无运动性。4.4毒力
4.4.1材料
4.4.1.18g~22g健康小白鼠4只。4.4.1.2马丁氏肉汤。
4.4.2方法
取码丁肉汤24h的培养物,用马丁肉汤稀释约为1.000个菌体/ml.,皮下接种18g~22g健康小白鼠4只,应死亡。
4.5血清学试验
用以确定血清群和血清型。
4.5.1间接血凝试验(Carter氏英膜分群法)4.5.1.1材料
所需材料如下:
a)多杀性巴氏杆菌A、B、D分群血清;b)新鲜红细胞;
c)致敏红细胞;
d)牛理盐水、pH6.0磷酸盐缓冲盐水。a)b)、c)试剂配制方法见附录B。4.5.1.2操作方法
NY/T 564--2002
4.5.1.2.1分群血清于56C水浴30min(除去非特异性的凝聚因子),用生理盐水作10倍稀释后再进行连续对倍稀释至第8管,取每个稀释度0.2 mL加到小圆底试管。4.5.1.2.2每支小圆底试管加人致敏红细胞(见第B.4章)0.2mL。4.5.1.2.3设对照组:
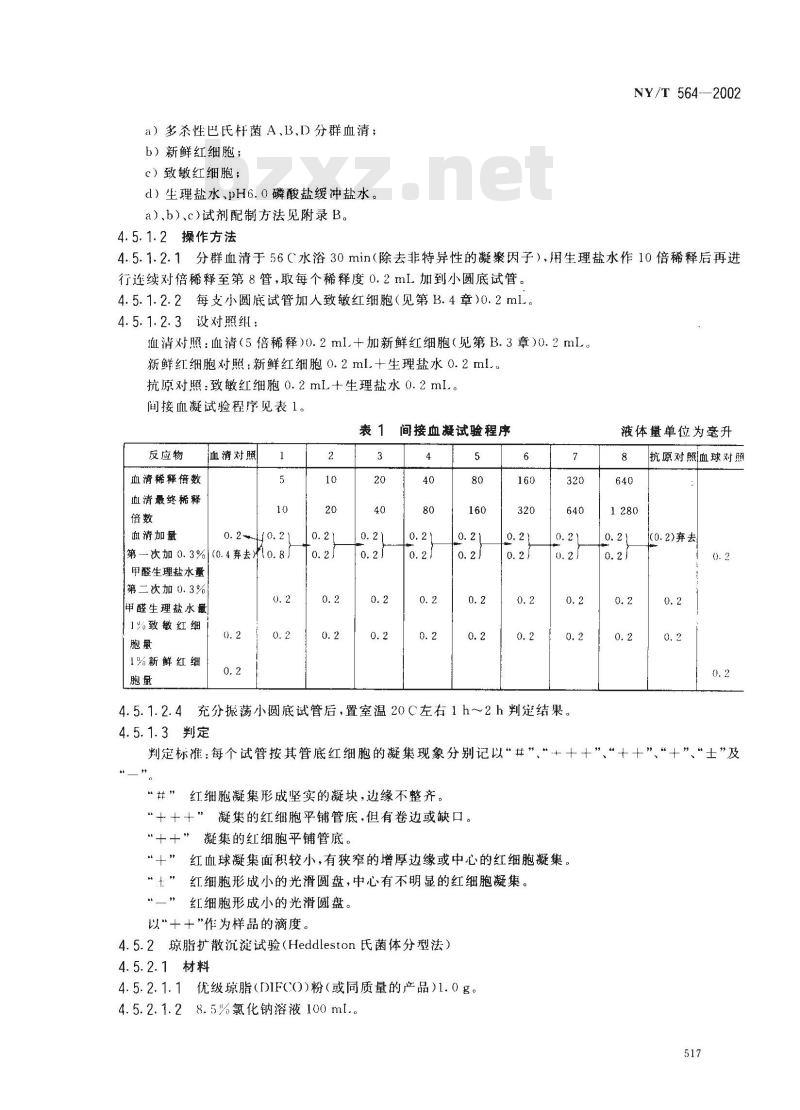
血清对照:血清(5倍稀释)0.2ml.+加新鲜红细胞(见第B.3章)0.2mL新鲜红细胞对照:新鲜红细胞0.2ml.十生理盐水0.2ml.。抗原对照:致敏红细胞0.2mL+生理盐水0.2ml.。间接血凝试验程序见表1。
表 1 间接血凝试验程序
反应物
血清稀释倍数
血清最终稀释
血清加量
血清对照
第一次加0.3%(0.4弃去10.8
甲醛生理盐水量
第二次加0.3%
甲醛生理盐水量
%致敏红细bzxZ.net
1%新鲜红细
4.5.1.2.4充分振荡小圆底试管后,置室温20C左右1h~2h判定结果。4.5.1.3判定
判定标准:每个试管按其管底红细胞的凝集现象分别记以“#”红细胞凝集形成坚实的凝块,边缘不整齐。#”
“十十十”凝集的红细胞平铺管底,但有卷边或缺口。凝集的红细胞平铺管底。
\++”
“十”红血球凝集面积较小,有狭窄的增厚边缘或中心的红细胞凝集。“士”红细胞形成小的光滑圆盘,中心有不明显的红细胞凝集。二”红细胞形成小的光滑圆盘。以“十十”作为样品的滴度。
4.5.2琼脂扩散沉淀试验(Heddleston氏菌体分型法)4.5.2.1材料
4.5.2.1.1优级琼脂(DIFCO)粉(或同质量的产品)1.0g。4.5.2.1.28.5%氯化钠溶液100ml.。液体量单位为毫升
抗原对照血球对照
(0.2)弃去
+#*++*
、“士”及
NY/T564-2002
4.5.2.1.31%硫柳汞溶液1ml。
4.5.2.1.4多杀性巴氏杆菌菌体分型血清,1~16个血清型。4.5.2.1.5抗原。制备方法见附录C。4.5.2.2方法
用8.5%氯化钠溶液100ml.十琼脂1.0g加热溶化后再加人1ml.1%:硫柳求,混合凉至60C左在倒人平皿内,琼脂厚度2.5mm~3mm,琼脂冷凝后,打孔,孔径4mm孔与孔中心距离为6mm,每组5孔,中央孔加待检抗原(见第(.2章),滴满为度(约0.03mI.).四周孔加分型血清(见第(.1章)分别加人到四周孔。置36(37(,24h~48h后判定结果。4.5.2.3判定
在抗原与血清孔之间出现明显的沉淀线为阳性。5
诊断判定
根据临床症状和病理变化、加上涂片染色镜检,订对本病进行初步诊断·但确诊要靠病原分离鉴定其中血清分群和血清分型鉴定系对病原的精确鉴定·作为选做项目。518
A.1牛肉汤
A.1.1成分
水(丢离子水)
A.1.2制法
附录A
(规范性附录)
培养基制备
A.1.2.1将牛肉除去脂肪、筋膜,用绞肉机绞碎.按肉、水1:2比例混个·搅排均匀。NY/T 564.- 2002
A.1.2.2用不锈钢或耐酸陶瓷双层锅,加温至65(75(保持15nin.继续加热至沸腾.保持1h.全部过程均应不断搅拌。
A.1.2.3点沸光成·携出肉渣,沉淀30mim.抵上清液·经绒布滤过,将滤过的肉汤从肉渣中压粹阳的肉汤混合即成。
A.1.2.4制成的肉汤.即可与猪胃消化液(见第A.3章)混合配制成马「氏肉汤:或分装经103.7kPa灭菌30min40min.存备用
A.1.2.5制备少鼠肉汤时.也可采用将绞碎的牛肉在2倍1~8(水中没泡12h~21h,再煮沸30 min·分装火菌后备用。
A.2改良猪胃消化液
A.2.1成分
猪(清洗时保护胃膜)
去离子水
A.2.2制法
A.2.2.1将猪胃除去脂肪,用绞肉机绞碎。350g
1 000 ml
A.2.2.2碎猪胃350g加65(左右溢水1000ml.并加盐酸8.5ml..放置51(~55(中消化18h~22h,前12h至少搅拌6~10次,待胃组织溶解·液体澄清,即表示消化良好:否则、可酌情予以延长消化川间。
取出后全部倒人中性容器、并加氢氧化钠溶液,调成竭酸性,然后煮沸l0min·使其停止消化
以粗布过滤后,即成。
猪胃消化液
A.3.1成分
猪胃(清洗时保护胃膜)
盐酸(HCI)
去离子水
A.3.2制法
A.3.2.1将猪胃除去脂防,用绞肉机绞碎300g
A.3.2.2按胃、水比例加入65(左右溢水混合均勾、再加人盐酸.使pH为1.6~2.0,保持消化液519
NY/T5642002
51(~55(,消化18 h~24h
A.3.2.3在消化过程的前12h至少搅拌6~10次,然后静置。至胃组织溶解、液体澄清.表示消化完全,如消化不完全,可酌情延长消化时间。A.3.2.4除去脂肪和浮物,抽清液煮沸10min~20min,放缸内静置沉淀48h或冷却到80℃~~90C,加氢氧化钠使成弱酸性,经灭菌贮存备用。A.4改良马丁氏琼脂
A.4.1成分
牛肉汤
改良猪胃消化液(见第A.2章)
氮化钠(NaCl)
琼脂(条状)
A.4.2制法
500 ml
20g~30g
A.4.2.1将牛肉汤、改良猪胃消化液、氯化钠和琼脂条混合(琼脂条须以水充分冲洗拧干),加热溶解。A.4.2.2待琼脂完全溶化后,以氢氧化钠溶液调整pH为7.4~7.6。A.4.2.3以卵自澄清或凝固沉淀法沉淀。A.4.2.4分装于试管或中性玻璃瓶中,以i03.7kPa火菌30min~~40min。A.5马丁氏肉汤
A.5.1成分
牛肉汤(见第A.1章)
猪胃消化液(见第A.3章)
氯化钠(Nacl)
A.5.2制法
A.5.2.1将上列材料混合后.以氢氧化钠溶液调pH7.6~7.8煮沸20min~.10min,补足失去的水分。A.5.2.2冷却沉淀,抽取上清、经滤纸或绒布滤过、滤液应为澄清,淡黄色·按需要分装,经103.7kPa火菌 30 min~~40 in。
A.5.2.3pH应为7.2~7.6。
A.6糖发酵培养基制备
A.6.1 材料
A.6.1.1小试管(内装有倒置小管)灭菌后备用。A.6.1.2糖、醇等(分析纯)(按所需种类准备)。A.6.1.3指示剂:1.6%的溴甲酚紫。A.6.1.41%蛋自藤水(见第A.7章)。A.6.2制法
每种糖(或醇)按质量浓度为1%比例分别加人到装有1%蛋白陈水的瓶中,加热溶解后,按0.1%的比例加人1.6%溴印酚紫指示剂,摇勾后,分装小试管.每支大约6ml,流通蒸汽灭菌3次,每天1次,每次30min。
A.71%蛋白陈水
蛋山陈
氟化钠(NaCI)
蒸馏水
1000 ml
NY/T 564-~2002
将以l材料混合,加热溶解,调整pH7.4。煮沸滤过,分装于中性容器中,103.7kPa灭菌20min。A,8靛基质试验用试剂
对二甲氨基苯甲醛
95%乙醇
纯浓盐酸
吲哚试验试剂(欧-波Ehrlich-Boehme二氏试剂)的配制1.0g
将对甲基氨苯甲醛溶于乙醇中,然后慢慢加进盐酸。此试剂应如量配制,并保存于冰箱内。A.9氧化酶试剂(1%盐酸四甲基对苯二胺溶液)的配制盐酸四甲基对苯二胺
去离子水
100 ml
将1.0g的盐酸四甲基对苯二胺溶于100ml.的去离子水中。A.10运动性培养基的制备
A.10.1材料
A.10.1.1马了氏肉汤(见第A.5章)1000ml.。A. 10. 1.2 琼脂 3. 5 g~4 g。A.10.1.3内装有套管的试管。
A.10.2制法
A.10.2.1将马氏肉汤、琼脂混合加热溶解。103.7kPa灭菌40min.置室温保存备用。A.10.2.2加热溶解琼脂.分装到试管中,以103.7kPa灭30min40)min。A.11麦康凯琼脂培养基
A.11.1成分
蛋自陈
猪胆盐(或牛、羊胆盐)
氯化钠
蒸馏水(或去离子水)
0.01%结晶紫水溶液
0.5%中性红水溶液
A.11.2制法
A.11.2.1将蛋白陈、脉陈、胆盐和氧化钠溶解于400ml.蒸馏水中、校止pH值为7.2。将琼脂加人600ml.蒸馏水.加热溶解。将两液合并,分装于烧瓶内,103kPa高灭菌15min,备用。A.11.2.2临用时加热熔化琼脂.趁热加乳糖,冷至50C~~55(时,加人结晶紫和中性红水溶液,摇匀后倾注平板。
1)结晶紫及中性红水溶液配好后须高压灭菌。2)中性红水溶液配好后须高压灭菌。521
NY/T 564 2002
附录B
(规范性附录)
多杀性巴氏杆菌荚膜分群抗原及致敏红细胞的制备方法B.1多杀性巴氏杆菌英膜抗原的制备B.1.1材料
B.1.1.1改良马丁氏琼脂。
B.1.1.2牛理盐水、pH6.0磷酸盐缓冲盐水。B.1.1.3透明质酸酶。
B.1.2方法
B.1.2.11支改良马丁氏琼脂斜面中管(30mm×230mm)的7h~~24h融合生长的培养物用3ml灭菌生理盐水洗下,置56C水浴加热30min,离心8000r/min,15min,取1清液,即为荚膜抗原B.1.2.2由于有些粘液型菌株的外层被尤抗原性的透明质酸所包被,不能被定群,需经透明质酸酶处理。制备方法如下:1支改良马丁氏琼脂斜面中管7h~~24h的培养物.用3ml.pH6.0磷酸盐缓冲盐水洗下,加人1ml(含15IU)的透明质酸酶溶液(透明质酸酶是用pH6.0的磷酸盐缓冲盐水稀释)。混匀后置36℃-37C水浴作用3h~4h,再用8000r/min离心15min,取上清液即为英膜抗原。B.2新鲜红细胞的制备
B.2.1材料
绵羊脱纤红细胞。
B.2.2方法
绵羊脱纤血液(采集后4周内使用)用6~8倍的生理盐水洗3次,每次皆用离心法收集红细胞(2000r/min),最后一次收集的红细胞,应恢复到原血量的一半。置2C~8(保存,2d内使用B.3致敏红细胞的制备
B.3.1材料
B.3.1.1荚膜抗原(见第B.1章)。B.3.1.2新鲜红细胞(见第B.2章)。B.3.1.3生理盐水。
B.3.2方法
取英膜抗原3ml,加人0.2ml洗净的红细胞,混合均匀后置36(37(作用2h,离心弃上清,再用10mL生理盐水洗1次,最后悬浮于20mL生理盐水中,配制成1%的致敏红细胞悬液。522
附录C
(标准的附录)
多杀性巴氏杆菌菌体分型抗原的制备方法NY/T 564
取1支收良码丁氏琼脂中管斜面24h培养物,用3mI.8.5%氯化钠溶液洗下.置100C水浴中加热1h.4000)r/min离心30min.取其上清液即为琼脂凝胶免疫扩散试验抗原523
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国农业行业标准
NY/T 564—2002
猪巴氏杆菌病诊断技术
Diagnostic techniques for swine pasteurellosis2002-08~27 发布
2002-12-01实施
中华人民共和国农业部发布
NY/T564-2002
猪巴氏杆菌病,又称猪肺疫·是您害我国养猪业的重要疫病之,我因将之楚为类动物疫病。世界动物生织![World Organization for Animal Healih(英),OfficeIntentional desEpizootic(法),OIE]虽无本病的诊断标准,但对牛和禽的巴氏杆菌病的诊断有技术规定,各国多年研究和实践经验表明,由多杀性巴长杆菌(Pusterrllumuliocidu)引起的多种动物疫病其实验室诊断技术基本t是一致的。本标准是参照(IE有关多杀性巴氏杆菌引起的疫病之诊断技术规定和国内外通用方法、依据我国的实践经验制楚的。
本标准的附录八、附求3、附录(是规范性附录。本标准主农业部畜牧兽医局提出。本标准用全国动物检疫标准化技术委员会归山。本标准起草单位:中国兽医药品监察所。本标准主要起草人:关时、毛开荣、钱心元、魏财文、夏业才。311
1范围
猪巴氏杆菌病诊断技术
本标准规定了猪巴氏杆菌病诊断的技术要求。NY/T 564—2002
本标准所规定的临床诊断、病理剖检和病原分离鉴定,适用于猪巴氏杆菌病的诊断,间接血凝试验技术和琼脂扩散沉淀试验技术适用于病原血清学分群和定型鉴定。2临床诊断
猪巴氏杆菌病分流行性和散发性两类。2.1流行性
特点是病程很短,发病快,体温可高达41(以上。分最急性型和急性型两种。最急性型:多发生在流行初期,呼吸困难.心跳加快,于数小时内死广.急性型:病状主要分两种,一种表现为咽炎症状,咽喉部皮肤发红、热痛肿胀、坚硬,延伸可达到耳根及颈部。常犬坐式伸长头颈呼吸。腹侧、耳根和四肢内侧可发现红色斑点。口、眼等可视粘膜呈暗红色。经出现呼吸症状,病情即迅速恶化,口、鼻流出泡沫状分泌物,死亡率达到100%。另种为急性胸膜炎病状,表现为呼吸困难,痊挛性干咳,触诊胸部有疼痛感,鼻流稠粘液。初便秘后腹泻,病后期皮肤有紫斑或点。病程约4d~6d。
2.2散发性
常年都有发生,病程初期体温升高到41C左右。呈现呼吸困难,偶尔表现急促腹式呼吸。间有咳嗽。口、鼻和肛门粘膜及四肢皮肤呈暗紫色,颈部无红肿病状,由于病程长,诸多病例逐渐消瘦死亡。3病理剖检
3.1最急性型
病理变化不明显、常见皮肤、皮下、浆膜、黏膜有大量出血点。3.2急性型
主要表现咽喉部的结缔组织呈出血性浆液性炎。口腔和鼻孔流出红色泡沫状液体。皮下组织有大量出血点,全身淋巴结出血、断面呈红色,颈部淋巴结肿大.有渗出液,全身各脏器浆膜和黏膜及皮肤呈现点状出,脾不肿大。
3.3散发性
颈部不肿胀、喉头充血、出血,气管有大量泡沫,肺脏呈现水肿、气肿、充血、出血,纤维素性胸膜肺炎病变,局部出现红色和灰色肝变,肺叶切面呈大理石状。胸膜常有纤维素状附着物、胸腔及心包时有积液。
4病原分离鉴定
4.1材料
4.1.1改良马丁氏琼脂。
4.1.2了氏肉汤。
4.1.3糖发酵培养基。
NY/T 564---2002
4.1.41%蛋自陈水。
4.1.5吲哚试验试剂(靛基质试验试剂)(Ehelich-Boehme二.氏试剂)。4.1.6氧化酶试验用试剂(1%盐酸四甲基对苯二胺溶液)。4.1.7运动性试验用培养基(半固体培养基)。4.1.8麦康凯琼脂培养基。
以上各种培养基配制方法见附录A。4.2病原分离
将濒死前或死后数小时内以无菌手术采取病死猪的心血、肝脏组织·接种于改度马丁氏琼脂(见第A.4章)斜面,麦康凯琼脂(见第A.11章)平皿,含10%绵羊全血的改良码丁琼脂平Ⅲ,含有0.1%裂解健康动物红细胞的全血、4%健康动物血清的改良马丁氏琼脂平皿及马丁氏肉汤(见第A.5章)小管培养基,置36(~37C培养。
4.3病原鉴定
4.3.1病原形态
病原为多杀性巴氏杆菌,用肝脏组织或心血抹片可见革兰氏染色阴性,瑞氏染色皇两极浓染的球杆菌。
4.3.2培养特性
培养18h~24h后,改良马丁琼脂斜面生长纯粹的培养物,呈微蓝色菌苔或菌落。马丁肉汤培养物生长为均匀混浊,不产生菌膜。麦康凯琼脂平Ⅲ上不生长。10%的血琼脂平耻上生长的菌落不出现溶血。在含有0.1%裂解血球全血、4%健康动物血清的改良马丁氏琼脂平血上,的单个菌落,肉眼观察光滑圆整,直径2mm~3mm,半透明,呈微蓝色。在低倍显微镜45°折光下观察,应有虹彩,为蓝绿色荧光(Fg菌落型),或桔红色荧光(Fo菌落型)。4.3.3生化特性
4.3.3.1糖发酵试验:用1%蛋白陈水(见第A.7章),将改良马丁氏琼脂18h~24h的培养物洗下,接种糖发酵管(见第A.6章),置36℃~37C培养7d~10d,每天记录反应结果。本菌应发酵葡萄糖、果糖、半乳糖,多数发酵蔗糖,不发酵乳糖、肌醇、菊糖、水杨素及鼠李糖。4.3.3.2吲哚试验:用1%蛋白陈培养基的48h培养物加人吲哚试验试剂(见第A.8章)0.5mL,沿管壁流下,覆盖于培养液表面,液面接触处呈玫瑰红色,为阳性反应4.3.3.3氧化酶试验:取白色洁净滤纸一角,蘸取菌落少许,加试剂(见第A,9章)1滴,立即呈粉红色,为阳性反应,并于5s~10s内呈现深紫色。4.3.3.4运动性试验:用铂金耳钩取固体培养物接种运动性培养基(见第A.10章)倒置小试管的套管内,36℃~37(3d,在套管内生长,无运动性。4.4毒力
4.4.1材料
4.4.1.18g~22g健康小白鼠4只。4.4.1.2马丁氏肉汤。
4.4.2方法
取码丁肉汤24h的培养物,用马丁肉汤稀释约为1.000个菌体/ml.,皮下接种18g~22g健康小白鼠4只,应死亡。
4.5血清学试验
用以确定血清群和血清型。
4.5.1间接血凝试验(Carter氏英膜分群法)4.5.1.1材料
所需材料如下:
a)多杀性巴氏杆菌A、B、D分群血清;b)新鲜红细胞;
c)致敏红细胞;
d)牛理盐水、pH6.0磷酸盐缓冲盐水。a)b)、c)试剂配制方法见附录B。4.5.1.2操作方法
NY/T 564--2002
4.5.1.2.1分群血清于56C水浴30min(除去非特异性的凝聚因子),用生理盐水作10倍稀释后再进行连续对倍稀释至第8管,取每个稀释度0.2 mL加到小圆底试管。4.5.1.2.2每支小圆底试管加人致敏红细胞(见第B.4章)0.2mL。4.5.1.2.3设对照组:
血清对照:血清(5倍稀释)0.2ml.+加新鲜红细胞(见第B.3章)0.2mL新鲜红细胞对照:新鲜红细胞0.2ml.十生理盐水0.2ml.。抗原对照:致敏红细胞0.2mL+生理盐水0.2ml.。间接血凝试验程序见表1。
表 1 间接血凝试验程序
反应物
血清稀释倍数
血清最终稀释
血清加量
血清对照
第一次加0.3%(0.4弃去10.8
甲醛生理盐水量
第二次加0.3%
甲醛生理盐水量
%致敏红细bzxZ.net
1%新鲜红细
4.5.1.2.4充分振荡小圆底试管后,置室温20C左右1h~2h判定结果。4.5.1.3判定
判定标准:每个试管按其管底红细胞的凝集现象分别记以“#”红细胞凝集形成坚实的凝块,边缘不整齐。#”
“十十十”凝集的红细胞平铺管底,但有卷边或缺口。凝集的红细胞平铺管底。
\++”
“十”红血球凝集面积较小,有狭窄的增厚边缘或中心的红细胞凝集。“士”红细胞形成小的光滑圆盘,中心有不明显的红细胞凝集。二”红细胞形成小的光滑圆盘。以“十十”作为样品的滴度。
4.5.2琼脂扩散沉淀试验(Heddleston氏菌体分型法)4.5.2.1材料
4.5.2.1.1优级琼脂(DIFCO)粉(或同质量的产品)1.0g。4.5.2.1.28.5%氯化钠溶液100ml.。液体量单位为毫升
抗原对照血球对照
(0.2)弃去
+#*++*
、“士”及
NY/T564-2002
4.5.2.1.31%硫柳汞溶液1ml。
4.5.2.1.4多杀性巴氏杆菌菌体分型血清,1~16个血清型。4.5.2.1.5抗原。制备方法见附录C。4.5.2.2方法
用8.5%氯化钠溶液100ml.十琼脂1.0g加热溶化后再加人1ml.1%:硫柳求,混合凉至60C左在倒人平皿内,琼脂厚度2.5mm~3mm,琼脂冷凝后,打孔,孔径4mm孔与孔中心距离为6mm,每组5孔,中央孔加待检抗原(见第(.2章),滴满为度(约0.03mI.).四周孔加分型血清(见第(.1章)分别加人到四周孔。置36(37(,24h~48h后判定结果。4.5.2.3判定
在抗原与血清孔之间出现明显的沉淀线为阳性。5
诊断判定
根据临床症状和病理变化、加上涂片染色镜检,订对本病进行初步诊断·但确诊要靠病原分离鉴定其中血清分群和血清分型鉴定系对病原的精确鉴定·作为选做项目。518
A.1牛肉汤
A.1.1成分
水(丢离子水)
A.1.2制法
附录A
(规范性附录)
培养基制备
A.1.2.1将牛肉除去脂肪、筋膜,用绞肉机绞碎.按肉、水1:2比例混个·搅排均匀。NY/T 564.- 2002
A.1.2.2用不锈钢或耐酸陶瓷双层锅,加温至65(75(保持15nin.继续加热至沸腾.保持1h.全部过程均应不断搅拌。
A.1.2.3点沸光成·携出肉渣,沉淀30mim.抵上清液·经绒布滤过,将滤过的肉汤从肉渣中压粹阳的肉汤混合即成。
A.1.2.4制成的肉汤.即可与猪胃消化液(见第A.3章)混合配制成马「氏肉汤:或分装经103.7kPa灭菌30min40min.存备用
A.1.2.5制备少鼠肉汤时.也可采用将绞碎的牛肉在2倍1~8(水中没泡12h~21h,再煮沸30 min·分装火菌后备用。
A.2改良猪胃消化液
A.2.1成分
猪(清洗时保护胃膜)
去离子水
A.2.2制法
A.2.2.1将猪胃除去脂肪,用绞肉机绞碎。350g
1 000 ml
A.2.2.2碎猪胃350g加65(左右溢水1000ml.并加盐酸8.5ml..放置51(~55(中消化18h~22h,前12h至少搅拌6~10次,待胃组织溶解·液体澄清,即表示消化良好:否则、可酌情予以延长消化川间。
取出后全部倒人中性容器、并加氢氧化钠溶液,调成竭酸性,然后煮沸l0min·使其停止消化
以粗布过滤后,即成。
猪胃消化液
A.3.1成分
猪胃(清洗时保护胃膜)
盐酸(HCI)
去离子水
A.3.2制法
A.3.2.1将猪胃除去脂防,用绞肉机绞碎300g
A.3.2.2按胃、水比例加入65(左右溢水混合均勾、再加人盐酸.使pH为1.6~2.0,保持消化液519
NY/T5642002
51(~55(,消化18 h~24h
A.3.2.3在消化过程的前12h至少搅拌6~10次,然后静置。至胃组织溶解、液体澄清.表示消化完全,如消化不完全,可酌情延长消化时间。A.3.2.4除去脂肪和浮物,抽清液煮沸10min~20min,放缸内静置沉淀48h或冷却到80℃~~90C,加氢氧化钠使成弱酸性,经灭菌贮存备用。A.4改良马丁氏琼脂
A.4.1成分
牛肉汤
改良猪胃消化液(见第A.2章)
氮化钠(NaCl)
琼脂(条状)
A.4.2制法
500 ml
20g~30g
A.4.2.1将牛肉汤、改良猪胃消化液、氯化钠和琼脂条混合(琼脂条须以水充分冲洗拧干),加热溶解。A.4.2.2待琼脂完全溶化后,以氢氧化钠溶液调整pH为7.4~7.6。A.4.2.3以卵自澄清或凝固沉淀法沉淀。A.4.2.4分装于试管或中性玻璃瓶中,以i03.7kPa火菌30min~~40min。A.5马丁氏肉汤
A.5.1成分
牛肉汤(见第A.1章)
猪胃消化液(见第A.3章)
氯化钠(Nacl)
A.5.2制法
A.5.2.1将上列材料混合后.以氢氧化钠溶液调pH7.6~7.8煮沸20min~.10min,补足失去的水分。A.5.2.2冷却沉淀,抽取上清、经滤纸或绒布滤过、滤液应为澄清,淡黄色·按需要分装,经103.7kPa火菌 30 min~~40 in。
A.5.2.3pH应为7.2~7.6。
A.6糖发酵培养基制备
A.6.1 材料
A.6.1.1小试管(内装有倒置小管)灭菌后备用。A.6.1.2糖、醇等(分析纯)(按所需种类准备)。A.6.1.3指示剂:1.6%的溴甲酚紫。A.6.1.41%蛋自藤水(见第A.7章)。A.6.2制法
每种糖(或醇)按质量浓度为1%比例分别加人到装有1%蛋白陈水的瓶中,加热溶解后,按0.1%的比例加人1.6%溴印酚紫指示剂,摇勾后,分装小试管.每支大约6ml,流通蒸汽灭菌3次,每天1次,每次30min。
A.71%蛋白陈水
蛋山陈
氟化钠(NaCI)
蒸馏水
1000 ml
NY/T 564-~2002
将以l材料混合,加热溶解,调整pH7.4。煮沸滤过,分装于中性容器中,103.7kPa灭菌20min。A,8靛基质试验用试剂
对二甲氨基苯甲醛
95%乙醇
纯浓盐酸
吲哚试验试剂(欧-波Ehrlich-Boehme二氏试剂)的配制1.0g
将对甲基氨苯甲醛溶于乙醇中,然后慢慢加进盐酸。此试剂应如量配制,并保存于冰箱内。A.9氧化酶试剂(1%盐酸四甲基对苯二胺溶液)的配制盐酸四甲基对苯二胺
去离子水
100 ml
将1.0g的盐酸四甲基对苯二胺溶于100ml.的去离子水中。A.10运动性培养基的制备
A.10.1材料
A.10.1.1马了氏肉汤(见第A.5章)1000ml.。A. 10. 1.2 琼脂 3. 5 g~4 g。A.10.1.3内装有套管的试管。
A.10.2制法
A.10.2.1将马氏肉汤、琼脂混合加热溶解。103.7kPa灭菌40min.置室温保存备用。A.10.2.2加热溶解琼脂.分装到试管中,以103.7kPa灭30min40)min。A.11麦康凯琼脂培养基
A.11.1成分
蛋自陈
猪胆盐(或牛、羊胆盐)
氯化钠
蒸馏水(或去离子水)
0.01%结晶紫水溶液
0.5%中性红水溶液
A.11.2制法
A.11.2.1将蛋白陈、脉陈、胆盐和氧化钠溶解于400ml.蒸馏水中、校止pH值为7.2。将琼脂加人600ml.蒸馏水.加热溶解。将两液合并,分装于烧瓶内,103kPa高灭菌15min,备用。A.11.2.2临用时加热熔化琼脂.趁热加乳糖,冷至50C~~55(时,加人结晶紫和中性红水溶液,摇匀后倾注平板。
1)结晶紫及中性红水溶液配好后须高压灭菌。2)中性红水溶液配好后须高压灭菌。521
NY/T 564 2002
附录B
(规范性附录)
多杀性巴氏杆菌荚膜分群抗原及致敏红细胞的制备方法B.1多杀性巴氏杆菌英膜抗原的制备B.1.1材料
B.1.1.1改良马丁氏琼脂。
B.1.1.2牛理盐水、pH6.0磷酸盐缓冲盐水。B.1.1.3透明质酸酶。
B.1.2方法
B.1.2.11支改良马丁氏琼脂斜面中管(30mm×230mm)的7h~~24h融合生长的培养物用3ml灭菌生理盐水洗下,置56C水浴加热30min,离心8000r/min,15min,取1清液,即为荚膜抗原B.1.2.2由于有些粘液型菌株的外层被尤抗原性的透明质酸所包被,不能被定群,需经透明质酸酶处理。制备方法如下:1支改良马丁氏琼脂斜面中管7h~~24h的培养物.用3ml.pH6.0磷酸盐缓冲盐水洗下,加人1ml(含15IU)的透明质酸酶溶液(透明质酸酶是用pH6.0的磷酸盐缓冲盐水稀释)。混匀后置36℃-37C水浴作用3h~4h,再用8000r/min离心15min,取上清液即为英膜抗原。B.2新鲜红细胞的制备
B.2.1材料
绵羊脱纤红细胞。
B.2.2方法
绵羊脱纤血液(采集后4周内使用)用6~8倍的生理盐水洗3次,每次皆用离心法收集红细胞(2000r/min),最后一次收集的红细胞,应恢复到原血量的一半。置2C~8(保存,2d内使用B.3致敏红细胞的制备
B.3.1材料
B.3.1.1荚膜抗原(见第B.1章)。B.3.1.2新鲜红细胞(见第B.2章)。B.3.1.3生理盐水。
B.3.2方法
取英膜抗原3ml,加人0.2ml洗净的红细胞,混合均匀后置36(37(作用2h,离心弃上清,再用10mL生理盐水洗1次,最后悬浮于20mL生理盐水中,配制成1%的致敏红细胞悬液。522
附录C
(标准的附录)
多杀性巴氏杆菌菌体分型抗原的制备方法NY/T 564
取1支收良码丁氏琼脂中管斜面24h培养物,用3mI.8.5%氯化钠溶液洗下.置100C水浴中加热1h.4000)r/min离心30min.取其上清液即为琼脂凝胶免疫扩散试验抗原523
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 农业行业标准(NY)
- NY/T5295-2004 无公害食品 产地环境评价准则
- NY/T2669-2014 热带作物品种审定规范 木薯
- NY/T598-2002 食用绿豆
- NY5086-2002 无公害食品 鲜食葡萄
- NY/T797-2004 硅肥
- NY/T1858.2-2010 番茄主要病害抗病性鉴定技术规程 第2部分:番茄抗叶霉病鉴定技术规程
- NY/T1153.4-2013 农药登记用白蚁防治剂药效试验方法及评价 第4部分农药木材处理预防白蚁
- NY469-2001 葡萄苗木
- NY/T456-2001 茉莉花茶
- NY5187-2002 无公害食品 罐装金针菇
- NY/T749-2003 绿色食品 食用菌
- NY/T889-2004 土壤速效钾和缓效钾含量的测定
- NY/T1378-2007 土壤氯离子含量的测定
- NY/T1364-2007 温室齿条开窗机
- NY/T1159-2006 中华蜜蜂种蜂王
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2