- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0169. 2-1994 丁基橡胶抗生素瓶塞
标准号:
YY 0169. 2-1994
标准名称:
丁基橡胶抗生素瓶塞
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
763.10 KB
点击下载
标准简介:
YY 0169. 2一1994.
6.3.4瓶塞的紫外吸光度、还原物质、混浊度、pH变化值四项化学性能应全部合格。
6.4型式检验
6.4.1' 当出现下列情况之一时,应进行型式检验;
a. 原材料或工艺有较大改变时$
b. 停产6个月后恢复生产时;
c.。 连续生产12个月时。
6.4.2型式检验的项 目为技术要求中规定的全部性能。其中主要尺寸及外观的验收按6. 3.3条规定;物理性能、化学性能、生物性能应全部合格。
6.4.3若型式检验不合格,应停止生产,分析原因并采取措施,直至新的型式检验合格才能恢复生产。
6.5 交验规则
使用方收货验收时,如有任何一项指标达不到规定,则使用方和生产方对该不合格项目进行会同检验,以会同检验结果判定该批产品合格或不合格。
7标志.包装、运输、贮存
7.1 标志
包装箱上应印有产品名称、型号、数量、批号、生产日期、生产厂名、厂址、商标及“怕热”、“湿”、“小心轻放”的图示标志,图示标志应符合GB191规定。
7.2 包装
7.2.1瓶塞的 包装由内、外包装组成。
7.2.2瓶塞的内包装用洁净的双层聚乙烯塑料袋封装。
7.2.3瓶塞的外包装为 瓦楞纸箱包装,瓦楞纸箱应符合GB 6543中2类双层瓦楞纸箱规定。
7.2.4包装箱内应附有产 品合格证。产品合格证应有产品名称、型号、批号、检验日期、检验员代号。
7.2.5瓶塞的每箱装量- 般不超过20 kg.
7.3 运输
瓶塞在运输过程中,应防止堆码不当,避免强阳光照射和雨雪浸淋,防止与酸、破物质接触,防止外包装破损,保持瓶塞清洁。
7.4贮存
瓶塞应贮存在干燥通风、无化学污染物的库房内,贮存温度应在30C以下,瓶塞保质期为7年。瓶塞贮存超过6个月须进行复验,合格后方可出厂、使用。
部分标准内容:
YY 0169.294
丁基橡胶抗生素瓶塞
1994-07-02发布
国豪医药管理局
1994-11-01实施
(京)新登物3号
中华人民共和国医药
行业标准
丁基橡胶抗生素瓶塞
YY 0169. 2--94
中国标准出版社出版
北京复兴门外三里河北街16 号
邮政编码:100045
话:8522112
中国标准出版社北京印制厂印制新华书店北京发行所发行各地新华书店经售版权有·不得随印
开本880×12301/16印张3/4字数20千字1994-年10月第服--1:994年-1:0月第次印削--印数1-2000
满号:155066起29550定价:3.0:元中华人民共和国医药行业标准
丁基檬胶抗生素瓶塞
本标准等效来用国际标准ISO8362-2—1988医用注射器具1主题内容与适用范围
YY 0169. 2---94
第二部分注射瓶瓶赛”
本标准规定了丁基橡胶抗生素瓶塞的产品分类、技术要求、试验方法、检验规则、标志、包装、运输和贮存。
本标准适用于以丁基橡胶为主要原料制造的一次性使用的抗生素瓶赛(以下简称\瓶塞\)。2引用标准
包装储运图示标志
GB531橡胶邵尔A型硬度试验方法GB2828遥批检查计数抽样程序及抽样表(适用于连续批的检查)GB3672、橡胶实心模压和压出制品尺寸公差GB6543瓦楞纸箱
GB 6682
实验室用水规格
GB/T14233.2.医用输液、输血、注射器具检验方法第二部分,生物试验方法
YY/T0169.3丁基橡胶药用瓶塞化学试验方法3产品分类
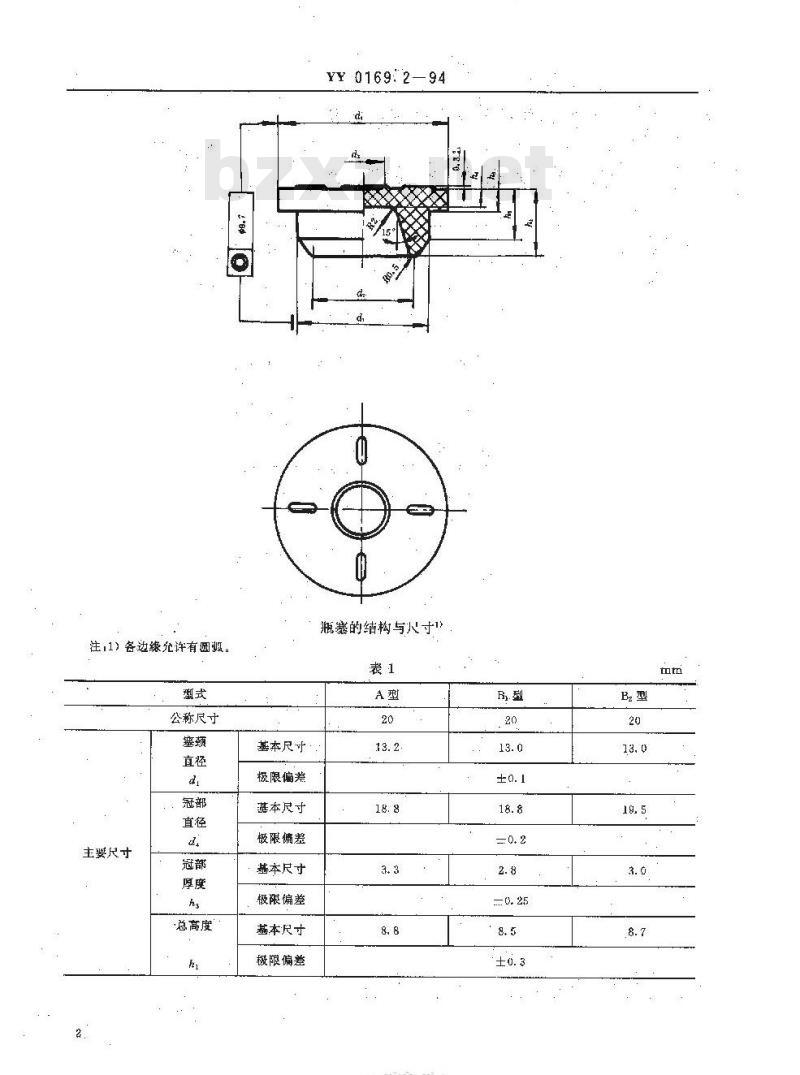
3.1瓶塞按所配套的瓶子类型分为A型,B型两种。3.2:瓶塞的结构和尺寸接下图、表1规定:3.3标记示例
符合本标准要求,型式A型,公称尺寸20.mm的丁基橡胶抗生素瓶塞标记为:丁基橡胶抗生素瓶塞20-AYY0169.2—94国家医药管理属1994-07-02批准1994-11-01实施
注,1)各边缘允许有圆。
公称尺寸
主娶尺寸
总高度
基本尺叶:
极限偏差
湛本尺寸
极限偏差
基本尺寸
极限偏差
基本尺寸
极限偏差
YY 0169:2
瓶塞的结构与寸
KAONIKAca
黎考尺守1
YY0169.2-94
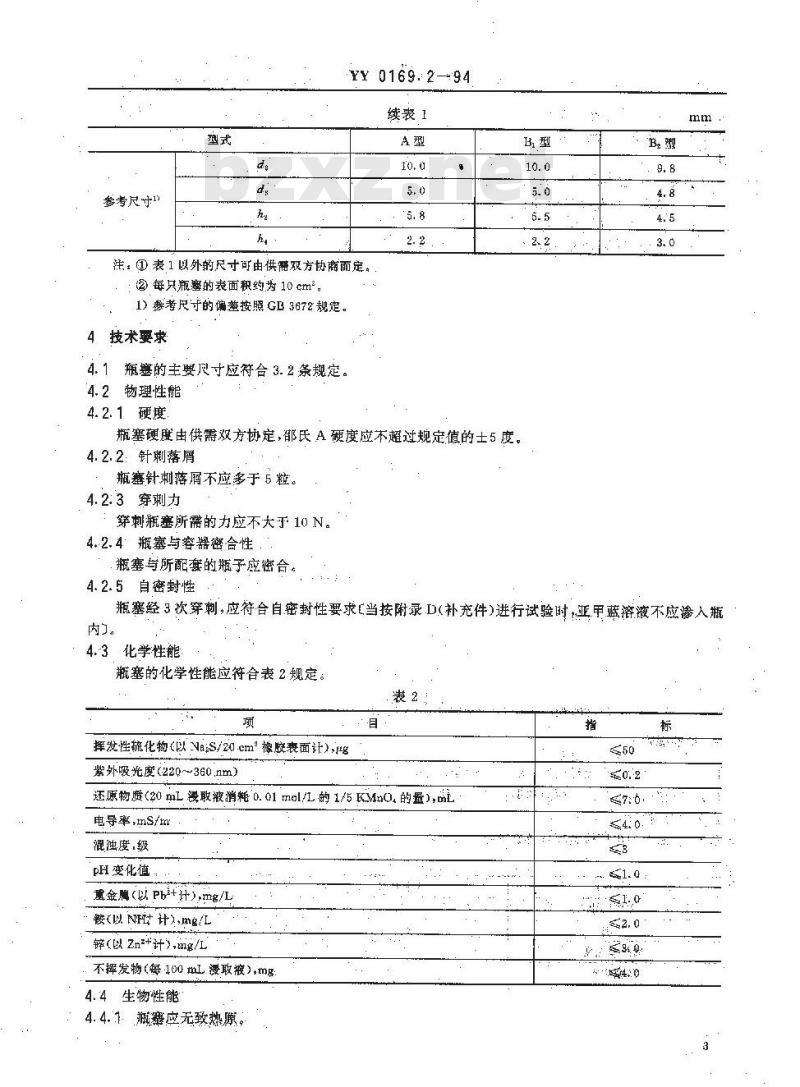
续表1
注:①表1以外的尺寸可由供需双方协商而定。②每只瓶癌的表面积约为10cm。1)誉考尺守的偏整按照GL3672规定。技术要求
瓶塞的主要尺寸应符合3.2条规定4.2物理性能
4.2.1硬度
瓶塞硬度由供需双方协定,都氏A硬度应不超过规定值的士5度。4.2.2:针刺落屑
瓶塞针刺落屑不应多于 5粒。
4.2:3穿刺力
等刺瓶塞所需的力应不大于 10 N。4.2.4瓶塞与容器密合性
瓶塞与所配套的瓶子应密合。
4.2.5自密封性
瓶塞经3次穿刺,应符合自密封性要求E当按附录D(补充件)进行试验时,亚甲蓝溶液不应渗入瓶内了。免费标准下载网bzxz
4.3化学性能
瓶塞的化学性能应符合表2规定。表2
挥发性梳化物(以NaaS/20.cm橡胶表面),g紫外吸光魔(220~360.nm)
还原物质(20 mL没敢液消耗0. 01 mal/L的1/5 EMnO,的量),L电导率,mS/m
混浊度.级
PH变化值
重金网(以 Phi+计),mg/L
铵(以 NF+ 计),m&/L
锌(以 Zn+计),mg/L
不挥发物(每100mL浸取被),mg:4.4生物性能
4.4.7.瓶塞应无致热原。
4.4.2瓶塞应无急性全身毒性。
4.4.3瓶塞应无溶血作用。
4.5外观
瓶塞的外观应符合下列规定:
表面不应有污点,杂质,
表面不应有气泡、裂纹,
裹面不应有缺胶、粗糙
YY 0169.294
表面不应有胶丝、胶屑、海绵状、毛边;不应有除边道成的残缺或锯齿现象!不应有模具造成的明显痕迹;
表面的色泽应均匀。
4.6工艺要求
瓶塞出」前须进行清洗和硅化处理。5试验方法
5.1尺寸
以通用量具或专用量具检验。
5.2物理性能
5.2.1硬度,按GB.531规定进行(试片由生产厂提供)5. 2. 2 针刺落屑 按附录 A(补充件)和附录 B(补充件)进行。5.2.3穿刺力:按附录A(补充件)和附录C(补充件)进行。5. 2. 4瓶塞与容器的密合性和自密封性,按附录 D(补充件)进行。5.3化学性能
按 YY/T 0169.3进行。
.5.4生物性能
按 GB/T 14233.2进行。
5.5'外观
以目力检验必要时辅以游标卡尺或10倍放大镜,6检验规则
6.1瓶塞交货出厂须经生产厂的质量检验部门检验合格。6.2瓶塞的检验分出广检验和型式检验两种。6. 3出厂检验
6. 3. 1·瓶塞的出厂检验项目及要求按表 3规定表3
梳验项围
主要尺寸,
紫外吸光度
还源物质
混浊度
PH变化值
技术要求
YTKAONIKACa
试验方法
YY: 0169.2-94
6.3.2批量以生产厂日产整或班,台产量组批。6.3.3瓶塞的尺寸、外观的出厂检验执行GB2828,6.3.3.1抽样方案由供需双方商定选择一次、二次或五次抽样方案。6.3.3:2尺寸的不合格分类、检查水平和合格质量水平按表4规定。表4
不合格分类
合格质盘水平
检查水平
6. 3. 3. 3
冠部厚度超偏差
外观的不合格分类、检查水平和合格质盘水平按表5.规定表5
不合格分类
合格质量水平
检查水平
针刺圈内或与内容物接触面
有污点、杂质
针圈内或密封面有气泡.裂
塞颈直径、冠部直径超偏差
表简有污点、杂质、胶丝、胶
屑、海绑状毛边
塞颈部分粗髓
明显缺胶
除逆造成的綫缺和锯齿
由模具造成的痕迹
色泽明显不均匀
6.3.4瓶塞的紫外吸光度、还原物质、混浊度、pH变化值四项化学性能应全部合格。6.4型式检验
6.4.1当出现下列情况之一时,应进行式检验:原材料或工艺有较大改变时,
b.停产6个月后恢复生产时;
c,连续生产12个月时。
6.4.2.型式检验的项目为技术要求中规定的全部性能。其中主要尺寸及外观的验收按6.3.3条规定物理性能、化学性能、生物性能应全部合格。6.4.3若型式检验不合格,应停止生产,分析原因并采取措施,直室新的型式检验合格才能恢复生产6.5交验规则
使用方收货验收时,如有任何一项指标达不到规定,则使用方和生产方对该不合格项目进行会同检验,以会同检验结果判定该批产品合格或不合格。7标志、包装、运输、贮存
7.1标志
包装箱上应印有产品名称、型号、数悬、批号、生产日期、生产厂名、厂址、商标及“怕热”、“怕湿”“小心轻放”的图示标志,图示标志应符合GB191规定。7.2包装
7.2、1瓶塞的包装由内、外包装组成。7.2.2瓶塞的内包装用洁净的双层聚乙烯塑料袋封装。:7.2.3瓶塞的外包装为瓦楞纸箱包装,瓦楞纸箱应符合GB6543中.2类双层瓦楞纸箱规定。5
YY 0169.2--94
:7.2.4包装箱内应附有产品合格证。产品合格证应有产品名称,型号、批号检验日期,检验员代号7.2. 5瓶塞的每箱装量一般不粗过 20:kg7.3运输
瓶鑫在运输过程中,应防止堆码不当,避免强阳光射和俩雪漫淋,防止与酸、碱物质接触,防止外包装破损,保持瓶塞清洁。
7.4赔存
瓶塞应贮存在干燥、通风,无化学污染物的库房内,贮存温度应在30℃以下,瓶塞保质期为7年。瓶塞贮存超过6个月须进行复验,合格后方可出厂、使用。KAoNrKAca
A1仪器和器血
A1.1高压蒸汽消溝器。
A1.2恒温干燥箱。
A2处理方法
YY 0169.2--94
附录A
样品的预处理方法
(补充件)
A2.1试验用水在没有注明其他要求时应符合GB 6682中二级水的规定。A2.2计算出全部被测瓶塞的总表面积Acm(每只瓶塞的表面积为10cm\),将瓶塞效人烧杯中,加2AmL水漫没瓶塞,煮沸5min,用水冲洗5次。将瓶塞放入三角烧瓶中,加入2.AmL水,并漫没瓶塞。用铝箱或一只硅硼酸盘烧怀将烧瓶口盖住,放入高压蒸汽消毒器中加热,在30min内温度升到121士1℃并维持30 min。
布30mtn内使瓶塞冷却至室温,取出。在60C条件下烘60min,贮存于密封的玻璃容器中备用。A3上述瓶塞供针刺落屑和穿刺力试验用。附录B
针刺落屑的测定方法
(补充伴)
B1原理
本试验是测量瓶塞的针刺落屑性能。由干测量值受诸多因素影响,如瓶塞的预处理,封盖器具的结构形式,密封力、注射针尖的锋利度、针上润滑剂的涂量及操作者的视力等,必须对这些变盘加以控制以获得可比结果。故被测瓶赛应与已知样晶进行比较,B2仪器和器血
注射瓶,与瓶塞配套。
B2.2铝盖,与瓶塞配套。
B2.3手动封盖机。
快速滤纸及布氏瀚斗。
B2.5注射针;外径0.8 mm.
B2.6注射器:5ml.。
B3测定步骤
B3.1:敢50只与被测瓶塞配套的注射瓶,每只瓶中注人半瓶水,在25只瓶上各放一只被测瓶塞,另25只瓶上各放一只已知其针刺落屑性能的瓶塞,瓶塞均按附录A(补充件)规定处理过。
加上铝盖,用手动封盖机封口,按图B1所示排列,打开铝盖针刺部位。第一推
试验规塞
YY 0169.2—94
已知针蕊落厚瓶痛
瓶塞与瓶组合
1 26 2 27 3
28 4 29 5 30
6 31 7 32 8
每支针计只能刺20次
图B1针刺落屑试验程序
用丙酮或甲基-异丁基酮擦拭注射针,并装在注射器上。B3.3将注射充水并除去针头上的水。B3.4使1号瓶保持直立,手握注射器垂直向1号瓶塞标记区域内针刺,拔出针头,B3.5按B3.4步骤再做三次,最后一次拨出针头前,将1mL的水法入瓶内。B3.6对26号瓶塞(即第二排中第1个瓶塞)重复B3.3至B3.5步骤。B3.7两排瓶塞按图B1箭头所示交替重复B3.3~B3.6的步骤,直至每只瓶塞被针刺四次。B3.8每针20次后,更换一支注射针,重复B3.2步骤。B3.9取下第一排被测瓶塞,将瓶中水全部通过快速滤纸过滤,确保瓶中不残留落屑。在一般条件下,眼与滤纸距离为25cm,用肉眼观察并记录快速滤纸上的落履数:B3.10对第二排已知针刺落屑性能的瓶塞重复B3.9步骤。B4
结票表示
报告各排瓶塞100次针刺所记录的落属整B5有效性判断
如果总知瓶塞的结果与先前测得的结果具有一一致性,则应判试验瓶塞测得的结果有效。反之,则无效。
附录℃
案刺力的测定方法
(补充件)
仪器和器血
c1.1注射针:外径0.8mm。
C1.2注射瓶与被测瓶塞配套。
HYYKAONYKACa
C1.3铝盖:与瓶塞配套。
:C1.4手动封机
YY 0169.2-94
C1.5针刺装置,装置中针刺器能以200mm/min的速度垂直运动,运动期间针刺器受到的反作用力能被指示和记,精度为士2 N。
注射瓶能效进装置并保持同轴,以能对瓶塞中心针刺。C2
测定步骤
C2.1用丙酮或甲基-异丁基酮擦拭注射针后,装于针刺装置上C2.2取10只瓶,分别放上一只按附录A(补充件)规定处理的瓶塞,盖上铝靠,用手动封盖机封盖、打开铝盖针刺部位,将瓶放入针刺装骨中,使注射针垂直刺向瓶塞,记录刺穿瓶塞时所施加的C2.3
C2.4重复C2.3步骤,使所有被测瓶塞针刺1次。c3
结果衰示
报告被测瓶塞中最大穿刺力的值。附录D
瓶塞与容器的密合性和自密封性的测定方法(补充件)
D1原理
瓶塞与瓶密合性的测定(包括经针刺和未经针刺的瓶塞),是通过外部局部真空抽出瓶中空气,观察有色溶液是否被吸进负压瓶中。D2试痫
10g/1亚甲蓝溶液:称取1.0z亚甲蓝,用水溶解并稀释至100mLD3
仪器和器血
注射瓶,与瓶配套。
铝盘:与瓶塞配套。
D3.3手动封盖机。
D3.4注射针,外径为0.8mm。
D3.5针刺装置:同附录C(补充件)中C1.5条D3.6真空箱。
D3.7烧杯:1000mL。
D3.8高压蒸汽消毒器。
D3.9.恒温干燥箱。
D4测宠步骤
D4.1试验前2h内对被测瓶赛进行预处理,将瓶塞放入水中煮沸5min后取出,在70℃恒温干燥箱中干燥ih。
D4.2在20只瓶中,每只加半瓶水,将瓶塞和铝用手动封盖机封口后,放入高压蒸汽消器中;于121YY0169.2—94
土1℃条件下加热30 min,联出后冷却,放置24 hD4.3将1只按D4.2准备的组件打开铝盖穿刺部位,放在针刺装置中,装工城内不同位暨穿剌3次。
D4.4在另9只组件上重复D4.3步骤。D4.5 每穿刺10次后换一支新注射针。支注射针,在瓶塞标记区
D4.6取上述20只组件(包括针刺过的和未针刺过的)放进装有亚甲蓝溶液(D2)的烧杯中,使其完全漫没。将烧杯放入真空箱中,抽真空至75士5kPa,维持30 min;使真空箱恢复至常压,再维持30.min。取出组件,用自来水冲洗瓶外,以目力检查亚甲蓝溶液是否渗人瓶内。D5结巢囊示
分别报告装有末针刺过和针刺过的瓶塞的瓶内溶液虽现颜色的个数。同时注明抽真空时的试验温度和带压下的试验阖度。
附加说明,
本标准由国家医药管理局提出。本标准由国家医药管理厨医用高分子产品质量检测中心归。本标准由潮北华强化工厂负贵起草。本标催主要起草人肖美芳、李吉生、赵明艳、主继柏、王秀臣。版权变有不得翻印
书号:155066·2-9550
定你:
TTYKAONTKAca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 热门标准
- YY医药标准
- YY0345-2002 骨接合植入物金属骨针
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY/T0452-2003 止血钳
- YY/T0179-2005 丁字式开口器
- YY0062-1991 X射线管组件固有滤过
- YY/T0457.6-2003 医用电气设备 光电X射线影像增强器特性 第6部分:对比度及炫光系数的测定
- YY0476-2004 眼内冲洗灌注液
- YY/T0279-1995 口腔材料生物试验方法 口腔粘膜刺激试验
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T1533-2017 全自动时间分辨荧光免疫分析仪
- YY0322-2000 高频电灼治疗仪
- YY0320-2000 麻醉机
- YY/T0268-2001 牙科学 用于口腔的医疗器械生物相容性临床前评价 第1单:评价与试验项目选择
- YY0011-1990 X射线摄影暗匣
- YY0014-1990 生化分析仪
- 行业新闻
网站备案号:湘ICP备2025141790号-2