- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0908-2013 一次性使用注射用过滤器
标准号:
YY/T 0908-2013
标准名称:
一次性使用注射用过滤器
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
2.55 MB
点击下载
标准简介:
YY/T 0908-2013.Single-use filter for syringe.
若采用环氧乙烷灭菌,过滤器经灭菌后,按GB/T 14233. 1- -2008 进行试验时,其残留量应不大于10 ug/g.
7生物要求
7.1 总则
过滤器在新产品投产时、材料发生重大改变时,应按GB/T16886.1的规定对细胞毒性.刺激或皮内反应、致敏、急性全身毒性、热原反应和血液相容性进行生物学评价。
7.2无菌
过滤器应通过一灭菌确认的过程和常规控制使产品无菌。
注1:适宜的灭菌确认和常规控制见GB 18278 .GB 18279和GB 18280。
注2: GB/T 14233. 2中规定了无菌试验方法,该方法可用于型式试验而不适宜于出厂检验。
注3:若提供非灭菌状态的产晶,在包装上应明确标识“未经灭菌,不得直接用于临床".
7.3 细菌内毒素
过滤器按GB/T 14233. 2试验时,其含量应不超过20 EU/只(或件)。
8标志
8.1 初包装
初包装上至少应有下列信息:
a) 产品名称和符合第3章的规格标记;
b)制造商名称和地址;
c) 产品注册证号、执行标准号;
d)使用YY/T0466.1给出的图形符号,标明过滤器无菌;若提供非灭菌状态的产晶,在包装上应用红色明确标识“未经灭菌,不得直接用于临床。”
e)过滤器无热原;
f) 过滤器仅供一次性使用,或同等说明,或使用符合YY/T 0466. 1给出的图形符号;
g)使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;
h) 生产批号,以“批”字或“LOT"打头,或使用符合YY/T 0466. 1给出的图形符号;
i) 失效年月,附以适当文字,或使用符合YY/T 0466.1给出的图形符号; .
部分标准内容:
中华人民共和国医药行业标准
YY/T0908—2013
一次性使用注射用过滤器
Single-usefilterforsyringe
2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
本标准按照GB/T1.1一2009给出的规则起草YY/T0908—2013
请注意本标准的某些内容可能涉及专利。本标准的发布机构不承担识别这些专利的责任。本标准由国家食品药品监督管理总局提出。本标准由全国医用注射器(针)标准化技术委员会(SAC/TC95)归口。本标准主要起草单位:北京伏尔特技术有限公司、上海市医疗器械检测所。本标准参加起草人:晏绍军、陈俊、王剑锋、胡以文、李银华、花松鹤。1范围
一次性使用注射用过滤器
YY/T0908—2013
本标准规定了一次性使用注射用过滤器的分类与标记、材料、物理要求、化学要求、生物要求、标志、包装。
本标准适用于一次性使用注射用过滤器(以下简称过滤器),过滤器与注射器具配套使用,应用于临床治疗中肌肉注射、静脉注射药物,以及向液体瓶内添加药物等,用于过滤药液中的不溶性微粒。2规范性引用文件
下列文件对于本文件的引用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T1962.1注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求GB/T1962.2注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T6682分析实验室用水规格和试验方法一次性使用输液器重力输液式
GB8368
GB/T14233.1一2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法一次性使用无菌注射器
GB15810
GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验一次性使用麻醉用过滤器
YY/T0466.1E
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY0770.1
3分类与标记
3.1结构型式
医用输、注器具用过滤材料
第1部分:药液过滤材料
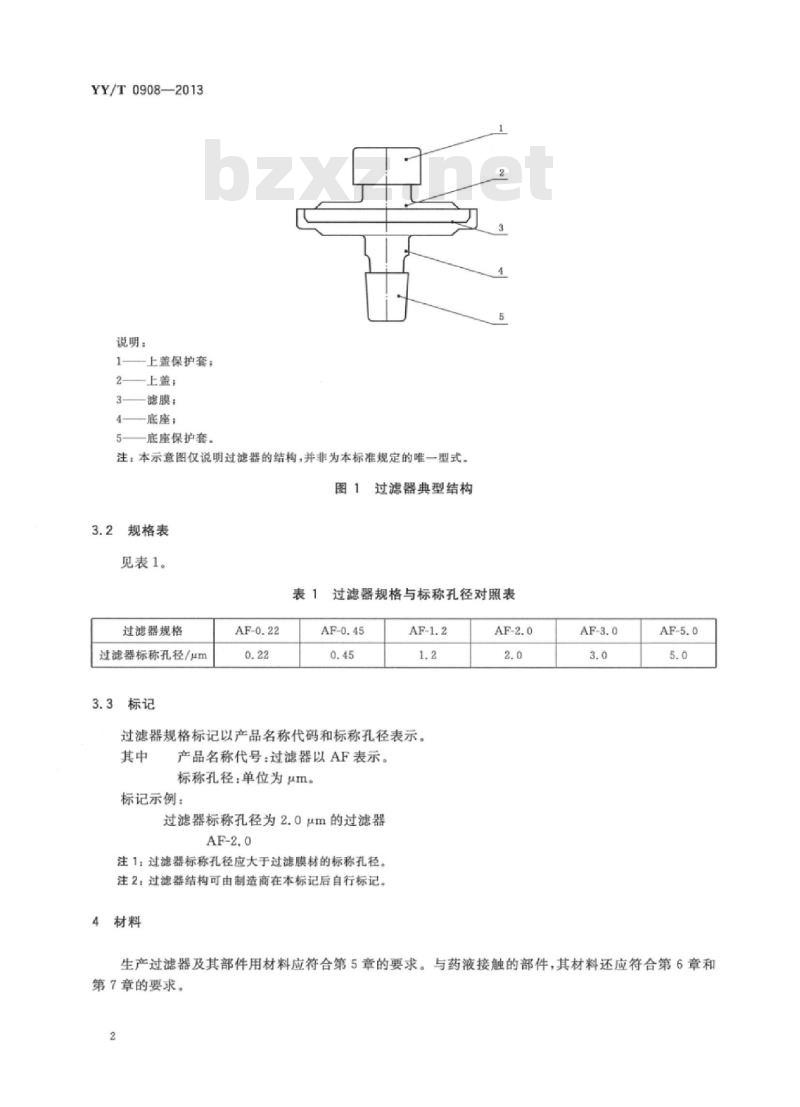
过滤器典型结构如图1所示。
YY/T0908—2013
说明:
—上盖保护套:
2—上盖:
一滤膜;
一底座;
底座保护套。
注:本示意图仅说明过滤器的结构,并非为本标准规定的唯一型式。图1
规格表
见表1。
过滤器典型结构
过滤器规格与标称孔径对照表
过滤器规格
过滤器标称孔径/μm
过滤器规格标记以产品名称代码和标称孔径表示其中
产品名称代号:过滤器以AF表示。标称孔径:单位为μm。
标记示例:
过滤器标称孔径为2.0μm的过滤器AF-2.0
注1:过滤器标称孔径应大于过滤膜材的标称孔径。注2:过滤器结构可由制造商在本标记后自行标记。材料
生产过滤器及其部件用材料应符合第5章的要求。与药液接触的部件,其材料还应符合第6章和第7章的要求。
5物理要求
5.1外观
YY/T0908—2013
以正常视力或矫正到正常视力观察,过滤器外表面应光洁、无毛刺、杂质、裂痕等缺陷。5.2接头
过滤器接头应符合GB/T1962.1和/或GB/T1962.2的规定。5.3完整性
过滤器完整性应符合如下要求:5.3.1
a)过滤器过滤介质标称孔径≥2.0μm,按第A.1章试验时,过滤器滤除率应不小于90%。b)过滤器过滤介质标称孔径<2.0μm,按第A.2章试验时,满足表2泡点压力值要求。表2过滤器标称孔径及泡点压力值过滤器标称孔径
泡点压力值
5.4密合性
过滤器按第A.3章试验时,应无液体泄漏现象。5.5微粒污染
按第A.4章试验时或其他等效方法测定过滤器微粒污染时,60mL洗脱液中,5.0m以上的微粒不得超过100个/mL。
5.6液体流量
过滤器在300kPa水压下,1min内通过过滤器流出的0.9%氯化钠注射液应不小于200mL。化学要求
6.1试验液制备
在同一批产品中随机抽取过滤器若干,按过滤器与药液接触的表面积(cm)与水的体积(mL)为2:1的比例加人符合GB/T6682中二级水要求的水,使其内表面完全浸湿,加盖,置于37C士1℃下浸泡1h。收集全部浸提液并冷却。同时制备空白对照液。6.2还原物质(易氧化物)
按GB/T14233.12008间接滴定法试验时,检验液和空白液消耗高锰酸钾溶液[c(KMnO.)=0.002mol/LJ的体积之差应不超过2.0mL。3
YY/T0908—2013
3金属离子
按GB/T14233.1—2008中5.6.1试验时,检验液呈现的颜色应不超过质量浓度p(Pbz+)=1μg/mL的标准对照液。
按GB/T14233.1一2008原子吸收分光光度法试验时,镉的含量应不超过0.1g/mL6.4酸碱度
按GB/T14233.1—2008酸度计法进行试验,检验液与空白液pH之差应不超过1.06.5环氧乙烷残留量
若采用环氧乙烷灭菌,过滤器经灭菌后,按GB/T14233.1一2008进行试验时,其残留量应不大于10μg/g。
7生物要求
7.1总则
过滤器在新产品投产时、材料发生重大改变时,应按GB/T16886.1的规定对细胞毒性、刺激或皮内反应,致敏,急性全身毒性,热原反应和血液相容性进行生物学评价。7.2无菌
过滤器应通过一灭菌确认的过程和常规控制使产品无菌。注1:适宜的灭菌确认和常规控制见GB18278.GB18279和GB18280。注2:GB/T14233.2中规定了无菌试验方法,该方法可用于型式试验而不适宜于出厂检验。注3:若提供非灭菌状态的产品,在包装上应明确标识“未经灭菌,不得直接用于临床”7.3细菌内毒素
过滤器按GB/T14233.2试验时,其含量应不超过20EU/只(或件)。8标志
8.1初包装
初包装上至少应有下列信息:
a)产品名称和符合第3章的规格标记;b)
制造商名称和地址:
c)产品注册证号、执行标准号:d)
使用YY/T0466.1给出的图形符号,标明过滤器无菌;若提供非灭菌状态的产品,在包装上应用红色明确标识“未经灭菌,不得直接用于临床。”过滤器无热原;
过滤器仅供一次性使用,或同等说明,或使用符合YY/T0466.1给出的图形符号;使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;生产批号,以“批”字或“LOT”打头,或使用符合YY/TO466.1给出的图形符号:失效年月,附以适当文字,或使用符合YY/T0466.1给出的图形符号;i)标注过滤器标称孔径。
外包装
外包装上至少应有下列信息:
产品名称和符合第3章的规格标记;制造商名称和地址;
YY/T0908—2013
使用YY/T0466.1给出的图形符号,标明过滤器无菌著提供非灭菌状态的产品,在包装上应用红色明确标识“未经灭菌,不得直接用于临床”。批号,以“批”字或“LOT”打头,或使用符合YY/T0466.1给出的图形符号;d)
9包装
失效年月,附以适当文字,或使用符合YY/T0466.1给出的图形符号;推荐的贮存条件(如果有)。
9.1每一支过滤器应封装在初包装内采用环氧乙烷灭菌时,过滤器初包装应采用一面透析纸另一面塑材或全透析纸的包装材料,本标准鼓励采用透析效果更好的包装材料。包装的材料不得对内装物产生有害影响。此包装的材料和设计应确保:
在干燥、清洁和充分通风的贮存条件下,能保证内装物无菌;a)
b)在从包装中取出时,内装物受污染的风险最小:在正常的搬动、运输和贮存期间,对内装物有充分的保护;一旦打开,包装不能轻易地重新密封,而且应有明显的被撕开的痕迹dWww.bzxZ.net
一件或更多件初包装,应装人一件中包装中。9.2
在正常搬运、运输和贮存期间,中包装应能充分有效地保护内装物。9.3若提供非灭菌状态的产品,由制造商自行确定。5
YY/T0908—2013
A.1过滤器滤除率试验(粒子计数器法)A.1.1试验仪器
附录A
(规范性附录)
物理试验
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A.1.2试验液
按表A.1的要求选择胶乳粒子悬浮液作为试验液。表A.1
试验悬浮液中胶乳粒子的技术要求过滤器标称孔径
A.1.3冲洗液
粒子峰值粒径
粒径的变异系数
粒径计数范围
粒径计数范围内的
粒子数量
个/mL
1500~3000
1000~2000
蒸馏水或质量浓度为9g/L的氯化钠注射液,经孔径为0.2μm的微孔滤膜过滤。A.1.4步骤
A.1.4.1取100mL试验液(A.1.2),注人洁净的计数器的样品池中,按表A.1中粒径计数范围对样品池内试验液中的胶乳粒子计数(N。),总取样量不少于15mL。注:测得的N。值须满足表A.1规定。A.1.4.2取100mL试验液(A.1.2),采用注射器将其注人过滤器,滤过液流入洁净的计数器的样品池中,按表A.1中粒径计数范围对样品池内滤过液中的胶乳粒子计数(N),总取样量不少于15mL。A.1.5结果表示
式(A。1)给出过滤器的滤除率,以百分数表示:C=
式中:
滤除率,%:
)×100%
N。—一试验液中测得的粒子数,单位为个每毫升(个/mL);N.
一滤出液中测得的粒子数,单位为个每毫升(个/mL)。6
过滤器泡点试验
A.2.1试验仪器:泡点压力测试仪:压力表精度为:0.25级(如图A.1)。A.2.2试剂:纯化水。
A.2.3环境、试剂温度:20℃~25℃。A.2.4步骤
YY/T09082013
将经预处理过的过滤器试样置于测试池底座上,旋紧测试池上盖,在测试池上盖中加人试验用试剂,用氮气升压测试,至测试池中出现第一个气泡并连续出泡时立即停止升压,读取此时的压力值,即为泡点压力。
说明:
闵门:
储气罐;
调压阀;
管路:
测试池底座;
过滤材料;
测试池上盖:
压力表。
泡点压力测试仪示意图
A.3密合性试验
将蒸馏水从过滤器进液端注人,另一端封闭,施加300kPa压力观察15s,不得有液体渗漏现象。7
YY/T0908—2013
微粒污染试验
这一方法是通过冲洗过滤器内腔,收集过滤器洗脱液中的粒子,并对其计数来评价污染。A.4.2
试验仪器
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A.4.3冲洗液
水或质量浓度为9g/L的氯化钠注射液,经孔径为0.2μm的微孔滤膜过滤A.4.4预处理
将供试过滤器充满符合A.4.3的液体,常温下浸泡2h。A.4.5步骤
取60mL冲洗液,采用注射器将其注入预处理后的过滤器,流入洁净的计数器的样品池中,即得洗脱液。对样品池内洗脱液中≥5μm的粒子计数,总取样量不少于15mL。A.4.6
结果表示
以洗脱液中微粒含量(个/mL)报告结果。8
B.1检验项目
附录B
(规范性附录)
型式检验规则
检验项目为本标准第5章~第7章的各项要求。B.2
抽样数量
若无特殊规定,每项性能各随机抽检5只。判定规则
YY/T0908—2013
所有检验项目均合格,则通过型式检验。检验中若第6章、第7章中的要求全部合格,第5章中的要求出现不合格项时,允许再次加倍抽样,对不合格项进行复验,复验仍不合格,则型式检验不通过9
YY/T0908-2013
打印日期:2014年1月16日F007
中华人民共和国医药
行业标准
一次性使用注射用过滤器
YY/T 0908—2013
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100013)北京市西城区三里河北街16号(100045)网址spc.net.cn
总编室:(010)64275323发行中心:(010)51780235读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张1字数20千字
2013年12月第一版
2013年12月第一次印刷
书号:155066·2-26335
如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68510107
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY1122-2005 咬骨钳(剪)通用技术条件
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY0345-2002 骨接合植入物金属骨针
- YY/T0452-2003 止血钳
- YY0320-2000 麻醉机
- YY0003-1990 病床
- 行业新闻
网站备案号:湘ICP备2025141790号-2