- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0918-2014 药液过滤膜、药液过滤器细菌截留试验方法
标准号:
YY/T 0918-2014
标准名称:
药液过滤膜、药液过滤器细菌截留试验方法
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
964.07 KB
点击下载
标准简介:
YY/T 0918-2014.Test method for determining bacterial retention of membrane/filter assembly utilized for infusion liquid filtration.
1范围
YY/T 0918规定的试验方法适用于对标称孔径不超过0.22μm的医疗器械用除菌级药液过滤膜或药液过滤器的细菌截留能力进行评价。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T6682分析实验室用水规格和试验方法
YY/T0929.1输液用除菌过滤器第1部分:药液过滤器完整性试验
3术语和定义
下列术语和定义适用于本文件。
3.1
log降低值lcg reductioa value;LRV挑战微生物的數量与滤出液微生物数量比值的以10为底的对数值。
4试验方法概达
用一定体积和浓度的缺陷假单胞菌(ATCC19146)菌悬液,以膜两侧不高于200kPa的压差和每平方厘米有效过滤面积(EFA)2 mL/min~4 mL/min的流量,对灭菌后的供试过滤膜或过滤器进行挑战,使最终挑战水平不低于10' CFU/cm2 EFA.全部的滤出液再经过分析滤膜过滤后,将分析滤膜置于固体培养基上培养。能透过供试过滤膜或过滤器的细菌将会在分析滤膜上形成可见的菌落,并可进行计数。
注:当需要考核过滤膜或过滤器长期使用是否能保持其细茵截留能力时,可采用附录A给出的试验方案。
5意义和用途
5.1本试验方法设计成在临床使用条件下评价除菌级过滤膜或过滤器的细菌截留能力。
5.2每平方厘米有效过滤面积经受10*个细菌的挑战水平远远高于一般除菌过滤过程。选用该挑战水平是为使过滤膜或过滤器能截留大量微生物提供高度的安全保证。
部分标准内容:
中华人民共和国医药行业标准
YY/T 0918—2014
药液过滤膜、药液过滤器
细菌截留试验方法
Test method for determining bacterial retention of membrane/filter assembly utilized for infusion liguid filtration2014-06-17发布
国家食品药品监督管理总局
2015-07-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准参考ASTMF838-05《液体过滤用膜过滤器细菌截留试验方法》制定YY/T0918—2014
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由全国医用输液器具标准化技术委员会归口。本标准主要起草单位:山东省医疗器械产品质量检验中心。本标准参加单位:Pall过滤器(北京)有限公司、杭州科诺过滤器材有限公司。本标准起草人:吴平、王文庆、唐燕、张步增、林卫健。H
YY/T0918—2014
尽管当前的大输液和输液器具都经过最终灭菌,但在某些条件相对较差的医疗环境中,配药和连接输液器材的过程仍有将环境中的微生物引人到输液系统的可能。有些输注液(如某些营养液)本身也有助于微生物生长。因此,除菌级药液过滤器有相当的市场需求。本标准给出的方法可用于测定除菌级药液过滤膜、过滤器截留药液中细菌的能力。目前公认的能滤除药液中细菌的滤膜的最大孔径是0.22μm。通常,只有通过本试验的药液过滤膜才可将滤膜孔径标称为0.22μm。细菌截留试验的局限性在于其不能在药液过滤膜、过滤器生产过程中进行常规控制。常规控制中一般采用泡点压试验检验过滤膜的孔径和过滤器的完整性(见YY/T0929.1),泡点压指标需经过本标准给出的方法进行确认。
某些无菌加工医疗器械生产过程确认中对除菌过滤器除菌能力的评价也可以采用本标准给出的方法。
1范围
药液过滤膜、药液过滤器下载标准就来标准下载网
细菌截留试验方法
YY/T0918—2014
本标准规定的试验方法适用于对标称孔径不超过0.22μm的医疗器械用除菌级药液过滤膜或药液过滤器的细菌截留能力进行评价。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件。仅注日期的版本适用于本文件。凡是不注日期的用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法YY/TC929.1输液用除菌过滤器第1部分:药液过滤器完整性试验3术语和定义
下列术语和定义适用于本文件。3.1
log降低值lcgreductionvalue;LRV挑战微生物的数量与滤出液微生物数量比值的以10为底的对数值。4试验方法概述
用一定体积和浓度的缺陷假单胞菌(ATCC19146)菌悬液,以膜两侧不高于200kPa的压差和每平方厘米有效过滤面积(EFA)2mL/min~4mL/min的流量,对灭菌后的供试过滤膜或过滤器进行挑战,使最终挑战水平不低于10°CFU/cmEFA。全部的滤出液再经过分析滤膜过滤后,将分析滤膜置于固体培养基上培养。能透过供试过滤膜或过滤器的细菌将会在分析滤膜上形成可见的菌落,并可进行计数。
注:当需要考核过滤膜或过滤器长期使用是否能保持其细菌截留能力时,可采用附录A给出的试验方案5意义和用途
5.1本试验方法设计成在临床使用条件下评价除菌级过滤膜或过滤器的细菌截留能力。5.2每平方厘米有效过滤面积经受10°个细菌的挑战水平远远高于一般除菌过滤过程。选用该挑战水平是为使过滤膜或过滤器能截留大量微生物提供高度的安全保证。6仪器
6.1不锈钢压力容器。
6.2空气调节器。
YY/T0918—2014
6.347mm过滤装置,以软管相连。6.4隔膜保护压力表,适宜量程。6.5阀门,耐高压蒸汽,以软管相连。6.6管路,耐高压蒸汽,能承受350kPa的压力。6.7液体流量计。
6.8软管夹。
6.9生化培养箱,30℃士2℃。
6.10生物安全柜。
6.11超净工作台。
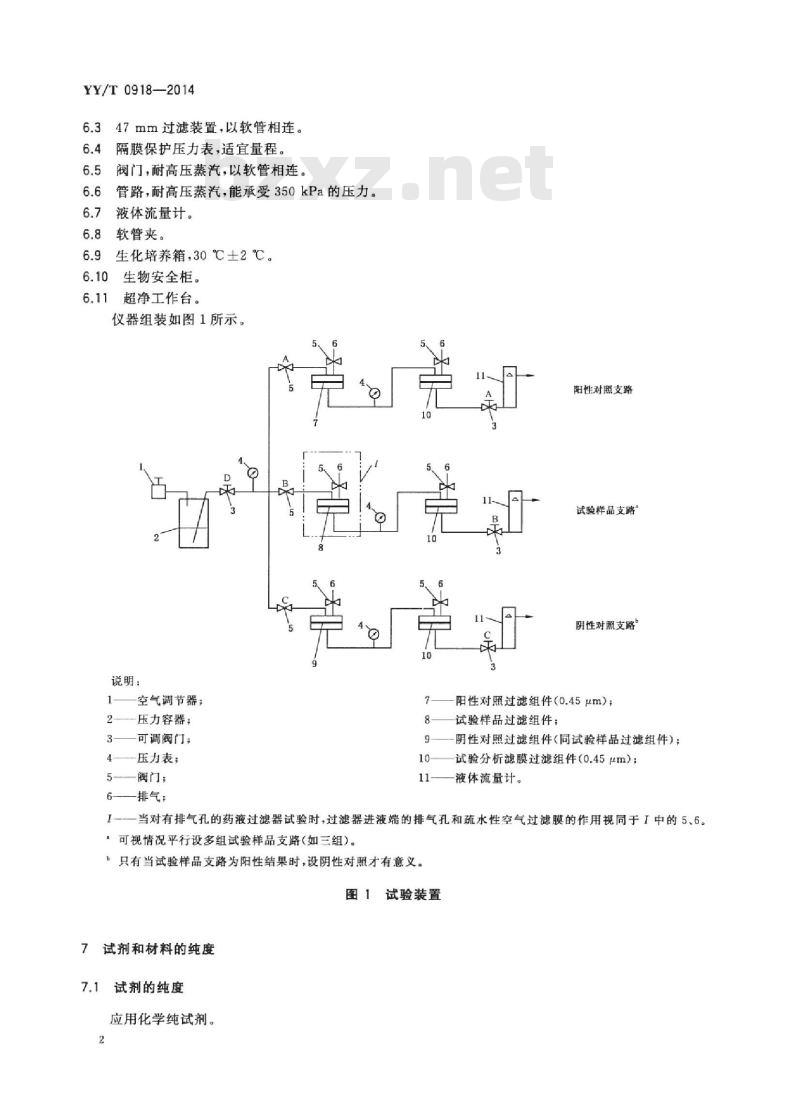
仪器组装如图1所示。
说明:
空气调节器:
-压力容器;
可调阀门:
-压力表
一阀门:
-排气:
阳性对照支路
试验样品支路”
阴性对照支路”
阳性对照过滤组件(0.45μm);试验样品过滤组件;
阴性对照过滤组件(同试验样品过滤组件);试验分析滤膜过滤组件(0.45μm);液体流量计。
I当对有排气孔的药液过滤器试验时,过滤器进液端的排气孔和疏水性空气过滤膜的作用视同于I中的5、6。:可视情况平行设多组试验样品支路(如三组)。只有当试验样品支路为阳性结果时,设阴性对照才有意义。图1试验装置
试剂和材料的纯度
7.1试剂的纯度
应用化学纯试剂。
7.2水的纯度
YY/T0918—2014
除非另有说明,试验用水都应符合GB/T6682中规定的二级水。本试验方法中的任何用水都应是非抑菌水。
8试剂和材料
8.1盐水乳糖肉汤培养基
8.1.1乳糖肉汤将1.3g脱水乳糖肉汤培养基溶人100mL水中。8.1.2氯化钠溶液将7.6g氯化钠溶人盛有970mL水的2L具塞烧瓶中。8.1.3将30mL乳糖肉汤(8.1.1)加人到970mL氯化钠溶液,121℃灭菌15min。8.2制备冷冻菌糊所用试剂
生长培养基A(pH6.8~7.0)
以下成分溶人水中并稀释到1L。121℃灭菌15min。胰蛋白陈(或酪陈)
酵母浸出物
氯化钠(NaCI)
硫酸镁(MgSO4·3Hz0)
8.2.2保存用缓冲液
将0.790g的磷酸二氢钾(KHaPO.)和1.0g的磷酸氢二钾(K.HPO)溶人100mL丙三醇。用氢氧化钾溶液[c(KOH)=0.1mcl/L]调pH到7.2,用水稀释到1L,121℃灭菌15min。8.2.3氢氧化钾[e(KOH)=0.1mol/L将5.61g的氢氧化钾(KOH)溶人水中,并在容量瓶中定容至1L。8.2.4胰蛋白大豆琼脂
按制造商说明制备。
8.2.5胰蛋白大豆肉汤
按制造商说明制备。
8.3分析试剂和材料
8.3.1M平板计数琼脂
按制造商说明制备。
8.3.2蛋白陈水(1g/L)
将蛋白陈溶人水中,以合适体积分装于螺口瓶中,以便于制备10倍稀释液,121℃灭菌15min。3
YY/T0918—2014
8.4缺陷假单胞菌
缺陷假单胞菌(ATCC19146)。
8.5分析滤膜
直径47mm,孔径0.45μm。
9细菌挑战原液制备方法
9.1总则
以下两种方法已被广泛用于缺陷假单胞菌悬液的制备。这些方法并不排斥其他等同有效的方法。然而,重要的是所应用的所有缺陷假单胞菌挑战悬液都是单分散的,同时应符合第10章的规定。9.2菌种分离和保藏
根据缺陷假单胞菌的说明进行培养,通过划线平板来检查纯度。检查菌落形态是否一致,按第10章鉴定缺陷假单胞菌单菌落。
9.2.1储用培养物
用9.2分离得到的单菌落来制备储用培养物。接种胰蛋白大豆琼脂斜面,在30℃士2℃条件下培养24h。用无菌液状石腊覆盖斜面,4℃保存。每周检查一次活力和纯度。也可选用胰蛋白大豆半固体琼脂穿刺培养来替代斜面培养。9.2.2培养物的长期保藏
冻干或液氮保存。
9.3在盐水乳糖肉汤中制备挑战原液9.3.1向10mL无菌胰蛋白大豆肉汤接种储用培养物(9.2.1),30℃土2℃培养24h9.3.2将2mL混匀的肉汤培养液移人1L无菌盐水乳糖肉汤中,涡旋混合,30℃士2℃培养24h。注:盐水乳糖肉汤菌悬液临用前可以在4℃保存,但不超过8h。9.3.3按第11章测定挑战菌悬液中活菌的浓度(一般浓度为10°CFU/mL~10°CFU/mL)。9.3.4按第10章鉴定缺陷假单胞菌。9.4制备缺陷假单胞菌冷冻菌糊
9.4.1向10mL无菌生长培养基A(8.2.1)接种储用培养物(9.2.1),30℃士2℃培养24h。9.4.2将10mL由9.4.1得到的细菌悬液移人500mL无菌生长培养基A中,30℃土2℃培养24h。9.4.3将200mL由9.4.2得到的细菌悬液移人10L无菌生长培养基A,制备10L种子培养液,30℃士2℃培养24h。
9.4.4将上述10L种子培养液接种到500L生长培养基A中。在30℃土2℃有氧培养。通过500nm下分光光度分析对生长进行监视,绘制生长曲线。9.4.5当培养达到静止生长期时,通过连续离心收集菌体。9.4.6用2~3倍体积的冷的无菌保存用缓冲液重悬菌体。9.4.7离心菌体悬液,再用等体积的保存用缓冲液重悬菌体。测定菌体浓度(活菌浓度一般为1×1012CFU/mL)。
YY/T0918—2014
9.4.8将全部菌糊(如50mL)移人无菌塑料离心试管,用干冰丙酮或液氮冷冻,在一60℃条件下保存。9.5用冷冻菌糊制备挑战原液
9.5.1用无菌钳夹持试管,将其浸渍于80%(体积分数)酒精中进行消毒,点燃酒精至多数酒精被烧光。9.5.2无菌取下试管帽,常温条件下,将试管投人盛有无菌磁力搅拌棒和20倍于菌糊体积的含0.001mo1/L~0.002mol/L氯化镁(MgCl2)的无菌生理盐水的锥形瓶中(例如,将50mL冷冻菌糊移1L无菌溶液中)。
注:加人冷冻菌糊前需先将氯化镁(MgClz)溶解于溶剂中。9.5.3将烧瓶放置于磁力搅拌器上,混合直到试管内容物悬浮均勾(40min)。9.5.4按第11章测定活菌浓度(菌悬液浓度一般为1×101°CFU/mL~2×10CFU/mL)。9.5.5按第10章鉴定缺陷假单胞菌。10缺陷假单胞菌的鉴定
10.1菌落形态
缺陷假单胞菌的菌落呈米黄色,轻微突起,完整透明。10.1.1
2在30℃(最佳生长温度)培养24h后,生长至针尖般大小,培养36h~48h后直径为1mm~10.1.2
2mm。
10.2显微观察
10.2.1进行革兰氏染色
10.2.1.1用装有经校准的目镜千分尺和良好分辨率油镜镜头的复合光学显微镜来检查所制备的菌株。观察几个视场中微生物的大小和分布情况。10.2.1.2染色所制备的菌株,应为革兰氏阴性、尺寸为(0.3μm~0.4μm)×(0.6μm~1.0μm)的短小杆状菌,主要以单细胞形式存在。10.2.2进行鞭毛染色(可选)。缺陷假单胞菌具有极生单鞭毛的特征。10.3生化特性
进行如下生化特性试验,缺陷假单胞菌具有以下生化特性:试验
芽胞形成
葡萄糖氧化发酵培养基,开口
葡萄糖氧化发酵培养基,封口
3%乙醇氧化发酵培养基,开口
3%乙醇氧化发酵培养基,封口
靛基质
甲基红
3-羟基-2-丁酮
明胶酶
需氧菌
过氧化氢酶
缺陷假单胞菌
(ATCC19146)
YY/T0918—2014
细胞色素(靛酚)氧化酶
在麦康凯琼脂上生长
DNA酶(BBLDNA酶测试琼脂或类似物)氨戊酰胺耐受
11细菌挑战悬液的制备
缺陷假单胞菌
(ATCC19146)
11.1用直接显微镜计数测定菌悬液的浓度。这样可以测定出总细菌数量,包括活菌和非活菌。11.2应用合适体积的挑战原液,在盐水乳糖肉汤或无菌生理盐水中制备合适体积和浓度的缺陷假单胞菌挑战悬液,使每平方厘米测试滤膜至少经受10°个微生物的挑战,充分混合。11.3在无菌条件下从所制备的缺陷假单胞菌挑战悬液中取样。11.4在无菌条件下用0.1%蛋白陈水稀释菌悬液到10-稀释度。11.5采用薄膜过滤法或直接平板涂布法进行两个平行活菌分析。11.5.1对于薄膜过滤法,分别1mL10-*~10-6稀释度的稀释液进行过滤。在加人1.0mL十倍稀释液之前,先在过滤夹持器的漏斗宁加人50mL无菌生理盐水,过滤后再用50mL无菌生理盐水冲洗渴斗壁,从漏斗上联下分析滤,置于琼脂培养基上。11.5.2对于直接平板涂布法,分别用0.1mL10-3,10-4,10-5稀释度的稀释液直接涂板。11.e在30℃土2℃条件下培养薛膜过滤平板或直接涂布平板48h。11.7取3CCFU~33CCFU的直接涂布平板或20CFU~200CFU的薄膜过滤平板进行菌落计数.计算初始菌悬液浓度(CFU/mL)。11.8将活菌浓度与11.1中直接显微镜计数结果进行比较。活菌数应不小于总菌数的25%。2样品和仪器准备
12.1对滤膜材料进行试验时,将其裁切成$47mm的圆形试验样品,装人过滤装置。对于已经过灭菌的药液过滤器进行试验时,直接取成品试验,试验前无需进行灭菌。12.2将试验样品过滤组件(对于滤膜材料)、阴性对照过滤组件和阳性对照过滤组件分别用灭菌纸包裹进口和出口接头,按制造商说明书进行灭菌。灭菌程序宜采用生物指示物或热电偶进行确认。如需要,按YY/T0929.1在无菌条件下对试验样品过滤组件进行完整性测试。12.3将试验分析滤膜过滤组件进口和出口处各连接一段可蒸汽灭菌的管路,用灭菌纸包裹软管末端,按制造商说明书进行灭菌。灭菌程序宜采用生物指示物或热电偶进行确认。12.4用灭菌纸包裹试验样品过滤组件、阴性对照过滤组件和阳性对照过滤组件下游的其他管路和连接件,按制造商说明书进行灭菌。灭菌程序宜采用生物指示物或热电偶进行确认。12.5在无菌条件下按图1对实验仪器进行组装。12.6压力容器和上游连接管路不需要蒸汽灭菌,但是宜在试验前彻底清洗,消毒,并用无菌水冲洗。压力容器可用5%次氯酸钠溶液或70%乙醇消毒,晾干,并用水彻底清洗。6
13试验步骤
13.1阴性对照
YY/T0918—2014
13.1.1图
阴性对照在细菌挑战试验前进行,并且对照分析滤膜与试验分析滤膜和阳性对照分析滤膜同时培养。
13.1.2在压力容器中加人至少500mL盐水乳糖肉汤或无菌生理盐水。13.1.3关闭阀门A和B和可调阀门A、B、C和D.打开阀门C。13.1.4对压力容器加压到200kPa。13.1.5缓慢打开可调阀门D,让液体充满阴性对照过滤组件和其下游的分析过滤组件。将各过滤装置中空气排人合适消毒剂中。当各过滤组件中充满液体时,关闭其排气阀。13.1.6打开可调阀门D,并用可调阀门C调节流量为每平方厘米阴性对照过滤膜有效过滤面积2 mL/min~4 mL/min。
13.1.7当全部液体过滤完成后,关闭阀门C和可调阀门C。13.1.8关闭空气调节器并释放容器内压力。13.1.9取下该分析过滤组件,从下游抽真空15s,除去所有液体,在无菌条件下将膜从过滤组件转移至M平板计数琼脂上,30℃士2℃培养,在第72小时和第7天记录菌落数。13.2细菌挑战试验和阳性对照试验13.2.1在压力容器中加人第11章制备的所需体积(每支路至少500mL)的菌悬液。13.2.2关闭阀门C和可调阀门A、B、C和D,打开阀门A和B。13.2.3对压力容器加压到200kPa。13.2.4缓慢打开可调阀门D,让挑战菌悬液充满试验样品过滤组件、阳性对照过滤组件和它们下游的分析过滤组件。将各过滤组件中空气排人合适消毒剂中。当各过滤组件中充满液体时,关闭其排气阀。13.2.5打开可调阀门A和B。
13.2.6打开可调阀门D,并用可调阀门A和B调节流量为每平方厘米供试过滤膜和阳性对照过滤膜有效过滤面积2mL/min~4mL/min。13.2.7当全部液体过滤完成以后,关闭阀门A、B和可调阀门A、B。13.2.8关闭空气调节器并释放容器内压力。13.2.9取下各支路分析过滤组件,从下游抽真空15s,除去所有液体,在无菌条件下将各膜从过滤组件转移至M平板计数琼脂上,30℃土2℃培养,在第72小时和第7天记录菌落数。13.2.10鉴定各菌落是缺陷假单胞菌还是污染菌(第10部分)。13.3完整性试验
在挑战试验结束之后,如需要,按YY/T0929.1对试验样品过滤组件进行完整性测试。14
结果表述
过滤器的识别
报告供试过滤膜/过滤器制造商名称、标称孔径、有效过滤面积和其他相关数据。7
YY/T0918—2014
14.2操作条件
报告压力,压差,温度,流量和其他相关参数。挑战菌数
报告第11.7步骤中所测定的细菌浓度,计算和报告挑战悬液中总菌数。14.4
滤出液中细菌数
14.4.1对照
报告阳性和阴性对照分析滤膜所观察到的菌落数。14.4.2试验样品
报告试验样品分析滤膜所观察到的菌落数。报告每一菌落是缺陷假单胞菌还是污染菌。5滤器完整性
若适用,报告算12.1和13.3的完整性测试中的参数和结果,说明滤器是否能通过完整性试验,并解释判断的依据。
过滤性能
计算并报告1og降低值。
结果评价
性对照分析滤膜上出现菌落或试验分析滤膜上出现非试验微生物时试验无效。试验样品分所滤膜未出现菌落且阳性对照为阳性时,判为满足除菌要求。A.1试验布置
试验布置如图A.1所示。
说明:
细菌挑战悬液容器;
2——前置、后置蠕动泵;
循环液容器;
4——上游、下游压力表;
一阀门;
附录A
(资料性附录)
药液过滤膜/过滤器细菌截留循环试验方案去
排气;
YY/T0918—2014
阳性对照支路
试验样品支路
明性对照支路
-阳性对照过滤组件(o.45μm);试验样品过滤组件:
阴性对照过滤组件(同试验样品过滤组件);试验分析滤膜过滤组件(0.45m)。当对有排气孔的药液过滤器试验时,过滤器进液端的排气孔和疏水性空气过滤膜的作用视同于「中的5.6。“可视情况平行设多组试验样品支路(如三组)。6只有当试验样品支路为阳性结果时,设阴性对照才有意义。图A.1药液过滤膜/过滤器细菌截留循环试验方案A.2试验条件
A.2.1挑战水平
挑战水平不低于107CFU/cm2EFA。9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY/T0452-2003 止血钳
- YY0476-2004 眼内冲洗灌注液
- YY0781-2010 血压传感器
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T0182-2013 宫内节育器取出钩
- YY/T1268-2015 环氧乙烷灭菌的产品追加和过程等效
- 行业新闻
网站备案号:湘ICP备2025141790号-2