- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 7628-2008 谷物中维生素B1测定
标准号:
GB/T 7628-2008
标准名称:
谷物中维生素B1测定
标准类别:
国家标准(GB)
标准状态:
现行-
发布日期:
2008-05-27 -
实施日期:
2008-10-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
2.54 MB
标准ICS号:
ICS 食品技术>>67.060谷物、豆类及其制品中标分类号:
食品>>食品综合>>X04基础标准与通用方法
替代情况:
替代GB/T 7628-1987
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了用荧光分光光度计测定谷物中维生素B1的原理、试剂和材料、仪器设备、试样制备、分析步骤、结果计算及重复性。本标准适用于谷物中维生素B1的测定。 本标准参考了AACC Method86-80《Thiamine—ThiochromeMethod》(2000年英文版)。本标准是对GB/T7628—1987《谷物维生素B1 测定方法》的修订。本标准与GB/T7628—1987的主要差异如下:———规定了实验用水应符合GB/T6682中三级水的规格;———规定了扦样、分样方法;———盐酸水解改为硫酸水解;———增加了硅酸盐离子交换树脂的使用;———将正丁醇溶剂改为异丁醇溶剂;———提取液色泽浅、无干扰物质时,不需进行提纯步骤;———取消以干基计算测定结果的要求;———增加了未通过提纯的试样中维生素B1 含量的计算公式;———增加了谷物中维生素B1 低含量时的测定重复性的要求。 GB/T 7628-2008 谷物中维生素B1测定 GB/T7628-2008
部分标准内容:
ICS67.060
中华人民共和国国家标准
GB/T7628-—2008
代替GB/T7628—1987
谷物中维生素B,测定
Determination of vitamin B, in cereals2008-05-27发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2008-10-01实施
GB/T7628—2008
本标准参考了AACCMethod86-80《Thiamine—ThiochromeMethod》(2000年英文版)。本标准是对GB/T7628—1987《谷物维生素B,测定方法》的修订。本标准与GB/T7628—1987的主要差异如下:规定了实验用水应符合GB/T6682中三级水的规格;规定了扦样、分样方法;
盐酸水解改为硫酸水解;
增加了硅酸盐离子交换树脂的使用;将正丁醇溶剂改为异丁醇溶剂:提取液色泽浅,无干扰物质时,不需进行提纯步骤;取消以干基计算测定结果的要求;增加了未通过提纯的试样中维生素B含量的计算公式;增加了谷物中维生素B:低含量时的测定重复性的要求。本标准由国家粮食局提出。
本标准由全国粮油标准化技术委员会归口。本标准起草单位:国家粮食局武汉粮油饲料质量监督检验中心。本标准主要起草人:杨林、刘小敏、屈利文、何一帆、钱防。本标准所代替标准的历次版本发布情况为:GB/T7628—1987。
1范围
谷物中维生素B测定
GB/T7628—2008
本标准规定了用荧光分光光度计测定谷物中维生素B的原理、试剂和材料、仪器设备、试样制备、分析步骤、结果计算及重复性。本标准适用于谷物中维生素B,的测定。本标准检出限为0.051g。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB5491粮食、油料检验扦样、分样法GB/T6682分析实验室用水规格和试验方法(GB/T6682—1992,negISO3696:1987)3原理
试样经稀硫酸、淀粉酶分解后,溶液中维生素B(硫胺素,C2HON,SCI)在碱性条件下被铁氰化钾氧化生成硫色素,即荧光色素。硫色素在异丁醇中的荧光强度与试样中维生素B的含量成正比,依此测定维生素B1含量。
4试剂和材料
除另有规定外,所用试剂均为分析纯,实验用水应符合GB/T6682中三级水的规格。4.1盐酸
4.2乙酸钠溶液c(CH;COONa)=2.5mol/L取205g无水乙酸钠或340g水合乙酸钠(CHCOONa·3H,O)溶于水中,稀释至1000mL。4.3乙酸溶液c(CH.COOH)=3%(体积分数)取30mL冰乙酸用水稀释至1000mL。4.4氯化钾溶液c(KCD)=0.25g/mL称取250g氯化钾溶解于水中,稀释至1000mL。4.5硝酸银溶液c(AgNO,)=0.01g/mL称取1g硝酸银溶解于水中,稀释至100mL。4.6淀粉酶悬浮液c=0.06g/mL
取6g淀粉酶制剂(takadiastase),其活性为1:250或相当活性的其他磷酸酯酶,用2.5mol/L乙酸钠溶液(4.2)制成悬浮液,稀释至100mL,当日制备当日使用4.7硅酸盐离子交换剂
4.7.1活性沸石
将沸石按规定筛层进行筛选,称取通过上层筛(孔径0.297mm,50目)、留存在下层筛(孔径Φ0.177mm,80日)上的沸石100g于布氏漏斗中,用3%的热乙酸(4.3,约50℃)溶液洗涤15min,应使乙酸与沸石保持接触10min~15min,用真空泵减压抽滤乙酸;再用0.25g/mL的热氯化钾溶液(4.4,约50℃)250mL进行洗涤;最后用热水(约50℃)洗涤,直至洗出液用硝酸银(4.5)检查时不出现1
GB/T76282008
氯离子。在室温或低于100℃烘箱中将沸石干燥后,在干燥器中冷却至室温,储存于磨口瓶中备用。4.7.2硅酸盐离子交换树脂,Bio-Rex70(H型)将硅酸盐离子交换树脂按规定筛层进行筛选,称取通过上层筛(孔径$0.297mm,50月)、留存在下层筛(孔径Φ0.149mm,100目)上的硅酸盐离子交换树脂50g,加人300mL盐酸(4.1),振摇10min~15min,将酸倒出,再加300mL水,振摇1min,将水倒出。重复数次,直至树脂的pH为4.5~7.0,抽滤或离心除去多余的水分,冷藏储存(4℃)。当时使用,可以不除去多余的水分。4.8氢氧化钠溶液c(NaOH)=0.15g/mL将15g氢氧化钠溶于水中,冷却,稀释至100mL4.9铁氰化钾溶液c[K,Fe(CN)。]=0.01g/mL将1g铁氰化钾溶于水中,稀释至100mL,赔存在具塞棕色瓶中,置于阴凉处保存。4.10碱性铁氰化钾
取0.01g/mL铁氰化钾溶液9)3mL,用0.15g/mL氢氧化钠溶液(8)稀释定容至100mL,现配现用。也可以按每3mL氧化钠溶液(4.8)加人1滴铁氰化钾溶液(4.9)混合配制。4.11异丁醇[(CH),CHCHOH
空白荧光值应低硫胺素标准工作溶液Ⅲ)(412.3)的荧光值的1%。否则,应将异丁醇在全玻璃仪器上蒸馏,或加粘性灵振摇除去荧光杂质4.12硫胺素溶液
4.12.1硫胺素标准储备溶液(I)e(CzHON.SCI)=100μg/mL将硫胺素盐酸放在装有五氧化二磷的干燥器中至少24h,然后精确称取100mg溶于25%乙醇储存于棕色瓶中冷藏(4℃),可保存数月(4.14)中,并用2560享稀释定容至1000m
4.12.2硫胺素标准落液()c(CzHONSCD=5μg/mL准确量取5m流胺素标准储备溶液(1(412.1)用25%乙醇(4.14)稀释,定容至100mL。4.12.3硫胺素标准工作溶液(m)(CH,ONSC)=0.2μg/mL准确量取4mL硫胺素标准溶液(Ⅱ)(412.2).用0.1mol/L硫酸(4.15)稀释定容至100mL,现配现用。
4.13硫酸童宁溶液口
4.13.1硫酸奎宁储液
精确称取100mg硫酸套宁,溶于0.1mol/L硫酸(415)电.用0.1mol/L硫酸稀释至1000mL,老容液混浊则不可使用。
储存于棕色瓶中冷藏保存
4.13.2硫酸奎宁工作液
准确量取3mL硫酸奎于磺备液(4.13.1),用0.1mol/L硫酸(4/15)稀释至1000mL,储存于棕色瓶中冷藏保存。
4.14乙醇溶液25%(体积分数)
将25mL无水乙醇加入到水中,稀释定容至100mL,摇今4.15硫酸溶液c(1/2H,SO.)=0.1mol/L将2.8mL浓硫酸加入到水中,稀释定容至1000mL。5
仪器设备
5.1荧光分光光度计。
5.2电热恒温水浴:100℃
5.3实验室用真空泵。
5.4电热恒温箱:37℃~40℃。
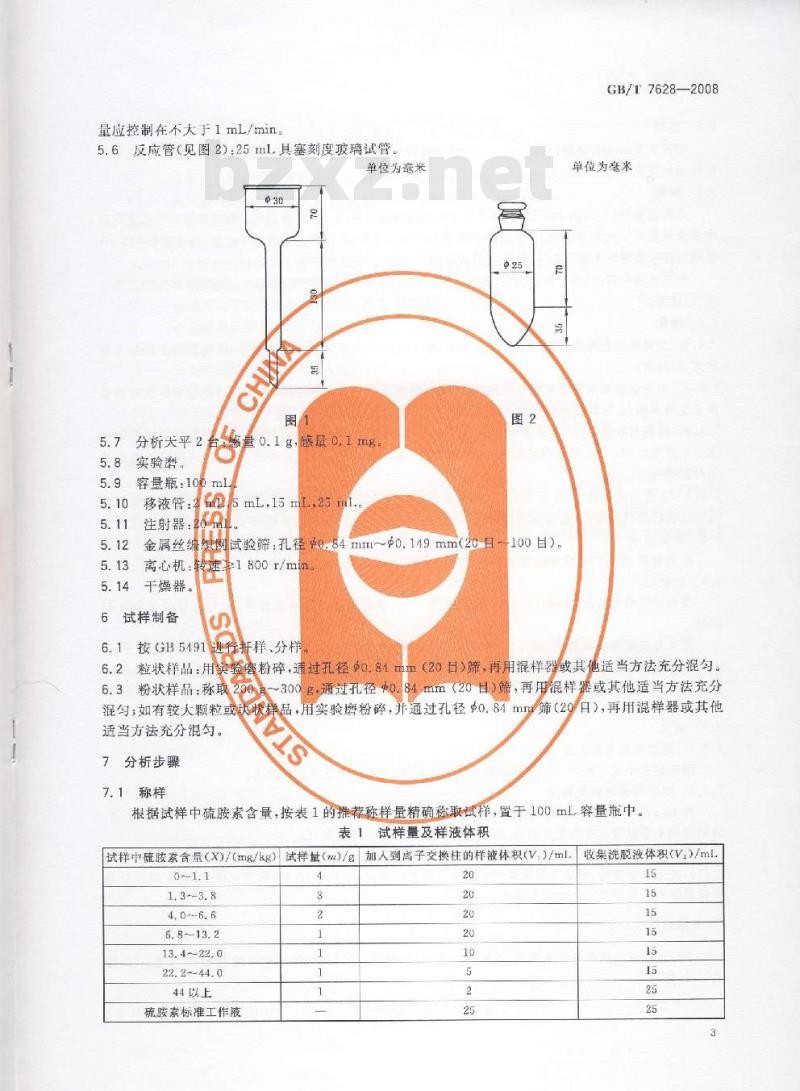
5.5吸附分离柱(见图1):容器全长约235mm:上端储液槽(外径×长度)30mm×70mm,容量为50mL;中部吸附管(外径X长度)8mmX130mm;下端为35mm的毛细管,其孔径在液体通过时的流2
量应控制在不大于1mL/min:
5.6反应管(见图2):25ml具塞刻度玻璃试管。单位为旁米
分析天平2
5.8实验磨。
台感量0.1g,感量0.1mg
5.9容量瓶:100ml
15mL15mL25mL
移液管:
注射器:
织网试验筛:孔径中o.84mmΦ0.149mm(20日-—100日)。金属丝编
1800/mm
离心机:
干燥器。
试样制备
GB/T7628-2008
单位为毫米
6.1按GB5491进行开样、分样
6.2粒状样品:用验磨粉碎,通过孔径$0.81mm(20日)筛,再用混样器或其他适当方法充分混匀。通过孔径+0.84mm(20自)筛,再用混样器或其他适当方法充分6.3粉状样品:称取200300
混匀;如有较大颗粒或美快养品,用实验磨粉碎,并通过孔径o.84mm筛(2°日),再用混样器或其他适当方法充分混匀。
7分析步骤
7.1称样
根据试样中硫胺素含量,按表1的推荐称样量精确称取试样,置于100mL容量瓶中。表1试样量及样液体积
试样中硫胺素含量(X)/((mg/kg)试样量(m))/g加人到离子交换柱的样液体积(V,)/ml收集洗脱液体积(V)/ml15
4. 0~6. 6
13.4-22.0
22.2~-44.0
44以上
硫胺素标准工作液
GB/T7628-2008
7.2提取
加人0.1mol/L硫酸(4.15)50mL到容量瓶(7.1)中,在100℃电热恒温水浴中加热10min,并不时摇动容量瓶,以防结块:
7.3酶解
冷却容量瓶(7.2)至40℃以下,加人5mL淀粉酶悬浮液(4.6),充分混匀,在37℃~40℃温度环境中至少放置4h,冷却至室温,用水稀释定容至100mL,摇勺,将试液通过滤纸于过滤,弃去最初的5mL滤液后再收集滤液于锥形瓶中,作为样品提取液。如提取液色泽浅、无干扰物质时,不需进行提纯步骤,按7.6进行氧化操作。测定结果按第8章的式(1)计算。
7.4净化
7.4.1当提取液色泽很深或含有干扰物质时,按7.4.2、7.4.3、7.4.4的步骤净化,测定结果按第8章的式(2)计算。
7.4.2取适量玻璃棉置于吸附分离柱吸附管底部,然后将0.5g活性沸石(4.7.1)或制备好的硅酸盐离子交换树脂(4.7.2)放入吸附管,在使用前用沸水充分洗涤吸附分离柱。7.4.3准确移取适量体积见表1(V)的样液,加人到已处理好的吸附分离柱中(吸附剂应保持被沸水完全浸泡),用5mL热水(约50℃)洗涤吸附分离柱,连续操作三次,弃去洗出液,以确保硫胺素在柱上分配完全。
7.4.4取适量煮沸的0.25g/mL氯化钾溶液(4.4),分三次连续加人吸附分离柱,用25mL具塞刻度玻璃试管收集洗脱液,收集的洗脱液体积[见表1(V)。冷却后用水稀释定容至25mL,充分混勾。7.5外标溶液
准确吸取25mL硫胺素标准工作液(Ⅲ)(4.12.3),重复7.1~7.3操作,作为外标溶液。7.6氧化
分别准确移取5mL样液(7.3)或洗脱液(7.4.3)于两只具塞离心试管中,编为1号试管和2号试管。
在1号具塞离心试管中,加人3mL碱性铁化钾溶液(4.10),在2号具塞离心试管中加人3mL0.15g/mL氢氧化钠溶液(4.8),振摇约30s:再分别准确加人15mL异丁醇(4.11),剧烈振摇1min。将1号、2号具塞离心试管置于离心机中以1800/min的速度离心1min后,用注射器吸去水层,在异丁醇层中加人1㎡L无水乙醇,混匀。7.7测定
7.7.1调整荧光分光光度计
用硫酸奎宁工作液(4.13.2)调整荧光分光光度计,使其处于正常工作状态。7.7.2测定样液的荧光强度
将10mL异丁醇层倒人比色杯中,于激发波长365nm,发射波长435nm处测定硫胺素的荧光值分别记录1号试管试液的荧光值R,和2号试管试液空白的荧光值R。同时分别准确吸取5mL外标溶液(7.5)置人另两只具塞离心试管中,编为3号和4号(作为标准空白),按7.6操作后,测定3号试管的硫胺素标准工作溶液(Ⅲ)(4.12.3)的荧光值R。和4号试管的硫胺素标准工作溶液空白的荧光值R%。8结果计算
未经过提纯的试样中维生素B含量(X)按式(1)计算,经过提纯的试样中维生素B含量(X,)按式(2)计算:bZxz.net
X, =(R.-Rt)×Vx
(R.-Rb)Xm
(1))
式中:
(R-R)×VXV,Xe
(R,-R)XV.XmXX。
未经过提纯的试样中维生素B含量,单位为毫克每千克(mg/kg)经过提纯的试样中维生素B含量,单位为毫克每千克(mg/kg);1号管试液的荧光值;
2号管试液空白的荧光值;
3号管硫胺素标准工作溶液的荧光值;4号管硫胺素标准工作溶液空白的荧光值;分取过离子交换柱样液的体积,单位为毫升(mL):收集洗脱液体积,单位为毫升(mL);试样质量,单位为克(g);
酶解提取液的体积,单位为毫升(mL);硫胺素标准工作溶液的浓度,单位为微克每毫升(ug/mL);X.
参与反应样品溶液体积与参与反应标准溶液体积的比值(通常5/5一1)。GB/T7628—2008
..(2)
每个试样进行平行试验,以算术平均值为测定结果。计算结果保留3位有效数字。9重复性
同一分析者对同试样在同样条件下同时进行两次测定:当维生素B,含量X<5.0mg/kg时,其获得的两次独立测定结果的相对偏差应≤15%,当维生素B含量X5.0mg/kg时,其获得的两次独立测定结果的相对偏差应10%:当维生素B含量X≥50.0mg/kg时,其获得的两次独立测定结果的相对偏差应≤5%。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T7628-—2008
代替GB/T7628—1987
谷物中维生素B,测定
Determination of vitamin B, in cereals2008-05-27发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2008-10-01实施
GB/T7628—2008
本标准参考了AACCMethod86-80《Thiamine—ThiochromeMethod》(2000年英文版)。本标准是对GB/T7628—1987《谷物维生素B,测定方法》的修订。本标准与GB/T7628—1987的主要差异如下:规定了实验用水应符合GB/T6682中三级水的规格;规定了扦样、分样方法;
盐酸水解改为硫酸水解;
增加了硅酸盐离子交换树脂的使用;将正丁醇溶剂改为异丁醇溶剂:提取液色泽浅,无干扰物质时,不需进行提纯步骤;取消以干基计算测定结果的要求;增加了未通过提纯的试样中维生素B含量的计算公式;增加了谷物中维生素B:低含量时的测定重复性的要求。本标准由国家粮食局提出。
本标准由全国粮油标准化技术委员会归口。本标准起草单位:国家粮食局武汉粮油饲料质量监督检验中心。本标准主要起草人:杨林、刘小敏、屈利文、何一帆、钱防。本标准所代替标准的历次版本发布情况为:GB/T7628—1987。
1范围
谷物中维生素B测定
GB/T7628—2008
本标准规定了用荧光分光光度计测定谷物中维生素B的原理、试剂和材料、仪器设备、试样制备、分析步骤、结果计算及重复性。本标准适用于谷物中维生素B,的测定。本标准检出限为0.051g。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB5491粮食、油料检验扦样、分样法GB/T6682分析实验室用水规格和试验方法(GB/T6682—1992,negISO3696:1987)3原理
试样经稀硫酸、淀粉酶分解后,溶液中维生素B(硫胺素,C2HON,SCI)在碱性条件下被铁氰化钾氧化生成硫色素,即荧光色素。硫色素在异丁醇中的荧光强度与试样中维生素B的含量成正比,依此测定维生素B1含量。
4试剂和材料
除另有规定外,所用试剂均为分析纯,实验用水应符合GB/T6682中三级水的规格。4.1盐酸
4.2乙酸钠溶液c(CH;COONa)=2.5mol/L取205g无水乙酸钠或340g水合乙酸钠(CHCOONa·3H,O)溶于水中,稀释至1000mL。4.3乙酸溶液c(CH.COOH)=3%(体积分数)取30mL冰乙酸用水稀释至1000mL。4.4氯化钾溶液c(KCD)=0.25g/mL称取250g氯化钾溶解于水中,稀释至1000mL。4.5硝酸银溶液c(AgNO,)=0.01g/mL称取1g硝酸银溶解于水中,稀释至100mL。4.6淀粉酶悬浮液c=0.06g/mL
取6g淀粉酶制剂(takadiastase),其活性为1:250或相当活性的其他磷酸酯酶,用2.5mol/L乙酸钠溶液(4.2)制成悬浮液,稀释至100mL,当日制备当日使用4.7硅酸盐离子交换剂
4.7.1活性沸石
将沸石按规定筛层进行筛选,称取通过上层筛(孔径0.297mm,50目)、留存在下层筛(孔径Φ0.177mm,80日)上的沸石100g于布氏漏斗中,用3%的热乙酸(4.3,约50℃)溶液洗涤15min,应使乙酸与沸石保持接触10min~15min,用真空泵减压抽滤乙酸;再用0.25g/mL的热氯化钾溶液(4.4,约50℃)250mL进行洗涤;最后用热水(约50℃)洗涤,直至洗出液用硝酸银(4.5)检查时不出现1
GB/T76282008
氯离子。在室温或低于100℃烘箱中将沸石干燥后,在干燥器中冷却至室温,储存于磨口瓶中备用。4.7.2硅酸盐离子交换树脂,Bio-Rex70(H型)将硅酸盐离子交换树脂按规定筛层进行筛选,称取通过上层筛(孔径$0.297mm,50月)、留存在下层筛(孔径Φ0.149mm,100目)上的硅酸盐离子交换树脂50g,加人300mL盐酸(4.1),振摇10min~15min,将酸倒出,再加300mL水,振摇1min,将水倒出。重复数次,直至树脂的pH为4.5~7.0,抽滤或离心除去多余的水分,冷藏储存(4℃)。当时使用,可以不除去多余的水分。4.8氢氧化钠溶液c(NaOH)=0.15g/mL将15g氢氧化钠溶于水中,冷却,稀释至100mL4.9铁氰化钾溶液c[K,Fe(CN)。]=0.01g/mL将1g铁氰化钾溶于水中,稀释至100mL,赔存在具塞棕色瓶中,置于阴凉处保存。4.10碱性铁氰化钾
取0.01g/mL铁氰化钾溶液9)3mL,用0.15g/mL氢氧化钠溶液(8)稀释定容至100mL,现配现用。也可以按每3mL氧化钠溶液(4.8)加人1滴铁氰化钾溶液(4.9)混合配制。4.11异丁醇[(CH),CHCHOH
空白荧光值应低硫胺素标准工作溶液Ⅲ)(412.3)的荧光值的1%。否则,应将异丁醇在全玻璃仪器上蒸馏,或加粘性灵振摇除去荧光杂质4.12硫胺素溶液
4.12.1硫胺素标准储备溶液(I)e(CzHON.SCI)=100μg/mL将硫胺素盐酸放在装有五氧化二磷的干燥器中至少24h,然后精确称取100mg溶于25%乙醇储存于棕色瓶中冷藏(4℃),可保存数月(4.14)中,并用2560享稀释定容至1000m
4.12.2硫胺素标准落液()c(CzHONSCD=5μg/mL准确量取5m流胺素标准储备溶液(1(412.1)用25%乙醇(4.14)稀释,定容至100mL。4.12.3硫胺素标准工作溶液(m)(CH,ONSC)=0.2μg/mL准确量取4mL硫胺素标准溶液(Ⅱ)(412.2).用0.1mol/L硫酸(4.15)稀释定容至100mL,现配现用。
4.13硫酸童宁溶液口
4.13.1硫酸奎宁储液
精确称取100mg硫酸套宁,溶于0.1mol/L硫酸(415)电.用0.1mol/L硫酸稀释至1000mL,老容液混浊则不可使用。
储存于棕色瓶中冷藏保存
4.13.2硫酸奎宁工作液
准确量取3mL硫酸奎于磺备液(4.13.1),用0.1mol/L硫酸(4/15)稀释至1000mL,储存于棕色瓶中冷藏保存。
4.14乙醇溶液25%(体积分数)
将25mL无水乙醇加入到水中,稀释定容至100mL,摇今4.15硫酸溶液c(1/2H,SO.)=0.1mol/L将2.8mL浓硫酸加入到水中,稀释定容至1000mL。5
仪器设备
5.1荧光分光光度计。
5.2电热恒温水浴:100℃
5.3实验室用真空泵。
5.4电热恒温箱:37℃~40℃。
5.5吸附分离柱(见图1):容器全长约235mm:上端储液槽(外径×长度)30mm×70mm,容量为50mL;中部吸附管(外径X长度)8mmX130mm;下端为35mm的毛细管,其孔径在液体通过时的流2
量应控制在不大于1mL/min:
5.6反应管(见图2):25ml具塞刻度玻璃试管。单位为旁米
分析天平2
5.8实验磨。
台感量0.1g,感量0.1mg
5.9容量瓶:100ml
15mL15mL25mL
移液管:
注射器:
织网试验筛:孔径中o.84mmΦ0.149mm(20日-—100日)。金属丝编
1800/mm
离心机:
干燥器。
试样制备
GB/T7628-2008
单位为毫米
6.1按GB5491进行开样、分样
6.2粒状样品:用验磨粉碎,通过孔径$0.81mm(20日)筛,再用混样器或其他适当方法充分混匀。通过孔径+0.84mm(20自)筛,再用混样器或其他适当方法充分6.3粉状样品:称取200300
混匀;如有较大颗粒或美快养品,用实验磨粉碎,并通过孔径o.84mm筛(2°日),再用混样器或其他适当方法充分混匀。
7分析步骤
7.1称样
根据试样中硫胺素含量,按表1的推荐称样量精确称取试样,置于100mL容量瓶中。表1试样量及样液体积
试样中硫胺素含量(X)/((mg/kg)试样量(m))/g加人到离子交换柱的样液体积(V,)/ml收集洗脱液体积(V)/ml15
4. 0~6. 6
13.4-22.0
22.2~-44.0
44以上
硫胺素标准工作液
GB/T7628-2008
7.2提取
加人0.1mol/L硫酸(4.15)50mL到容量瓶(7.1)中,在100℃电热恒温水浴中加热10min,并不时摇动容量瓶,以防结块:
7.3酶解
冷却容量瓶(7.2)至40℃以下,加人5mL淀粉酶悬浮液(4.6),充分混匀,在37℃~40℃温度环境中至少放置4h,冷却至室温,用水稀释定容至100mL,摇勺,将试液通过滤纸于过滤,弃去最初的5mL滤液后再收集滤液于锥形瓶中,作为样品提取液。如提取液色泽浅、无干扰物质时,不需进行提纯步骤,按7.6进行氧化操作。测定结果按第8章的式(1)计算。
7.4净化
7.4.1当提取液色泽很深或含有干扰物质时,按7.4.2、7.4.3、7.4.4的步骤净化,测定结果按第8章的式(2)计算。
7.4.2取适量玻璃棉置于吸附分离柱吸附管底部,然后将0.5g活性沸石(4.7.1)或制备好的硅酸盐离子交换树脂(4.7.2)放入吸附管,在使用前用沸水充分洗涤吸附分离柱。7.4.3准确移取适量体积见表1(V)的样液,加人到已处理好的吸附分离柱中(吸附剂应保持被沸水完全浸泡),用5mL热水(约50℃)洗涤吸附分离柱,连续操作三次,弃去洗出液,以确保硫胺素在柱上分配完全。
7.4.4取适量煮沸的0.25g/mL氯化钾溶液(4.4),分三次连续加人吸附分离柱,用25mL具塞刻度玻璃试管收集洗脱液,收集的洗脱液体积[见表1(V)。冷却后用水稀释定容至25mL,充分混勾。7.5外标溶液
准确吸取25mL硫胺素标准工作液(Ⅲ)(4.12.3),重复7.1~7.3操作,作为外标溶液。7.6氧化
分别准确移取5mL样液(7.3)或洗脱液(7.4.3)于两只具塞离心试管中,编为1号试管和2号试管。
在1号具塞离心试管中,加人3mL碱性铁化钾溶液(4.10),在2号具塞离心试管中加人3mL0.15g/mL氢氧化钠溶液(4.8),振摇约30s:再分别准确加人15mL异丁醇(4.11),剧烈振摇1min。将1号、2号具塞离心试管置于离心机中以1800/min的速度离心1min后,用注射器吸去水层,在异丁醇层中加人1㎡L无水乙醇,混匀。7.7测定
7.7.1调整荧光分光光度计
用硫酸奎宁工作液(4.13.2)调整荧光分光光度计,使其处于正常工作状态。7.7.2测定样液的荧光强度
将10mL异丁醇层倒人比色杯中,于激发波长365nm,发射波长435nm处测定硫胺素的荧光值分别记录1号试管试液的荧光值R,和2号试管试液空白的荧光值R。同时分别准确吸取5mL外标溶液(7.5)置人另两只具塞离心试管中,编为3号和4号(作为标准空白),按7.6操作后,测定3号试管的硫胺素标准工作溶液(Ⅲ)(4.12.3)的荧光值R。和4号试管的硫胺素标准工作溶液空白的荧光值R%。8结果计算
未经过提纯的试样中维生素B含量(X)按式(1)计算,经过提纯的试样中维生素B含量(X,)按式(2)计算:bZxz.net
X, =(R.-Rt)×Vx
(R.-Rb)Xm
(1))
式中:
(R-R)×VXV,Xe
(R,-R)XV.XmXX。
未经过提纯的试样中维生素B含量,单位为毫克每千克(mg/kg)经过提纯的试样中维生素B含量,单位为毫克每千克(mg/kg);1号管试液的荧光值;
2号管试液空白的荧光值;
3号管硫胺素标准工作溶液的荧光值;4号管硫胺素标准工作溶液空白的荧光值;分取过离子交换柱样液的体积,单位为毫升(mL):收集洗脱液体积,单位为毫升(mL);试样质量,单位为克(g);
酶解提取液的体积,单位为毫升(mL);硫胺素标准工作溶液的浓度,单位为微克每毫升(ug/mL);X.
参与反应样品溶液体积与参与反应标准溶液体积的比值(通常5/5一1)。GB/T7628—2008
..(2)
每个试样进行平行试验,以算术平均值为测定结果。计算结果保留3位有效数字。9重复性
同一分析者对同试样在同样条件下同时进行两次测定:当维生素B,含量X<5.0mg/kg时,其获得的两次独立测定结果的相对偏差应≤15%,当维生素B含量X5.0mg/kg时,其获得的两次独立测定结果的相对偏差应10%:当维生素B含量X≥50.0mg/kg时,其获得的两次独立测定结果的相对偏差应≤5%。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 国家标准(GB)
- GB/T2828.1-2012 计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB/T23892.3-2009 滑动轴承 稳态条件下流体动压可倾瓦块止推轴承 第3部分:可倾瓦块止推轴承计算的许用值
- GB/T11839-1989 二氧化铀芯块中硼的测定 姜黄素萃取光度法
- GB/T6122.1-2002 圆角铣刀 第1部分:型式和尺寸
- GB/T7433-1987 对称电缆载波通信系统抗无线电广播和通信干扰的指标
- GB/T21238-2007 玻璃纤维增强塑料夹砂管
- GB/T28809-2012 轨道交通 通信、信号和处理系统 信号用安全相关电子系统
- GB/T9124.1-2019 钢制管法兰 第1部分:PN 系列
- GB17945-2024 消防应急照明和疏散指示系统
- GB15603-2022 危险化学品仓库储存通则
- GB6819-1996 溶解乙炔
- GB/T9239-1988 刚性转子平衡品质 许用不平衡的确定
- GB/T15917.3-1995 金属镝及氧化镝化学分析方法 对氯苯基荧光酮--溴化十六烷基三甲基胺分光光度法测定钽量
- GB/T5738-1995 瓶装酒、饮料塑料周转箱
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2