- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0124-1993 药用中间体乙酰苯胺(退热冰)
标准号:
YY/T 0124-1993
标准名称:
药用中间体乙酰苯胺(退热冰)
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
160.88 KB
点击下载
标准简介:
YY/T 0124-1993.
5.6.3允许差
本方法两次平行测定的允许绝对差在0. 04%以内。
6检验规则
6.1 本产品应由生产厂的质量检验部门进行检验,生产厂应保证所有出厂的产品符合本标准的要求,每件产品都应附有产品合格证。
6.2使用单位可按照本标准对所收到的产品进行质量检验。
6.3 取样量,按包装总件数10%随机取样,少于10件取1件.取样需备有清洁、干燥、具有密闭性和避光性的样品瓶,瓶上贴有标签,注明产品名称、批号、生产厂名称和取样日期、取样人签名及必要的说明。取样时,应用清洁适用的不锈钢取样器,沿包装中心线伸入每包装三分之二深度处,取足够址的样品等量混匀后,装入样品瓶中。每批产品取样2份,每份样品应为全检所霜样品的3倍量,-份送化验室,另一份密封保存,以备仲裁分析用。
6.4如果在检验中有一项指标不符合标准,应加倍取样件数,重新取样品进行核验,产品重新检验的结果有一项不符合标准时,则整批产品为不合格品。
6.5如供霜双方对产品质量发生异议,可由双方协商选定仲裁单位,按本标准进行仲裁。
7标志、 包装运输和贮存
7.1 药用中间体乙酰苯胺用内衬聚乙烯吹塑薄膜袋(薄膜厚度不少于0.05 mm)的塑料编织袋包装,每袋净重50 kg.
7.2每批包装好的产品应附有本标准6.1条规定的质址证明书。.
7.3 包装袋上应徐刷牢固标志,内容应包括:产品名称、批号、产品生产批文号、生产日期、净重、商标、生产厂名称和贮存条件及GB 191图2“蔡用手钩”的标志。
7.4运输和贮存时应防止曝晒、雨淋,远离火源。
附加说明:
YY/T 0124由国家医药管理局提出。
YY/T 0124由国家医药管理局天津药物研究院归口。
YY/T 0124由吉林市制药厂负责起草。
YY/T 0124起草人宋秀清、金美丹。
YY/T 0124参照采用日本工业标准JIS K4111-85(乙酰苯胺)。
部分标准内容:
乙酰苯
胺(退热冰)
1主题内容与适用范围
YY/T0124—93
本标准规定了药用中间体乙酰苯胺的技术要求、试验方法、检验规则、包装、标志、运输和贮存的要求。
本标准适用于苯胺被冰乙酸酰化制得的乙酰苯胺,本产品主要用作生产医药、染料及其他有机化工产品的原料。
2引用标准
中华人民共和国药典
GB191包装贮运图示标志
ZBC10005原料药杂质含量测定法极限数值的表示方法和判定法3化学名称、分子式、结构式、分子量化学名称:N-乙酰基苯胺
N-acetyl aniline
分子式:C,H.NO
结构式:
分子量:135.17(按1987年国际原子量)4技术要求
4.1性状
本品为褐色或淡棕色片状固体,混有少量粉末,易溶于乙醇、三氯甲烷、丙三醇,溶解于热水、乙醚,微溶于水。
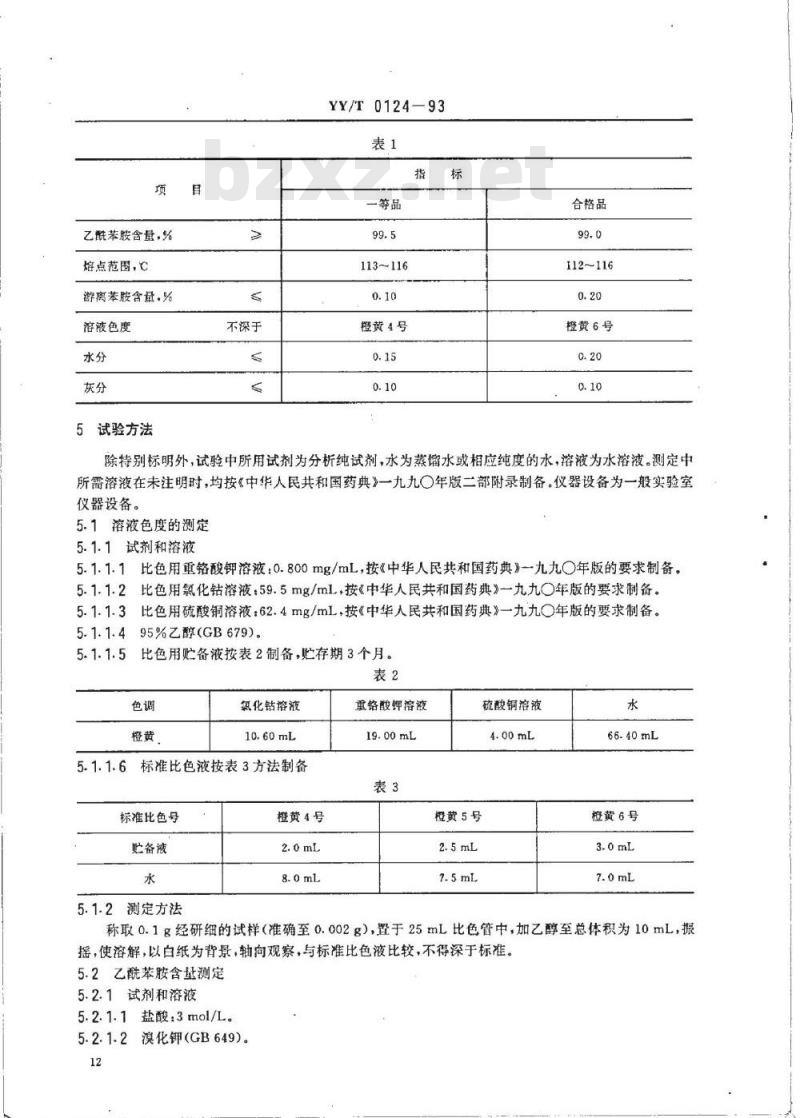
4.2项目和指标
国家医药管理局1993-05-06批准1993-10-01实施
乙酰苯胺含量,%
熔点范围,C
游离苯胺含量,%
溶液色度
5试验方法
不深于
YY/T0124-93
一等品
113~116
橙黄4号
合格品
112~116
橙黄6号
除特别标明外,试验中所用试剂为分析纯试剂,水为蒸馏水或相应纯度的水,溶液为水溶液。测定中所需溶液在未注明时,均按《中华人民共和国药典》一九九○年版二部附录制备。仪器设备为一般实验室仪器设备。
5.1溶液色度的测定
5.1.1试剂和溶液
5.1.1.1比色用重铬酸钾溶液:0.800mg/mL,按《中华人民共和国药典》一九九O年版的要求制备。5.1.1.2比色用氟化钻溶液:59.5mg/mL,按《中华人民共和国药典》一九九O年版的要求制备。5.1.1.3比色用硫酸铜溶液:62.4mg/mL,按《中华人民共和国药典》一九九○年版的要求制备。5.1.1.495%乙醇(GB679)。
比色用贮备液按表2制备,贮存期3个月。5.1.1.5
橙黄,
氮化钻溶液
6标准比色液按表3方法制备
标准比色号
贮备液
5.1.2测定方法
橙黄4号
重铬酸钾溶液
硫酸铜溶液
橙黄5号
66-40mL
橙黄6号
称取0.1g经研细的试样(准确至0.002g),置于25mL比色管中,加乙醇至总体积为10mL,振摇,使溶解,以白纸为背景,轴向观察,与标准比色液比较,不得深于标准。5.2乙酰苯胺含基测定
5.2.1试剂和溶液
5.2.1.1盐酸:3mol/L。
溴化钾(GB649)。
YY/T0124—93
5.2.1.3亚硝酸钠标准滴定溶液:0.1mo1/L。5.2.1.4淀粉指示液:取可溶性淀粉0.5g,加水5mL,搅匀后,缓缓倾入100mL沸水中,随加随搅拌,继续煮沸2min,放冷,倾取上层清液即得。5.2.1.5碘化钾淀粉指示液:碘化钾(GB1272)0.2g,加新制的淀粉指示液100mL,使溶解,即得。5.2.2仪器装置
永停滴定仪或按下图装置。
1.5V干电池
(R与电流计临界
阻尼电阻值近似)
使用永停滴定仪时,选择极化电压为50mV,灵敏度为10-A/格。铂-铂电极在使用前或使用钝化后,应用洗液浸泡40~60s,然后用蒸增水冲洗干净,使其活化。5.2.3测定方法
称取样品0.3g(准确至0.0002g),置于250mL圆底烧瓶中,加入3mol/L的盐酸30mL,接上球型冷凝器,加热回流30min,待溶液冷却至室温后,用少量水冲洗冷凝器内壁,全部转移到250mL烧杯中,加3mol/L的盐酸30mL和3g漠化钾,加水稀释至总体积约100mL,置磁力搅拌器上搅拌使溶解。
采用永停法时,将铂-铂电极于上述溶液中,使滴定管尖端插入液面下约三分之二处,在搅拌下于10~25℃用0.1mol/L亚硝酸钠标准液迅速滴定,近终点时,将滴定管尖端提出液面,用少量水淋洗,然后缓缓逐滴进行滴定,至电流指针突然偏转,并停留1min,不再回复时为滴定终点。采用一般容量分析法时,将滴定管尖端插入液下约三分之二处,在揽拌下于10~25℃用0.1mol/L亚硝酸钠标准溶液迅速滴定到接近终点,将滴定管尖端提出液面,用少量水冲洗,在强烈搅拌下继续逐滴滴定,直至用玻璃格蘸取少量溶液立即使碘化钾-淀粉指示剂显蓝色,搅拌1min后再试,仍显蓝色即为终点。
可用永停法指示终点,也可用碘化钾-淀粉外指示剂指示终点。5.2.4分析结果的表述
药用中间体乙酰苯胺百分含量X,按式(1)计算:X, = C.VX 0.135 2 × 100 - 1. 451 4X,m
式中:C——o.1mol/L亚硝酸钠标准滴定溶液的实际浓度,mol/L,V-滴定试样消耗0.1mol/L亚硝酸钠标准滴定溶液的体积,mL;试样的质量·g;
0.1352——与1.00mL亚硝酸钠标准滴定溶液(浓度1.000mol/L)相当的以克表示的乙酰苯胺的质量,
YY/T0124-93
X—按本标准5.4条规定的游离苯胺百分含量1:451.4一,游离苯胺换筑成乙酰苯胺的系数。5.2.5允许差
本方法两次平行测定的允许绝对差在0.3%以内。,5.3熔点范围的测定
产品不经干燥,直接按《中华人民共和国药典》一九九○年版熔点测定法第一法测定,5.4游离苯胺含量的测定
5.4.1试剂和溶液
5.4.1.1溴化钾(GB649)。
5.4.1.2盐酸溶液:3mol/L。
5.4.1.395%乙醇(GB679)。
亚硝酸钠标准滴定溶液:0.05mol/L5.4.1.4
5.4.1.5碘化钾淀粉指示液:同5.2.1.5条。5.4.2测定方法www.bzxz.net
称取1.5g(准确至0.0002g)试样,置250mL烧杯中,加10mL乙醇溶解,加100mL水稀释,加3mol/L盐酸溶液10mL和0.5g溴化钾,待溴化钾溶解后,以碘化钾-淀粉为外指示剂,用0.05mol/L亚硝酸钠标准滴定溶液滴定至碘化钾-淀粉指示液显蓝色,1min后再试,仍显蓝色,即为终点,同时作空白校正。
5.4.3计算结果的表述
游离苯胺百分含量X:按式(2)计算:X,G(V/-V,)× 0. 093 12
一0.05mol/L亚硝酸钠标准滴定溶液的浓度,mol/LV,滴定试样消耗0.05mo1/L亚硝酸钠标准滴定溶液的体积,mLV,—空白试验消耗.0.05mol/L亚硝酸钠标准滴定溶液的体积,mL;m
试样的质量,g;
(2)
与1.00mL亚硝酸钠标准滴定溶液(浓度1.000mol/L)相当的以克表示的苯胺的质量。5.4.4允许差
本方法两次平行测定的允许绝对差在0.03%以内。5.5水分测定
称取试样1g(准确至0.0002g),加无水甲醇5mL溶解,按《中华人民共和国药典》九九年版二部附录第55页第一法的规定操作,目测滴定终点,同时作空白校正。5.6灰分测定
5.6.1测定方法
称取1.0g试样(准确至0.0002g),置于已恒重的瓷埚中,在通风橱中置电炉或电热板上加热至乙酰苯胺全部升华,然后转入高温炉中,于650士25℃灼烧30min,移入干燥器内冷却至室温,称量。5.6.2分析结果的表述
本品中灰分的百分含量X,按下式计算:mz
式中:m2
灼烧后灰分与瓷甘埚的质量,g:m
-瓷地埚质量,g;
m.—试样的质量.g。
5.6.3允许差
YY/T0124-93
本方法两次平行测定的允许绝对差在0.04%以内6检验规则
6.1本产品应由生产厂的质量检验部门进行检验,生产厂应保证所有出厂的产品符合本标准的要求,每件产品都应附有产品合格证。6.2使用单位可按照本标准对所收到的产品进行质量检验。6.3取样量,按包装总件数10%随机取样,少于10件取1件。取样需备有清洁、干燥、具有密闭性和避光性的样品瓶,瓶上贴有标签,注明产品名称、批号、生产厂名称和取样日期、取样人签名及必要的说明。取样时,应用清洁适用的不锈钢取样器,沿包装中心线伸入每包装三分之二深度处,取足够量的样品等量混匀后,装入样品瓶中。每批产品取样2份,每份样品应为全检所需样品的3倍量,一份送化验室,另一份密封保存,以备仲裁分析用。6.4如果在检验中有一项指标不符合标准,应加倍取样件数,重新取样品进行核验,产品重新检验的结果有一项不符合标准时,则整批产品为不合格品。6.5如供需双方对产品质量发生异议,可由双方协商选定仲裁单位,按本标准进行仲裁。7标志、包装、运输和贮存
7.1药用中间体乙酰苯胺用内衬聚乙烯吹塑薄膜袋(薄膜厚度不少于0.05mm)的塑料编织袋包装,每袋净重50kg。
7.2每批包装好的产品应附有本标准6.1条规定的质量证明书。7.3包装袋上应涂刷牢固标志,内容应包括,产品名称、批号、产品生产批文号、生产日期、净重、商标、生产厂名称和贮存条件及GB191图2\禁用手钩”的标志。7.4运输和处存时应防止曝晒、雨淋,远离火源。附加说明:
本标准由国家医药管理局提出
本标准由国家医药管理局天津药物研究院归口。本标准由吉林市制药厂负责起草。本标准起草人未秀清、金美丹。本标准参照采用日本工业标准JISK4111—85《乙酰苯胺》。15
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0182-2013 宫内节育器取出钩
- YY1122-2005 咬骨钳(剪)通用技术条件
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY/T1268-2015 环氧乙烷灭菌的产品追加和过程等效
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY0345-2002 骨接合植入物金属骨针
- YY0455-2003 医用电气设备 第2部分:婴儿辐射保暖台安全专用要求
- YY/T0452-2003 止血钳
- 行业新闻
网站备案号:湘ICP备2025141790号-2