- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 1271-2016 心肺转流系统一次性使用吸引管
标准号:
YY 1271-2016
标准名称:
心肺转流系统一次性使用吸引管
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
1.80 MB
点击下载
标准简介:
YY 1271-2016.Cardiopulmonary bypass systems-Suction catheter for single use.
1范围
YY 1271规定了无菌的一次性使用吸引管(以下简称吸引管)的分类与结构.要求、试验方法、标志、标签、使用说明书包装、运输.贮存。
YY 1271适用于吸引管,供配套心肺转流系统,吸引管供心血管手术中用于左心脏排气,吸引减压或减轻左心负荷,吸引心脏术野内血液等液体使用。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件.
GB/T 191- -2008包装 储运图示标志
GB/T 9969- 2008 工业产 品使用说明书总则
GB/T 14233.1- -2008医用输液 、输血.注射器具检验方法第1部分:化学分析方法
GB/T 14233.2- 2005 医用输液 、输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗器械生物学评价 第1部分:风险管理过程中的评价与试验
GB 18279医疗器械 环氧乙烷灭菌确认和常 规控制
GB18280医疗保健产品灭菌确认和常规控制要求辐射灭菌
GB 19335- -2003 - .次性使用血路产品通用技术条件
YY/T 0149- -2006不锈钢医用器械耐腐蚀性能试验方法
YY/T 0466.1--2009医疗器械用于 医疗器械标签、标记和提供信息的符号第1部分:通用要求
YY/T 0681.1-2009无菌医疗器械包装试验方法第1部分:加速老化试验指南
3分类与结构
3.1 分类
YY 1271规定按产品的用途分为左心引流管、心腔吸引管(右心吸引管)两类;左心引流管主要用于体外循环心脏手术中,用于左心脏排气,减压或减轻左心负荷,心腔吸引管主要用于体外循环心脏手术中,用于吸引心脏术野内血液等液体,将之传输回贮血器。吸引管应以产品外径或外圆周长作为规格。推荐以毫米(mm)为单位,如果不是以毫米(mm)为单位使用说明书应有对照表。具体规格型号及尺寸由制造商按自身的实际情况规定.
部分标准内容:
中华人民共和国医药行业标准
YY1271—2016
心肺转流系统
一次性使用吸引管
Cardiopulmonary bypass systems-Suction catheter for single use2016-03-23发布
国家食品药品监督管理总局
2018-01-01实施
本标准全部技术内客为强制性
本标准按照GB/T1.1一2009给出的规则起草。YY1271-2016
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家食品药品监督管理总局提出。本标准由全国医用体外循环设备标准化技术委员会(SAC/TC158)归口。本标准起草单位:东莞科威医疗器械有限公司、国家食品药品监督管理局广州医疗器械质量监督检验中心。
本标准主要起草人:刘贻声、唐云华、洪良通、何晓帆。I
1范围
心肺转流系统
一次性使用吸引管
YY1271—2016
本标准规定了无菌的一次性使用吸引管(以下简称吸引管)的分类与结构、要求、试验方法、标志、标签、使用说明书、包装、运输、贮存。本标准适用于吸引管,供配套心肺转流系统,吸引管供心血管手术中用于左心脏排气,吸引减压或减轻左心负荷,吸引心脏术野内血液等液体使用。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T191—2008包装储运图示标志GB/T9969—2008工业产品使用说明书总则
GB/T14233.1一2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2一2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB18279
医疗器械环氧乙烷灭菌确认和常规控制GB18280
医疗保健产品灭菌确认和常规控制要求辐射灭菌GB19335—2003
一次性使用血路产品通用技术条件YY/T0149—2006不锈钢医用器械耐腐蚀性能试验方法YY/T0466.1—2009
医疗器械用于医疗器械标签,标记和提供信息的符号第1部分:通用YY/T0681.1-2009
无菌医疗器械包装试验方法第1部分:加速老化试验指南3分类与结构
3.1分类
本标准规定按产品的用途分为左心引流管、心腔吸引管(右心吸引管)两类:左心引流管主要用于体外循环心脏手术中,用于左心脏排气,减压或减轻左心负荷,心腔吸引管主要用于体外循环心脏手术中,用于吸引心脏术野内血液等液体,将之传输回贮血器。吸引管应以产品外径或外圆周长作为规格。推荐以毫米(mm)为单位,如果不是以毫米(mm)为单位,使用说明书应有对照表。具体规格型号及尺寸由制造商按自身的实际情况规定。1
HiiKAoNiKAca
YY1271—2016
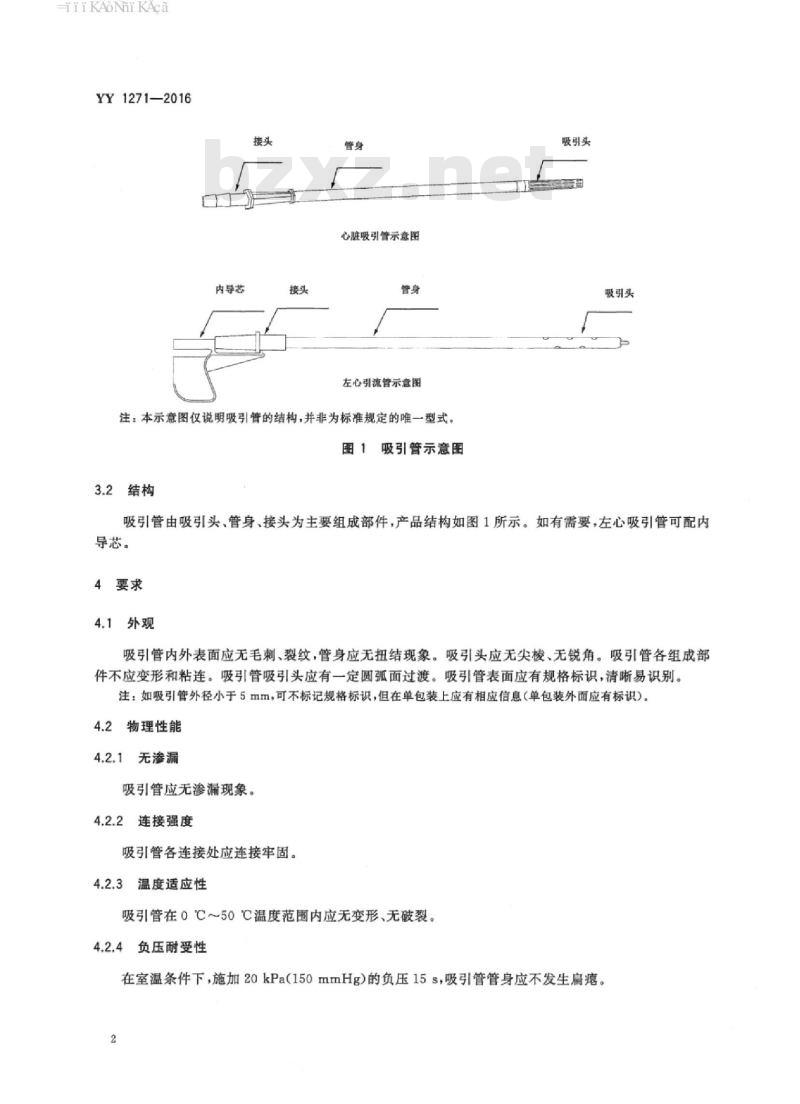
内导芯
心脏吸引管示意图
左心引流管示意图
注:本示意图仅说明吸引管的结构,并非为标准规定的唯一型式。图1吸引管示意图
3.2结构
吸引头
吸引头
吸引管由吸引头、管身、接头为主要组成部件,产品结构如图1所示。如有需要,左心吸引管可配内导芯。
4要求
4.1外观
吸引管内外表面应无毛刺、裂纹,管身应无扭结现象。吸引头应无尖棱、无锐角。吸引管各组成部件不应变形和粘连。吸引管吸引头应有一定圆弧面过渡。吸引管表面应有规格标识,清晰易识别。注:如吸引管外径小于5mm,可不标记规格标识,但在单包装上应有相应信息(单包装外面应有标识)。4.2物理性能
4.2.1无渗漏
吸引管应无渗漏现象。
4.2.2连接强度
吸引管各连接处应连接牢固。
3温度适应性
吸引管在0℃~50℃温度范围内应无变形、无破裂。4.2.4负压耐受性
在室温条件下,施加20kPa(150mmHg)的负压15s,吸引管管身应不发生扁癌。2
HiiKAoNiKAca
4.3生物性能
4.3.1生物学评价
吸引管应无生物学危害。
4.3.2无菌
吸引管应经过已确认过的灭菌过程使产品无菌。4.3.3无热原
吸引管应无热原。
4.4化学性能
4.4.1还原物质(易氧化物)
YY1271—2016
20mL检验液与同批空白对照液所消耗的高锰酸钾溶液[c(KMnO,)=0.002mol/L]的体积之差应不超过2.0mL。
重金属
当用原子吸收分光光度计法(AAS)或相当的方法进行测定时,检验液中钡、铬、铜、铅、锡的总含量应不超过1μg/mL。镉的含量应不超过0.1μg/mL。当按比色法试验时,检验液呈现的颜色应不超过质量浓度p(Pb2+)=1μg/mL的标准对照液。4.4.3酸碱度
检验液与同批空白液对照,pH之差应不超过1.5。4.4.4蒸发残渣
50mL检验液的蒸发残渣的总量应不超过2mg。4.4.5
紫外吸光度
检验液的吸光度应不大于0.1。
检验液应无色透明。
4.4.7环氧乙烷残留量
吸引管如采用环氧乙烷气体灭菌时,其环氧乙烷残留量应不大于10mg/kg。4.5耐腐蚀性
如有金属部件,则金属部件的耐腐蚀性应不超过b级。4.6微粒污染
吸引管每平方厘米内表面积上的15μm~25μm的微粒数不得超过1个,大于25um的微粒数不得超过0.5个。
HiiKAoNiKAca
YY1271—2016
4.7有效期
应给出有效期,有效期内产品应符合规定要求。5试验方法
5.1外观
以目力观察,吸引管应符合4.1的规定。5.2物理性能
5.2.1无渗漏
连接吸引管通路,通人高于大气压力50kPa的空气或氮气,置人水中,持续10min,仔细观察应无气泡逸出。符合4.2.1的规定。
5.2.2连接强度
将吸引管各连接处施加15N的轴向静态拉力,持续15s,应不发生分离,应符合4.2.2的规定。5.2.3温度适应性
将吸引管放人0℃环境中3min,然后放人50℃环境中3h,取出后恢复至室温进行观察,并作5.2.1的无渗漏测试,应符合4.2.3的规定。5.2.4负压耐受性
将吸引管的接头端连接于真空源,堵住吸引孔,在室温条件下施加20kPa的负压15s,吸引管的管身应不发生扁癌,应符合4.2.4的规定。5.3生物性能
5.3.1生物学评价
应按GB/T16886.1的规定进行生物学性能的评价。5.3.2无菌试验
灭菌过程应按GB18279或GB18280等相关标准进行确认。无菌检验按GB/T14233.2一2005的规定进行,该方法不宜用于出厂检验。5.3.3热原试验
按GB/T14233.2一2005的规定进行检验,应符合4.3.3的规定。5.4化学性能
试验液制备
按GB/T14233.12008中表1序号1的规定制备检验液。5.4.2还原物质(易氧化物)试验按GB/T14233.1一2008中5.2.2方法的规定进行,应符合4.4.1的规定。4
TTiKAoNiKAca
5.4.3重金属
按GB/T14233.1-2008中5.6.1和5.9.1规定进行试验,应符合4.4.2的规定。5.4.4酸碱度试验
按GB/T14233.1一2008中5.4.1规定进行,应符合4.4.3的规定。5.4.5蒸发残渣试验
按GB/T14233.1一2008中5.5规定进行,应符合4.4.4的规定。5.4.6紫外吸光度试验
YY1271—2016
按GB/T14233.1—2008中规定在250nm~320nm波长范围内进行,应符合4.4.5的规定。5.4.7色泽
目测检验液,应符合4.4.6的规定。5.4.8环氧乙烷残留量
按GB/T14233.1-2008中的规定进行检验,应符合4.4.7的规定5.5耐腐蚀性
取出金属部件,按YY/T0149一2006中氯化钠溶液试验法的规定进行,结果应符合4.5的规定。5.6微粒污染
试验按GB19335一2003中附录A的规定进行试验,应符合4.6的规定。5.7有效期试验
取过期不超过一个月的产品(仲裁法,宜优先采用),或按YY/T0681.1一2009的规定进行老化,检测4.2、4.3.2、4.3.3,结果应符合4.7的规定。6标志、使用说明书
6.1标志
6.1.1产品单包装应有下列标志:制造商名称;
产品名称、型号规格;
生产批号、有效期;
d)“一次性使用”“无菌”“包装破损禁止使用”“使用前请阅读说明书”等字样或图示。6.1.2产品外包装应有以下标志:a)制造商名称、地址;
b)产品名称。型号规格;
执行标准号;
产品注册号;
生产许可证号;
HiiKAoNiKAca
YY1271—2016
生产批号;
“一次性使用”等字样或图示;灭菌方法;
有效期;
包装数量,体积(长×宽×高);“小心轻放”切勿重压”“怕湿”等字样或标志,应符合GB/T191一2008、YY/T0466.1—2009中有关规定,字样或标志应能保证不因历时较久而模糊不清。使用说明书
吸引管包装内应附使用说明书一份。使用说明书的编写应符合GB/T9969—2008的相关规定。7
包装、运输、贮存
7.1包装
每根吸引管应有单包装。
若千个小包装为一大包装,装人一包装箱内。7.2运输
制造商按实际情况自行规定。
7.3贮存
包装后的吸引管应贮存在温度为0℃~40℃,相对湿度不大于80%无腐蚀气体并且通风良好的室内。
HiiKAoNiKAca
YY1271-2016wwW.bzxz.Net
打印日期:2016年6月8日F009B
中华人民共和国医药
行业标准
心肺转流系统
一次性使用吸引管
YY1271—2016
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100029)北京市西城区三里河北街16号(100045)网址spc.net.cn
总编室:(010)68533533发行中心:(010)51780238读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张0.75字数13千字2016年4月第一版
2016年4月第一次印刷
书号:155066·2-30004定价18.00元如有印装差错
由本社发行中心调换
版权专有
侵权必究
举报电话:(010)68510107
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY0345-2002 骨接合植入物金属骨针
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY/T0452-2003 止血钳
- YY/T0179-2005 丁字式开口器
- YY0062-1991 X射线管组件固有滤过
- YY/T0457.6-2003 医用电气设备 光电X射线影像增强器特性 第6部分:对比度及炫光系数的测定
- YY0476-2004 眼内冲洗灌注液
- YY/T0279-1995 口腔材料生物试验方法 口腔粘膜刺激试验
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T1533-2017 全自动时间分辨荧光免疫分析仪
- YY0322-2000 高频电灼治疗仪
- YY0320-2000 麻醉机
- YY/T0268-2001 牙科学 用于口腔的医疗器械生物相容性临床前评价 第1单:评价与试验项目选择
- YY0011-1990 X射线摄影暗匣
- YY0014-1990 生化分析仪
- 行业新闻
网站备案号:湘ICP备2025141790号-2