- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 26621-2011 日本对虾
部分标准内容:
ICS65.150
中华人民共和国国家标准
GB/T26621—2011
日本对虾
Kuruma prawn
2011-06-16 发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-11-01实施
本标准的附录A和附录B为规范性附录。本标准由中华人民共和国农业部提出。本标准由全国水产标准化技术委员会海水养殖分技术委员会归口。本标准起草单位:中国水产科学研究院黄海水产研究所。本标准主要起草人:刘萍、李健、孔杰、刘志鸿、庄志猛、张岩、王清印。GB/T26621—2011
1范围
日本对虾
GB/T26621—2011
本标准规定了日本对虾(Marsupenaeus japonicus)的主要外部形态构造特征、生长与繁殖,遗传学特性以及检测方法。
本标准适用了日本对虾的种质检测和鉴定。2学名与分类Www.bzxZ.net
2.1学名
日本对虾Marsupenaeusjaponicus(Bate,1988)。2.2分类位置
甲壳纲(Crustacca),十足目(Decapoda),对虾科(Penaeidae),囊对虾属(Marsupenaeus)。3主要形态构造特征
3.1外部特征
日本对虾甲壳光滑无毛,体1有于几条棕色和兰色相间的横带。附肢呈黄色,尾肢后部色泽鲜艳、皇鲜兰色和黄色,边缘呈红色。额角侧沟很深,延伸至头胸甲的斥缘。额角后脊较额角侧沟宽,具中央沟。尾节背面有深的纵沟,未端尖,两侧有 3对细小活动刺。肝脊和额胃脊明显。日本对虾的外部形态见图1。
图1扫本对虾外部形态
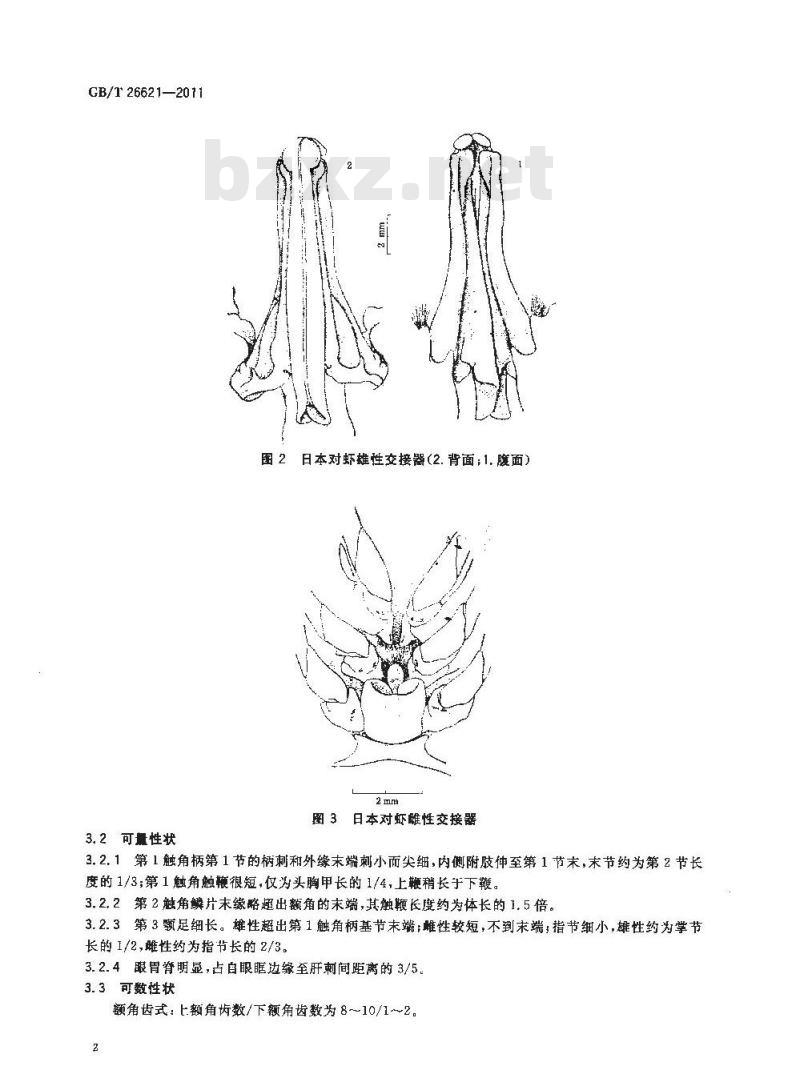
雄虾第1腹肢的内肢变形特化交接器,呈倒钟形,中叶末端形成横圆突起折向腹面,显著超出侧叶末端,顶端稍圆,雄性交接器见图2。雄性附肢由2节构成,末端鳞片状,近乎椭圆形,长约为宽的2倍,边缘着生细端刺。
雌虾第4对和第5对步足之间基部的腹甲上,有囊状交接器为纳精,前端开口,其前方有一圆突,见图3。
GB/T 26621—20↑1
3. 2可量性状
图2日本对虾雄性交接器(2.背面;1.腹面)2 mm
图 3日本对虾雌性交接器
3.2.1第1触角柄第1节的柄刺和外缘末端刺小面尖细,内侧附肢伸至第1节末,末节约为第2节长度的1/3;第1触角触鞭很短,仅为头胸甲长的1/4,上鞭稍长于下鞭。3.2.2第2触角鳞片末缘略超出额角的末端,其触鞭长度约为体长的1.5倍。3.2.3第3颤足细长。雄性超出第1触角柄基节末端;雌性较短,不到末端,指节细小,雄性约为掌节长的1/2,雌性约为指节长的2/3。3.2.4眼胃脊明显,占自眼眶边缘至肝刺间距离的3/53.3可数性状
额角齿式:上额角齿数/下额角齿数为8~~10/1~2。2
4生长繁殖特性
4.1生长
GB/T26621—2011
由于雌雄对虾性成熟时间不同,因而雌雄对虾的生长类型显著不同。雌性、雄性本对虾在南海北部自然海区体长与体重关系式分别以式(1)和式(2)表示。W卓=6.378X10-L3.116
W=9.949X106L3.029.5
式中:
W——体重,单位为克(g);
L—体长,单位为毫米(mm)。
4.2繁殖
4.2.1生物学最小型
性成熟的最小体长为118mm,最小体重为20g。4.2.2交配与产卵
--(2)
日本对虾产卵期较长,南海北部群体2月至8月均有性成熟个体出现,产卵高峰期在2月至5月。在10月上旬至11月初雌虾最后一次蜕皮后进行交配,交配时雄虾将精英投人雌虾交接器纳精囊内,外覆翼状精英栓。婴年春季产卵,纳精囊内精子与卵子同时排出,卵粒直径0.26mm0.28mm,为沉性卵,呈灰绿色或浅褐色。受精后卵膜举起,卵膜径0.33mm~0.44mm。4.2.3怀卵量
发育成熟的亲虾在水温升至26℃左右开始产卵,为多次产卵。雌虾怀卵量2010°粒~50×10*粒。
5遗传学特性
5.1染色体数目
日本对虾的染色体数目为2n=86。5.2生化遗传学特性
5.2.1同工酶图谱
日本对虾成体肌肉中的乳酸脱氢酶(LDH)同工酶电泳图谱见图4,表现为一条酶带。图4日本对虾肌肉LDH同工酶电泳图谱5.2.2群体遗传变异范围
日本对虾平均多态位点比例为18.2%,平均杂合度的观测值为0.1042士0.0045。6检测方法
6.1染色体的检测
6.1.1染色体的制备
日本对虾胚胎或幼体放人含0.02%秋水仙素的海水中培养3h~4h。6.1.1.1
6.1.1.2移去海水,加人0.075mol/L氯化钾溶液中室温下处理20min~30min。3
GB/T 26621—2011
6.1.1.3移去低渗溶液,加入预冷的现配卡诺(Carnoy)氏固定液(甲醇:冰乙酸一3:1)固定,每隔15min更换次固定液,更换2次~3次,最后更换1:1的Carnoy氏固定液固定3omin。6.1.1.4将胚胎或幼体滴到冰冻的载玻片上,室温下干燥。6.1.1.5用磷酸缓冲液(0.1mol/L.pH7.2)将吉姆萨(Giemsa)原液稀释为4%的溶液染色15min。吉姆萨染色滋的配制见附录A。
6.1.2染色体观察
选择染色体形态好的分裂相100个计数,确定染色体数目。6.2同工酶检测
6.2.1样品的采集与保存
日本对虾成体(活体)运到实验室,保存于70℃超低温冰箱中。6.2.2样品制备
从液氮中分别取出样品(肌肉),加人5倍体积的0.1mol/L磷酸缓冲液(PBS)后冰浴勾浆,4℃离心(15 000 1/min,10 min),取上消液加人少量1%酚兰,再加入等体积的 40%蔗糖溶液。一20 ℃保存待测。
6.2.3电泳
同工酶电泳采用不连续聚丙烯酰胺凝胶垂直电泳。电泳在4℃冰箱中进行。电泳参数如下。凝胶浓度(T) : T浓缩 - 3. 0%(pH6. 7),T分离放 =7. 5%(pH8. 9)。乳酸脱氢酶染色液配方见附录B
6.2.4结果计算
多态位点比例按式(3)计算:
P.- N./N×100%
式中:
P.\多态位点比例
N,”多态位点数;
N.——观察位点总数。
平均杂合度观察值按式(4)计算:H.=HI/N
式中:
平均杂合度观察值:
观察到的杂合个体数;
观察的个体总数。
7判定规则
检测结果不符合第3章和5.1要求的,则判定为不合格项;有不合格项的样品为不合格样品:合格样品数与样品总数的比为合格率,4
A.1 Glemsa 染色液母液
附录A
(规范性附录)
吉姆萨(Giensa)染色液的配制
GB/T 26621—2011
称取0.5gGiemsa粉,量取甘油33mL,在研钵中先用少量甘油与Giemsa粉混合,研磨至无颗粒时再将剩余甘油加入:在 56 ℃条件下温浴 2 h 后,加人 33 mL甲醇,混勾。并保存于棕色瓶中备用。A,2磷酸缓种液(0.2 mol/L,pH7.2)磷酸缓冲液由A液和B液按比例混合而成。A.2. 1A 液(0.2 mol/L,Na,HPO,)取36.1磷酸氢二钠(NazHPO,.Hz0)定容于1000ml.的蒸馅水中;或取71.63g磷酸氢二钠(Na2HPO2H,0)定容于100 mL的馅水中,即可。A.2.2 B 液(0. 2 mol/L,NaH,PO,)取27.6g磷酸二氢钠(NaH,PO。·H,O)定容于1000ml.的蒸馏水中;或取31.21g磷酸二氢钠(NaH,PO·2H,O)定容于100UmL的蒸馏水中,即可。A.2.3取A液720mL、B液28mL,两者混合即可。A, 3Giemsa 染色液
取100 mL的磷酸缓冲,加人4 mLGiemsa染色原液即可。5
GB/T26621—2011
附录B
(规范性附录)
同工酶染色液及其所需溶液的配制B. 11 mol/L三羟甲基氨基甲烷-盐酸(Tris-HC1)缓冲液的配制800 mL水中加入 121,1 g Tris碱,加入浓 HCl调节 pH 至 8. 0,加水定容至 1 000 mL,分装后高压灭菌。
2同工酶染色液的配制
见表B.1.
同工酶染色液的配制
Tris-HCl
乳酸锂
辅醉I (NAD)
硝基四唑蓝(NBT)
甲基盼嗪甲基硫酸盐(PMS)
0. 2 mol/L(pH8. 0)
1. 0 mol/L(pH8. 0)
10 mg/ml.
5 mg/mL
5 mg/mL
剂量/mL
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T26621—2011
日本对虾
Kuruma prawn
2011-06-16 发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-11-01实施
本标准的附录A和附录B为规范性附录。本标准由中华人民共和国农业部提出。本标准由全国水产标准化技术委员会海水养殖分技术委员会归口。本标准起草单位:中国水产科学研究院黄海水产研究所。本标准主要起草人:刘萍、李健、孔杰、刘志鸿、庄志猛、张岩、王清印。GB/T26621—2011
1范围
日本对虾
GB/T26621—2011
本标准规定了日本对虾(Marsupenaeus japonicus)的主要外部形态构造特征、生长与繁殖,遗传学特性以及检测方法。
本标准适用了日本对虾的种质检测和鉴定。2学名与分类Www.bzxZ.net
2.1学名
日本对虾Marsupenaeusjaponicus(Bate,1988)。2.2分类位置
甲壳纲(Crustacca),十足目(Decapoda),对虾科(Penaeidae),囊对虾属(Marsupenaeus)。3主要形态构造特征
3.1外部特征
日本对虾甲壳光滑无毛,体1有于几条棕色和兰色相间的横带。附肢呈黄色,尾肢后部色泽鲜艳、皇鲜兰色和黄色,边缘呈红色。额角侧沟很深,延伸至头胸甲的斥缘。额角后脊较额角侧沟宽,具中央沟。尾节背面有深的纵沟,未端尖,两侧有 3对细小活动刺。肝脊和额胃脊明显。日本对虾的外部形态见图1。
图1扫本对虾外部形态
雄虾第1腹肢的内肢变形特化交接器,呈倒钟形,中叶末端形成横圆突起折向腹面,显著超出侧叶末端,顶端稍圆,雄性交接器见图2。雄性附肢由2节构成,末端鳞片状,近乎椭圆形,长约为宽的2倍,边缘着生细端刺。
雌虾第4对和第5对步足之间基部的腹甲上,有囊状交接器为纳精,前端开口,其前方有一圆突,见图3。
GB/T 26621—20↑1
3. 2可量性状
图2日本对虾雄性交接器(2.背面;1.腹面)2 mm
图 3日本对虾雌性交接器
3.2.1第1触角柄第1节的柄刺和外缘末端刺小面尖细,内侧附肢伸至第1节末,末节约为第2节长度的1/3;第1触角触鞭很短,仅为头胸甲长的1/4,上鞭稍长于下鞭。3.2.2第2触角鳞片末缘略超出额角的末端,其触鞭长度约为体长的1.5倍。3.2.3第3颤足细长。雄性超出第1触角柄基节末端;雌性较短,不到末端,指节细小,雄性约为掌节长的1/2,雌性约为指节长的2/3。3.2.4眼胃脊明显,占自眼眶边缘至肝刺间距离的3/53.3可数性状
额角齿式:上额角齿数/下额角齿数为8~~10/1~2。2
4生长繁殖特性
4.1生长
GB/T26621—2011
由于雌雄对虾性成熟时间不同,因而雌雄对虾的生长类型显著不同。雌性、雄性本对虾在南海北部自然海区体长与体重关系式分别以式(1)和式(2)表示。W卓=6.378X10-L3.116
W=9.949X106L3.029.5
式中:
W——体重,单位为克(g);
L—体长,单位为毫米(mm)。
4.2繁殖
4.2.1生物学最小型
性成熟的最小体长为118mm,最小体重为20g。4.2.2交配与产卵
--(2)
日本对虾产卵期较长,南海北部群体2月至8月均有性成熟个体出现,产卵高峰期在2月至5月。在10月上旬至11月初雌虾最后一次蜕皮后进行交配,交配时雄虾将精英投人雌虾交接器纳精囊内,外覆翼状精英栓。婴年春季产卵,纳精囊内精子与卵子同时排出,卵粒直径0.26mm0.28mm,为沉性卵,呈灰绿色或浅褐色。受精后卵膜举起,卵膜径0.33mm~0.44mm。4.2.3怀卵量
发育成熟的亲虾在水温升至26℃左右开始产卵,为多次产卵。雌虾怀卵量2010°粒~50×10*粒。
5遗传学特性
5.1染色体数目
日本对虾的染色体数目为2n=86。5.2生化遗传学特性
5.2.1同工酶图谱
日本对虾成体肌肉中的乳酸脱氢酶(LDH)同工酶电泳图谱见图4,表现为一条酶带。图4日本对虾肌肉LDH同工酶电泳图谱5.2.2群体遗传变异范围
日本对虾平均多态位点比例为18.2%,平均杂合度的观测值为0.1042士0.0045。6检测方法
6.1染色体的检测
6.1.1染色体的制备
日本对虾胚胎或幼体放人含0.02%秋水仙素的海水中培养3h~4h。6.1.1.1
6.1.1.2移去海水,加人0.075mol/L氯化钾溶液中室温下处理20min~30min。3
GB/T 26621—2011
6.1.1.3移去低渗溶液,加入预冷的现配卡诺(Carnoy)氏固定液(甲醇:冰乙酸一3:1)固定,每隔15min更换次固定液,更换2次~3次,最后更换1:1的Carnoy氏固定液固定3omin。6.1.1.4将胚胎或幼体滴到冰冻的载玻片上,室温下干燥。6.1.1.5用磷酸缓冲液(0.1mol/L.pH7.2)将吉姆萨(Giemsa)原液稀释为4%的溶液染色15min。吉姆萨染色滋的配制见附录A。
6.1.2染色体观察
选择染色体形态好的分裂相100个计数,确定染色体数目。6.2同工酶检测
6.2.1样品的采集与保存
日本对虾成体(活体)运到实验室,保存于70℃超低温冰箱中。6.2.2样品制备
从液氮中分别取出样品(肌肉),加人5倍体积的0.1mol/L磷酸缓冲液(PBS)后冰浴勾浆,4℃离心(15 000 1/min,10 min),取上消液加人少量1%酚兰,再加入等体积的 40%蔗糖溶液。一20 ℃保存待测。
6.2.3电泳
同工酶电泳采用不连续聚丙烯酰胺凝胶垂直电泳。电泳在4℃冰箱中进行。电泳参数如下。凝胶浓度(T) : T浓缩 - 3. 0%(pH6. 7),T分离放 =7. 5%(pH8. 9)。乳酸脱氢酶染色液配方见附录B
6.2.4结果计算
多态位点比例按式(3)计算:
P.- N./N×100%
式中:
P.\多态位点比例
N,”多态位点数;
N.——观察位点总数。
平均杂合度观察值按式(4)计算:H.=HI/N
式中:
平均杂合度观察值:
观察到的杂合个体数;
观察的个体总数。
7判定规则
检测结果不符合第3章和5.1要求的,则判定为不合格项;有不合格项的样品为不合格样品:合格样品数与样品总数的比为合格率,4
A.1 Glemsa 染色液母液
附录A
(规范性附录)
吉姆萨(Giensa)染色液的配制
GB/T 26621—2011
称取0.5gGiemsa粉,量取甘油33mL,在研钵中先用少量甘油与Giemsa粉混合,研磨至无颗粒时再将剩余甘油加入:在 56 ℃条件下温浴 2 h 后,加人 33 mL甲醇,混勾。并保存于棕色瓶中备用。A,2磷酸缓种液(0.2 mol/L,pH7.2)磷酸缓冲液由A液和B液按比例混合而成。A.2. 1A 液(0.2 mol/L,Na,HPO,)取36.1磷酸氢二钠(NazHPO,.Hz0)定容于1000ml.的蒸馅水中;或取71.63g磷酸氢二钠(Na2HPO2H,0)定容于100 mL的馅水中,即可。A.2.2 B 液(0. 2 mol/L,NaH,PO,)取27.6g磷酸二氢钠(NaH,PO。·H,O)定容于1000ml.的蒸馏水中;或取31.21g磷酸二氢钠(NaH,PO·2H,O)定容于100UmL的蒸馏水中,即可。A.2.3取A液720mL、B液28mL,两者混合即可。A, 3Giemsa 染色液
取100 mL的磷酸缓冲,加人4 mLGiemsa染色原液即可。5
GB/T26621—2011
附录B
(规范性附录)
同工酶染色液及其所需溶液的配制B. 11 mol/L三羟甲基氨基甲烷-盐酸(Tris-HC1)缓冲液的配制800 mL水中加入 121,1 g Tris碱,加入浓 HCl调节 pH 至 8. 0,加水定容至 1 000 mL,分装后高压灭菌。
2同工酶染色液的配制
见表B.1.
同工酶染色液的配制
Tris-HCl
乳酸锂
辅醉I (NAD)
硝基四唑蓝(NBT)
甲基盼嗪甲基硫酸盐(PMS)
0. 2 mol/L(pH8. 0)
1. 0 mol/L(pH8. 0)
10 mg/ml.
5 mg/mL
5 mg/mL
剂量/mL
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 国家标准
- GB/T2828.1-2012 计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划
- GB/T228.1-2021 金属材料 拉伸试验 第1部分:室温试验方法
- GB/T7534-1987 工业用挥发性有机液体沸程的测定
- GB/T3836.1-2021 爆炸性环境 第1部分:设备 通用要求
- GB/T4100-2015 陶瓷砖
- GB/T10125-2021 人造气氛腐蚀试验 盐雾试验
- GB/T50772-2012 木结构工程施工规范
- GB/T30835-2014 锂离子电池用炭复合磷酸铁锂正极材料
- GB5226.1-2019 机械电气安全 机械电气设备 第1部分:通用技术条件
- GB50666-2011 混凝土结构工程施工规范
- GB/T15449-1995 管壳额定开关用场效应晶体管空白详细规范
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB8552-1987 电子器件详细规范 低功率非线绕固定电阻器 RJ13型金属膜固定电阻器评定水平E(可供认证用)
- GB/T11379-2008 金属覆盖层 工程用铬电镀层
- GB/T23892.3-2009 滑动轴承 稳态条件下流体动压可倾瓦块止推轴承 第3部分:可倾瓦块止推轴承计算的许用值
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2