- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 商检行业标准(SN) >>
- SN/T 2021-2007 牛无浆体病检疫技术规范
标准号:
SN/T 2021-2007
标准名称:
牛无浆体病检疫技术规范
标准类别:
商检行业标准(SN)
标准状态:
现行-
发布日期:
2007-12-24 -
实施日期:
2008-07-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
2.25 MB
部分标准内容:
中华人民共和国出入境检验检疫行业标准SN/T2021—2007
牛无浆体病检疫技术规范
Protocol of quarantine for bovine anaplasmosis2007-12-24发布
中华人民共和国
国家质量监督检验检疫总局bzxz.net
2008-07-01实施
规范性引用文件
诊断技术
临床症状和病理变化
病原鉴定
4.3血清学检测
附录A(资料性附录)
附录B(规范性附录)
附录C(规范性附录)
附录D(规范性附录)
牛无浆体病概述
载玻片的处理和姬姆萨染色液的配制PCR试剂的配制·
血清学试剂的配制
TYKAONIKAca-
SN/T 2021—2007
SN/T2021—2007
本标准是参照国际动物卫生组织(OIE)《ManualofDiagnostic,TestsandVaccinesforTerrestrialAnimals》(2004版)CHAPTER2.3.7BOVINEANAPLASMOSIS,结合国内外大量参考文献和标准起草单位进行的牛无浆体病诊断方法的研究成果编写的。本标准的附录B、附录C、附录D为规范性附录,附录A为资料性附录本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国上海出入境检验检疫局、中国农业科学院上海兽医研究所、华中农业大学。
本标准主要起草人:李树清、陈志飞、何国声、姚宝安、由轩、吴鉴三、王贵强、杜凯。本标准系首次发布的出入境检验检疫行业标准1范围
牛无浆体病检疫技术规范
HiiKAoNiiKAca
SN/T2021—2007
本标准规定了牛无浆体病的检疫技术规范,包括涂片镜检、聚合酶链式反应、酶联免疫吸附试验检测方法。
本标准适用于牛无浆体病的检疫。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准GB/T18651牛无浆体病快速凝集检测方法SN/T1679动物边虫病微量补体结合试验操作规程3概述
牛无浆体病(Bovineanaplasmosis)是由无浆体寄生于牛红细胞内,引起发热、贫血、黄疽和渐进性消瘦,甚至死亡的一种疾病。该病的分布、病原分类、传播媒介等参见附录A。牛无浆体病的诊断方法包括,临床症状和病理变化,病原鉴定及血清抗体检测。血清学检测方法中,补体结合试验(Complementfixationtest,CFT)和卡片凝集试验(Cardagglutinationtest,CAT)是最常用的方法。CFT使用了很多年,操作规程见SN/T1679,但最近的资料证实CFT在诊断持续感染牛时,敏感性仅20%,大部分的病原携带者不能被检测出。因此,CFT试验对单个动物的确证是不可靠的。CAT的优点是敏感、快速,既可在实验室也可以在由间进行,能在几分钟得出试验结果。假阴性率很低,但非特异反应是个问题。可作为初筛方法,操作程序见GB/T18651。竞争ELISA方法在检测感染动物,其敏感性大大增加。间接ELISA、斑点ELISA和荧光抗体试验也可用于特异的抗体检测.但间接荧光抗体试验由于一名操作人员一天检测样品数量有限,而且有非特异性的荧光反应,通常都愿选用其他血清学检测方法。
4诊断技术
4.1临床症状和病理变化
无浆体病随着动物年龄的增加而变得严重,感染牛表现为体温持续升高,达10d~21d,但很少超过41℃,并伴有贫血、虚弱和呼吸困难,特别是运动以后加剧。早期精神沉郁,食欲减退不明显,但随着病程的发展而逐渐明显。最典型的临床症状是贫血和黄疽,后者出现在疾病的后期。不会出现血红蛋白贫血和血红蛋白尿,但由于尿中出现胆色素,感染牛出现褐色尿,这一点有助于鉴别诊断无浆体病和巴贝斯虫病。这两个病经常在同一地区流行,只能通过病原鉴定进行确诊。另外,当血涂片中无浆体数量较少(如处于疾病的恢复阶段),红细胞数量和红细胞压积的降低有助于诊断无浆体的感染。边缘无浆体致病性强,爆发流行时牛的死亡率可达50%~80%。孕牛出现流产,良种奶牛的产奶量降低30%~50%,甚至停止泌乳。肉用牛体重也大量下降,使畜产品的质量和数量遭受严重损失。尸体解剖表现出贫血和消瘦,黄疽,肝、脾肿大,器官黄染,胆汁浓稠,有时心脏出血,尿液比正常暗。肝坏死也是本病的特征。中央无浆体致病性弱,牛感染后影响较小。1
SN/T2021—2007
4.2病原鉴定
4.2.1镜检鉴定病原
4.2.1.1血涂片的制备
在洁净的载玻片(载玻片处理见第B.1章)三分之一处蘸血一小滴,以一端缘光滑的载波片为推片,将推片的一端置于血滴之前,待血液沿推片端缘扩散后,自右向左推成薄血膜。理想的血膜中,红细胞呈均匀分布,空气干燥的血涂片可在室温保存至少1周。若血涂片不满意,可用抗凝血来制备。与牛巴贝斯虫不同,无浆体不积聚在毛细血管,因此,从颈静脉或其他大的血管采血较好。由于无浆体无特殊形态,要求血片质量要高,没有杂质,因碎片会引起误诊。厚的血涂片适宜诊断巴贝斯虫,不适宜无浆体,因为无浆体一旦与红细胞分离就很难鉴定。死亡动物应使用肝、肾、心、肺和外周血制备薄血片。脑涂片对牛巴贝斯虫的诊断是很有用的,对于无浆体无直接的诊断价值,但可以用于鉴别诊断。从组织收集血液用于制片比组织本身好,因显微镜下检查且标是完整红细胞中的无浆体4.2.1.2血涂片染色
血液或组织涂片,用姬姆萨染色进行镜检是最常用的鉴定无浆体方法。血液或组织涂片先用无水甲醇固定1min,用10%姬姆萨(配制方法见第B.2章)染色30min。染色后涂片用自来水冲洗3次~4次,以除去附着的染料,但不要超过5s,否则样本会脱色,然后空气干燥。4.2.1.3显微观察
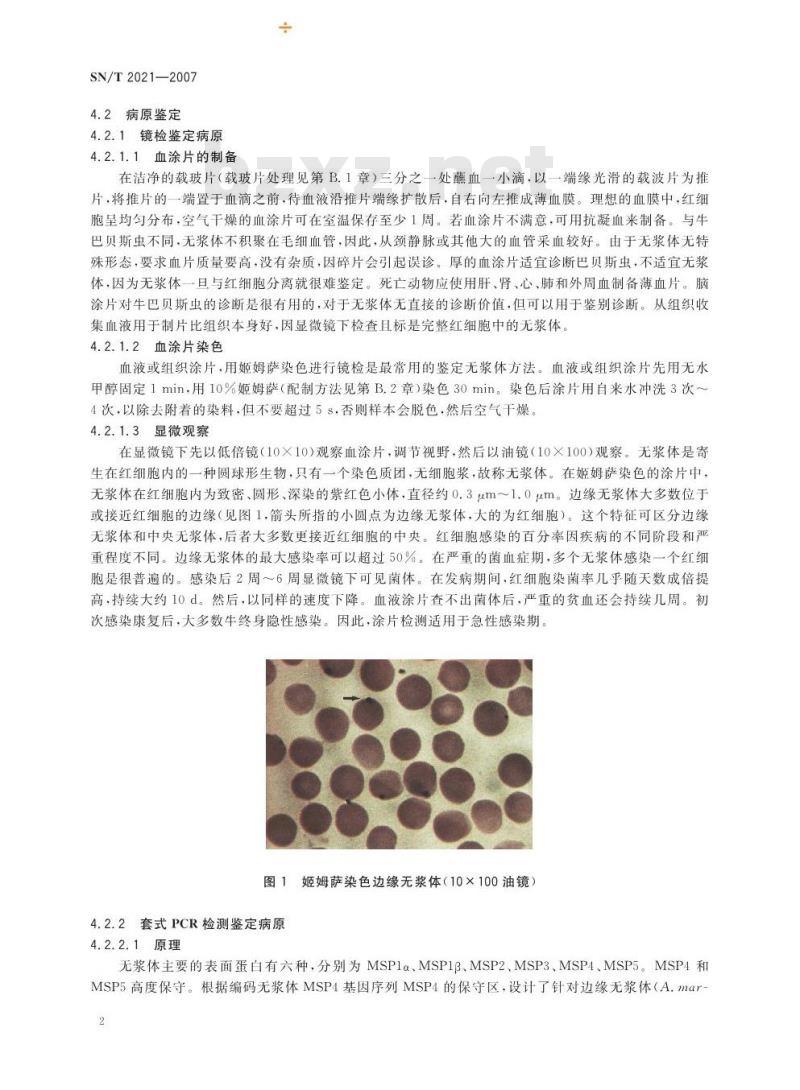
在显微镜下先以低倍镜(10×10)观察血涂片,调节视野,然后以油镜(10×100)观察。无浆体是寄生在红细胞内的一种圆球形生物,只有一个染色质团,无细胞浆,故称无浆体。在姬姆萨染色的涂片中,无浆体在红细胞内为致密、圆形、深染的紫红色小体,直径约0.3um1.0μm。边缘无浆体大多数位于或接近红细胞的边缘(见图1,箭头所指的小圆点为边缘无浆体,大的为红细胞)。这个特征可区分边缘无浆体和中央无浆体,后者大多数更接近红细胞的中央。红细胞感染的百分率因疾病的不同阶段和严重程度不同。边缘无浆体的最大感染率可以超过50%。在严重的菌血症期,多个无浆体感染一个红细胞是很普遍的。感染后2周~6周显微镜下可见菌体。在发病期间,红细胞染菌率几乎随天数成倍提高,持续大约10d。然后,以同样的速度下降。血液涂片查不出菌体后,严重的贫血还会持续儿周。初次感染康复后,大多数牛终身隐性感染。因此,涂片检测适用于急性感染期。图1姬姆萨染色边缘无浆体(10×100油镜)4.2.2套式PCR检测鉴定病原
4.2.2.1原理
无浆体主要的表面蛋白有六种,分别为MSP1α、MSP1β、MSP2、MSP3、MSP4、MSP5。MSP4和MSP5高度保守。根据编码无浆体MSP4基因序列MSP4的保守区,设计了针对边缘无浆体(A.mar2
HiiKANiKAca
SN/T2021—2007
ginale)、中央无浆体(A.centrale)和绵羊无浆体(A.ovis)三者通用的2对引物AMOC9/AMOC5和AMOC3/AMOC4,及分别针对三者的特异引物AM1/AM5、AC2/AC4和AO1/AO6。以AMOC9AMOC5为套式PCR第一轮引物,以其他为第二轮引物,分别扩增出716bp、431bp、310bp、584bp的DNA片段,用于鉴定无浆体、边缘无浆体、中央无浆体和绵羊无浆体。套式PCR检测无浆体的最低DNA量为0.2pg(相当于6个感染红细胞),可以检测出红细胞感染率为0.000001%的带菌牛。检测样品时,先用通用引物进行套式PCR反应,检测出阳性样品,然后以PCR第一轮产物为模板,用特异引物对阳性样品加以鉴别。
4.2.2.2设备和材料
4.2.2.2.1仪器设备
PCR扩增仪:
—电泳仪;
一凝胶成像系统;
微波炉;
可调移液器;
离心机;
天平;
水浴锅。
4.2.2.2.2耗材
PCR反应管;
-1.5mL离心管:
一移液器滴头。
4.2.2.2.3试剂
三蒸水0.103MPa灭菌15min;
琼脂糖;
皂素;
一漠化乙锭;
-Taq酶(5U/μL);
10XPCR反应缓冲液;
氯化镁(MgClz)25mmol/L;
1 mmol/L dNTP;
酚-三氯甲烷-异戊醇(25:24:1):分子量指示物(100bp~2000bpDNAMarker);除另有规定,所用化学试剂均为分析纯。4.2.2.2.4溶液的配制
3.8%柠檬酸钠、1.5%乙二胺四乙酸二钠(EDTA二钠)、AIsever's液、TNE、RNA酶A、10%SDS、20mg/mL蛋白酶K、70%乙醇、10mg/mL溴化乙锭(EB)、1.5%琼脂糖凝胶、6X加样缓冲液的配制见附录 C。
4.2.2.3引物
引物序列见表1。引物用灭菌三蒸水配成100μmol/L母液,一20℃冻存。使用时用灭菌三蒸水配成5μmol/L的工作液。
SN/T 2021—2007
AMOC5b
AMOC3%
AMOC4b
表1试验所用引物序列
核苷酸序列
5′-GCTCCCTACTTGTTAGTGG-3
5'-TTAGCTGAACAGGAATCTTG-3
5'-CGTAGTGGCATCTCCCATG-3
5-ACTGAGGCTTTTGCTTCTCC-3
5'-GGAGCCAGAGTGGAATTG-3
5'-GAGGCTTTTGCTTCTCCAGA-3
5'-CAAGCAGAGAGACCTCGTAT-3
5'-GGCTTTTGCTTCTCCGGG-3
5-AAGAGACTTCCTACGTCAAG-3
5'-GTGTTTATAATTTCGTCCACC-3'
a上游引物forwardprimer。
b下游引物reverseprimer。
cNucleotide location inAY786993d Nucleotide location in AY702924。eNucleotidelocationinAYo543834.2.2.4样品采集
56-749
830-8499
78-975
772-7934
358-377
769-788
206-226d
772-789d
127-147
416-436°
无菌采牛血,用3.8%柠檬酸钠或1.5%EDTA二钠抗凝作为临床检测样品。4.2.2.5样品处理
产物大小/bp
采集的血液1mL与等体积的Alsevers混合,4℃,2500×g离心20min,去上清液。以相同的条件用Alsevers液洗5次。压积细胞37℃预温10min,加人等体积37℃预温的含皂素Alsevers液,37℃孵育2min加1.2mL预冷的TNE,混匀。4℃.2500Xg离心15min去沉淀。4℃.7000Xg离心20min去上清液。沉淀溶于700LTNE中:加10%SDS35uL和10mg/mLRNA酶A7uL.37℃作用1h~2h。然后加20mg/mL蛋白酶K4uL,50℃作用2h~3h。加等体积饱和酚,混匀,4℃,12000×g离心5min;取上清液,加人等体积的酚-三氯甲烷-异戊醇(25:24:1),混勾,4℃,12000×g离心5min,取上清液,重复抽提一次;取上清液,加人等体积的三氯甲烷,混匀,4℃,12000×g离心5min。取上清液.加人2倍体积无水乙醇,冰上放置30min,4℃15000×g离心15min,弃上清液,沉淀用70%冷乙醇洗2次,空气干燥,加人50μL三蒸水溶解,一20℃保存备用。4.2.2.6PCR反应
4.2.2.6.1对照设立
阳性对照用A.marginale.A.centrale,A.ovis三种无浆体DNA(10ng~20ng)。阴性对照用健康牛血的抽提物。空白对照用无菌三蒸水。
4.2.2.6.2PCR反应体系
第一轮:总体积30uL.10XPCR反应缓冲液3uL:氯化镁(MgCl)3uL:dNTP3uL:引物AMOC9和AMOC5各1uL;样品(或对照)3μL0.2μLTaqDNA聚合酶,16μL三蒸水,第二轮:总体积30μL,10XPCR反应缓冲液3μL氯化镁(MgCl)3μL;dNTP3uL;引物AMOC3和AMOC4各1μL;样品(或对照)1μL;0.1μLTaqDNA聚合酶,18μL三蒸水。4.2.2.6.3循环参数
引物AMOC9/AMOC5用于第一轮PCR扩增,PCR反应循环参数为94℃3min;94℃30s,58℃30s.72℃1min,25个循环,最后72℃3min。HiiKANiKAca
SN/T2021—2007
引物AMOC3/AMOC4用于第二轮PCR扩增,PCR反应循环参数为94℃3min;94℃30s,58℃30s,72℃1min,35个循环;最后72℃3min。阳性样品再分别用特异引物AM1/AM5,AO1/AO6,AC2/AC4扩增其第一轮产物进行鉴别.循环参数与引物AMOC3/AMOC4进行的第二轮PCR扩增相同。4.2.2.6.4电泳
取产物10uL与2uL6×加样缓冲液混合,加样于含EB的1.5%琼脂糖凝胶中。在1XTAE缓冲液中,3V/cm~4V/cm电泳约30min,当溴酚蓝到达底部时停止电泳,用凝胶成像系统分析
阳性、阴性、空白对照和DNA分子量指示物同样电泳。4.2.2.7结果判定
4.2.2.7.1通用引物结果判定
阳性对照出现716bp的DNA片段;阴性、空白对照不出现任何DNA片段:对照成立才能进行判定;
无核酸带或带的大小不在716bp位置上的样品判为无浆体阴性:-在716bp位置上有核酸带的样品,判为无浆体阳性。阳性样品用特异性引物进行鉴定。4.2.2.7.2特异引物结果判定
阳性、阴性、空白对照成立,样品在431bP位置上有核酸带,判为边缘无浆体阳性:阳性、阴性、空白对照成立,样品在584bp位置上有核酸带,判为绵羊无浆体阳性;一阳性、阴性、空白对照成立,样品在310bp位置上有核酸带,判为中央无浆体阳性;一阳性样品进行测序,将序列与Genbank中无浆体MSP4序列进行比较确诊。4.3血清学检测
4.3.1概述
动物一旦感染无浆体,通常持续终生。然而,除了偶尔有少数再复发外,急性菌血症消失后血液涂片中检测不到无浆体。因此,一系列血清学试验可用于测定隐性感染。一般来说,动物没有进行治疗或非感染的早期阶段(感染14d以后),用ELISA或卡片凝集试验进行血清学诊断是理想的方法。需要强调的是·血清学检测中边缘无浆体和中央无浆体有高度的交叉。4.3.2设备和材料
4.3.2.1仪器设备
具有650nm、492nm波长的酶标仪;洗板机;
普通冰箱;
恒温培养箱:
多通道、单通道可调移液器。
4.3.2.2耗材
—96孔微量ELISA板;
移液器滴头。
4.3.3样品采集
被检动物无菌采血5mL,待血液凝固后,以2500×g离心10min,分离血清,血清一20℃保存备用。
SN/T2021—2007
4.3.4竞争酶联免疫吸附试验(cELISA)4.3.4.1原理
用MSP5重组抗原(rMSP5)及MSP5特异的单克隆抗体建立的cELISA方法原理是:用rMSP5包被ELISA板,加人血清样品,再加入辣根过氧化物酶标记的抗MSP5的单克隆抗体,竞争反应后再加人底物。通过测定吸光值计算样品抑制单克隆抗体与rMSP5结合的程度。颜色深表明无抑制或很少抑制,样品为阴性。无色或颜色浅表明有抑制,样品为阳性。已有商业化的试剂盒出售。4.3.4.2试剂盒组成
包被有rMSP5抗原的96孔微量板;包被有祛除血清非特异性结合的96孔吸附/转移板;10倍的浓缩洗液;
即用型酶稀释缓冲液和浓缩酶结合物;一即用型底物和终止液;
阳性对照血清和阴性对照血清。4.3.4.3试验程序
试验前,血清样品、试剂和反应板均恢复到室温;加70uL未稀释的血清样品到吸附/转移板,每个样品做一孔。同时设立两孔阳性对照,三孔阴性对照,阴性对照最好分布在不同的区域,室温孵育30 min;从吸附板吸50μL到包被有rMSP5的反应板,室温孵育60min;洗板2次;
每孔加50uL工作浓度的单克隆抗体酶结合物,室温孵育20min;洗板4次;
每孔加50uL底物,铝箔盖板,室温孵育20min;每孔加50uL终止液,轻轻混勾;在酶标仪上于650nm处读吸光值。4.3.4.4结果判定
阴性对照平均吸光值必须在0.40~2.10之间,阳性对照的抑制百分率大于或等于30%;抑制百分率按照式(1)计算:
式中:
I抑制百分率,%;
A——样品吸光值;
B一阴性对照平均吸光值。
X100%.......
样品抑制百分率小于30%的为阴性,大于或等于30%的为阳性。4.3.5间接酶联免疫吸附试验(iELISA)4.3.5.1原理
....(1)
使用正常红细胞作为阴性抗原,边缘无浆体感染红细胞作为阳性抗原。分别将阴性抗原和阳性抗原包被酶标板,加人被检血清,再加人抗牛的酶标抗体,然后加人底物。根据净吸光值判定被检血清是否含抗无浆体的抗体。净吸光值高表明抗体含量高,样品为阳性,净吸光值低表明抗体含量低,样品为阴性。
4.3.5.2试剂
阴性抗原(蛋白含量150μg/mL200μg/mL):阳性抗原(蛋白含量150μg/mL~200μg/mL);6
阳性对照血清;
阴性对照血清;
正常马血清;
酶结合物(辣根过氧化物酶标记的抗牛IgG);底物;
终止液。
4.3.5.3试验程序
HiiKANiKAca
SN/T2021—2007
取96孔微量ELISA板,每孔加200uL工作浓度抗原。奇数列加阳性抗原,偶数列加阴性抗原,封板膜封板后4℃过夜;
倒去抗原,用PBST(配制方法见附录D)洗板3次:用1%正常马血清(马血清用PBS稀释PBS配制见附录D)在37℃封闭60min;封闭后用PBST洗5次;
加200uL待检血清(用含1%马血清的PBST1:800稀释).封板37℃孵育2h;PBST洗板5次;
每孔加200uL用含1%马血清PBS1:400稀释的酶结合物,封板后37℃孵育2h;PBS洗板5次;
加200μL新配制的底物(配制方法见第D.3章),封板,置22℃轻轻地振荡30min;加50μL终止液(配制方法见第D.4章)终止反应;立即用酶标仪以492nm读板。
4.3.5.4结果判定
每个样品的阳性抗原的吸光值减去阴性抗原的吸光值为净吸光值;每批试验做20份已知的阴性血清,1份阳性血清。这20份阴性血清的平均净吸光值加2个标准差为阈值:
阳性对照血清的净吸光值应大于阈值。对照成立才能进行判定;样品净吸光值大于阈值的判为阳性,否则判为阴性。4.3.6斑点酶联免疫吸附试验(dot-ELISA)4.3.6.1原理
将抗原点于硝酸纤维素膜上,通过与相应的抗体和SPA(葡萄球菌蛋白A)标记的碱性磷酸酶的一系列免疫反应,形成酶标记抗原抗体复合物,加入底物后,结合物上的酶催化底物使其水解、氧化成另一种带色物质,沉着于抗原抗体复合物吸附的部位,呈现出肉眼可见的颜色斑点。试验结果可通过颜色斑点的出现与否和色泽深浅进行判定。4.3.6.2试剂
抗原(蛋白浓度25μg/mL);
阳性对照血清;
阴性对照血清;
碱性磷酸酶-蛋白A结合物;
一底物(硝蓝四唑/5-漠-4-氯吲哚磷酸盐)4.3.6.3试验程序
制备抗原片:取硝酸纤维膜用打孔器切成直径为6mm小圆片,点加抗原1L/圆片,空气于燥,重复3次。该膜上抗原一20℃或4℃可保存2年有效,25℃至少保存3个月;所有操作在25℃进行,用200uL反应体系;将抗原片置于平底微量反应板孔中;设立阳性、阴性血清和抗原对照;7
SN/T2021—2007
用含0.5%吐温-20PBS(PBS配制方法见第D.1章),孵育30min封闭;待检血清用含0.05%吐温-20的PBS1:200稀释,孵育1h;用含0.1%吐温-20的PBS洗3次,每次10min;加人碱性磷酸酶-蛋白A结合物(用含0.5%吐温-20PBS1:500稀释),室温孵育30min;用PBS洗涤3次,每次10min;
加人底物(配制方法见第D.5章)显色10min20min;—蒸馏水洗涤终止反应。
4.3.6.4结果判定
阳性对照血清为紫色圆点,阴性血清和抗原对照为无色圆点。对照成立才能进行判定;样品为紫色圆点判为阳性,样品为无色圆点判为阴性。o
附录A
(资料性附录)
牛无浆体病概述
HiiKAoNiiKAca
SN/T2021—2007
牛无浆体病(Bovineanaplasmosis)是由无浆体寄生于牛红细胞内,引起发热、贫血、黄疽和渐进性消瘦,甚至死亡的一种疾病。无浆体分为边缘无浆体(A.marginale)、中央无浆体(A.centrale)及绵羊无浆体(A.ouis)。在一些分离的边缘无浆体上可见附属物,这种微生物被命名为尾形无浆体(A.caudatum),但它不是一个独立的种。几乎所有爆发牛无浆体病的临床病例都是由边缘无浆体引起的。牛感染中央无浆体可产生中等程度的贫血·但田间爆发的临床病例很少。绵羊无浆体主要引起羊的无浆体病,也有从牛红细胞检测到A.ovis的报道。三种无浆体都不感染家免、海猪、小鼠、猫和狗等试验动物。无浆体在分类上属于立克次氏体目(Rickettsiales),无浆体科(Anaplasmataceae),无浆体属(Anaplasma)。遗传学上,无浆体群属于艾立希体族基因Ⅱ组。最初认为无浆体是原虫,但随后的研究表明,他们没有本属的重要特征。1957年,无浆体被划分为立克次氏体目的无浆体科。该科有4个属,分别是无浆体属、埃及小体属,血巴通氏体属和附红细胞体属。最近,建议根据16SrRNA、groesl和表面蛋白基因序列进行分类。在重组科里,无浆体科现在包括所有含α类菌体蛋白的艾立希体属、无浆体属、可体属,沃氏巴克体属和新立克次体属·并暂时保留埃及小体属。
无浆体通过节肢动物进行机械或生物传播,经胎盘垂直感染也有报道。研究发现有14种不同的螂能实验传播边缘无浆体。它们是:波斯锐缘蜱(Argaspersicus),拉合尔钝缘蜱(Ornithodoroslahorensis),环型牛蜱(Boophilusannulatus),消色牛蜱(B.decoloratus),微小牛蜱(B.microplus),白染革蜱(Dermacentoralbipictus),安氏革蜱(D.Andersoni),西方革蜱(D.occidentalis),变异革蜱(D.variabilis),凿洞璃眼蜱(Hyalommaezcavatum),葩子硬蜱(Irodesricinus),囊形扇头蜱(Rhipicephalusbursa),血红扇头蜱(R.sanguineus)和拟态扇头蜱(R.simus)。推测囊形扇头蜱、凿洞璃眼蜱、拉合尔钝缘蜱还不能完全认定是无浆体的传播媒介。另外,埃沃茨氏扇头蜱(Rhipicephalusevertsi)和赤足璃眼蜱(Hyalommarufipes)在南非已列为可试验传播媒介。雄蜱作为传播媒介尤其重要。能实验传播井不暗示着在自然传播中的作用。然而,微小牛蜱属在澳大利亚、非洲等国已证实是无浆体重要的传播媒介。有些革蜱在美国也是有效的传播媒介。实验证实,原蛇属的许多种蛇、鳞蚊属的蚊可传播该病。叮咬昆虫在自然传播无浆体的重要性还没有被证实。似乎地区与地区有很大的差异。在注射其他疫苗时,如果使用不洁针头或不是一针注射一头动物时,也可能传递边缘无浆体。未消毒的外科器械也引起相似传播。中央无浆体主要的生物传播媒介是多宿主蜱,在非洲包括拟态扇头蜱。普通牛蜱(微小牛蜱)不是传播媒介。因此,在微小牛蜱流行地区使用中央无浆体作为疫苗是恰当的,边缘无浆体主要分布于热带、亚热带国家和一些气候温和的地区。如非洲、南美洲、中美洲、北美洲、地中海沿岸、巴尔干半岛、中亚各国、印度、缅甸、东南亚地区、朝鲜半岛和澳大利亚北部均有分布。只有欧洲北部一些国家、加拿大和新西兰至今未发现有病原感染的动物。在中国主要见于广东、广西、湖南、湖北、江西、江苏、四川、云南、贵州、河南、山东、河北、上海、甘肃、北京、吉林、黑龙江、新疆等地中央无浆体于1911年首次在南非分离到,此后,澳大利亚、南美、东南亚和中东的一些国家引进中央无浆体,用于生产预防边缘无浆体的活疫苗,它为中等毒力的边缘无浆体流行区(如澳大利亚)提供部分,但足够的保护力。二次免疫接种后6周~8周产生部分免疫力,并可持续几年。中央无浆体疫苗并非完全安全,建议尽可能地限制在特牛中使用,因为非特异性的免疫反应会有降低疫苗的作用,而这种非特异的反应可能需要用四环素或咪唑苯脲进行治疗。在潮湿的热带地区,边缘无浆体似乎毒力很强,中央无浆体不能为动物提供足够的保护。北美洲不应用中央无浆体疫苗。其他免疫方法之一是使用边缘无浆体在鹿、绵羊等非牛动物进行传代减毒后制备疫苗。9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
牛无浆体病检疫技术规范
Protocol of quarantine for bovine anaplasmosis2007-12-24发布
中华人民共和国
国家质量监督检验检疫总局bzxz.net
2008-07-01实施
规范性引用文件
诊断技术
临床症状和病理变化
病原鉴定
4.3血清学检测
附录A(资料性附录)
附录B(规范性附录)
附录C(规范性附录)
附录D(规范性附录)
牛无浆体病概述
载玻片的处理和姬姆萨染色液的配制PCR试剂的配制·
血清学试剂的配制
TYKAONIKAca-
SN/T 2021—2007
SN/T2021—2007
本标准是参照国际动物卫生组织(OIE)《ManualofDiagnostic,TestsandVaccinesforTerrestrialAnimals》(2004版)CHAPTER2.3.7BOVINEANAPLASMOSIS,结合国内外大量参考文献和标准起草单位进行的牛无浆体病诊断方法的研究成果编写的。本标准的附录B、附录C、附录D为规范性附录,附录A为资料性附录本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国上海出入境检验检疫局、中国农业科学院上海兽医研究所、华中农业大学。
本标准主要起草人:李树清、陈志飞、何国声、姚宝安、由轩、吴鉴三、王贵强、杜凯。本标准系首次发布的出入境检验检疫行业标准1范围
牛无浆体病检疫技术规范
HiiKAoNiiKAca
SN/T2021—2007
本标准规定了牛无浆体病的检疫技术规范,包括涂片镜检、聚合酶链式反应、酶联免疫吸附试验检测方法。
本标准适用于牛无浆体病的检疫。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准GB/T18651牛无浆体病快速凝集检测方法SN/T1679动物边虫病微量补体结合试验操作规程3概述
牛无浆体病(Bovineanaplasmosis)是由无浆体寄生于牛红细胞内,引起发热、贫血、黄疽和渐进性消瘦,甚至死亡的一种疾病。该病的分布、病原分类、传播媒介等参见附录A。牛无浆体病的诊断方法包括,临床症状和病理变化,病原鉴定及血清抗体检测。血清学检测方法中,补体结合试验(Complementfixationtest,CFT)和卡片凝集试验(Cardagglutinationtest,CAT)是最常用的方法。CFT使用了很多年,操作规程见SN/T1679,但最近的资料证实CFT在诊断持续感染牛时,敏感性仅20%,大部分的病原携带者不能被检测出。因此,CFT试验对单个动物的确证是不可靠的。CAT的优点是敏感、快速,既可在实验室也可以在由间进行,能在几分钟得出试验结果。假阴性率很低,但非特异反应是个问题。可作为初筛方法,操作程序见GB/T18651。竞争ELISA方法在检测感染动物,其敏感性大大增加。间接ELISA、斑点ELISA和荧光抗体试验也可用于特异的抗体检测.但间接荧光抗体试验由于一名操作人员一天检测样品数量有限,而且有非特异性的荧光反应,通常都愿选用其他血清学检测方法。
4诊断技术
4.1临床症状和病理变化
无浆体病随着动物年龄的增加而变得严重,感染牛表现为体温持续升高,达10d~21d,但很少超过41℃,并伴有贫血、虚弱和呼吸困难,特别是运动以后加剧。早期精神沉郁,食欲减退不明显,但随着病程的发展而逐渐明显。最典型的临床症状是贫血和黄疽,后者出现在疾病的后期。不会出现血红蛋白贫血和血红蛋白尿,但由于尿中出现胆色素,感染牛出现褐色尿,这一点有助于鉴别诊断无浆体病和巴贝斯虫病。这两个病经常在同一地区流行,只能通过病原鉴定进行确诊。另外,当血涂片中无浆体数量较少(如处于疾病的恢复阶段),红细胞数量和红细胞压积的降低有助于诊断无浆体的感染。边缘无浆体致病性强,爆发流行时牛的死亡率可达50%~80%。孕牛出现流产,良种奶牛的产奶量降低30%~50%,甚至停止泌乳。肉用牛体重也大量下降,使畜产品的质量和数量遭受严重损失。尸体解剖表现出贫血和消瘦,黄疽,肝、脾肿大,器官黄染,胆汁浓稠,有时心脏出血,尿液比正常暗。肝坏死也是本病的特征。中央无浆体致病性弱,牛感染后影响较小。1
SN/T2021—2007
4.2病原鉴定
4.2.1镜检鉴定病原
4.2.1.1血涂片的制备
在洁净的载玻片(载玻片处理见第B.1章)三分之一处蘸血一小滴,以一端缘光滑的载波片为推片,将推片的一端置于血滴之前,待血液沿推片端缘扩散后,自右向左推成薄血膜。理想的血膜中,红细胞呈均匀分布,空气干燥的血涂片可在室温保存至少1周。若血涂片不满意,可用抗凝血来制备。与牛巴贝斯虫不同,无浆体不积聚在毛细血管,因此,从颈静脉或其他大的血管采血较好。由于无浆体无特殊形态,要求血片质量要高,没有杂质,因碎片会引起误诊。厚的血涂片适宜诊断巴贝斯虫,不适宜无浆体,因为无浆体一旦与红细胞分离就很难鉴定。死亡动物应使用肝、肾、心、肺和外周血制备薄血片。脑涂片对牛巴贝斯虫的诊断是很有用的,对于无浆体无直接的诊断价值,但可以用于鉴别诊断。从组织收集血液用于制片比组织本身好,因显微镜下检查且标是完整红细胞中的无浆体4.2.1.2血涂片染色
血液或组织涂片,用姬姆萨染色进行镜检是最常用的鉴定无浆体方法。血液或组织涂片先用无水甲醇固定1min,用10%姬姆萨(配制方法见第B.2章)染色30min。染色后涂片用自来水冲洗3次~4次,以除去附着的染料,但不要超过5s,否则样本会脱色,然后空气干燥。4.2.1.3显微观察
在显微镜下先以低倍镜(10×10)观察血涂片,调节视野,然后以油镜(10×100)观察。无浆体是寄生在红细胞内的一种圆球形生物,只有一个染色质团,无细胞浆,故称无浆体。在姬姆萨染色的涂片中,无浆体在红细胞内为致密、圆形、深染的紫红色小体,直径约0.3um1.0μm。边缘无浆体大多数位于或接近红细胞的边缘(见图1,箭头所指的小圆点为边缘无浆体,大的为红细胞)。这个特征可区分边缘无浆体和中央无浆体,后者大多数更接近红细胞的中央。红细胞感染的百分率因疾病的不同阶段和严重程度不同。边缘无浆体的最大感染率可以超过50%。在严重的菌血症期,多个无浆体感染一个红细胞是很普遍的。感染后2周~6周显微镜下可见菌体。在发病期间,红细胞染菌率几乎随天数成倍提高,持续大约10d。然后,以同样的速度下降。血液涂片查不出菌体后,严重的贫血还会持续儿周。初次感染康复后,大多数牛终身隐性感染。因此,涂片检测适用于急性感染期。图1姬姆萨染色边缘无浆体(10×100油镜)4.2.2套式PCR检测鉴定病原
4.2.2.1原理
无浆体主要的表面蛋白有六种,分别为MSP1α、MSP1β、MSP2、MSP3、MSP4、MSP5。MSP4和MSP5高度保守。根据编码无浆体MSP4基因序列MSP4的保守区,设计了针对边缘无浆体(A.mar2
HiiKANiKAca
SN/T2021—2007
ginale)、中央无浆体(A.centrale)和绵羊无浆体(A.ovis)三者通用的2对引物AMOC9/AMOC5和AMOC3/AMOC4,及分别针对三者的特异引物AM1/AM5、AC2/AC4和AO1/AO6。以AMOC9AMOC5为套式PCR第一轮引物,以其他为第二轮引物,分别扩增出716bp、431bp、310bp、584bp的DNA片段,用于鉴定无浆体、边缘无浆体、中央无浆体和绵羊无浆体。套式PCR检测无浆体的最低DNA量为0.2pg(相当于6个感染红细胞),可以检测出红细胞感染率为0.000001%的带菌牛。检测样品时,先用通用引物进行套式PCR反应,检测出阳性样品,然后以PCR第一轮产物为模板,用特异引物对阳性样品加以鉴别。
4.2.2.2设备和材料
4.2.2.2.1仪器设备
PCR扩增仪:
—电泳仪;
一凝胶成像系统;
微波炉;
可调移液器;
离心机;
天平;
水浴锅。
4.2.2.2.2耗材
PCR反应管;
-1.5mL离心管:
一移液器滴头。
4.2.2.2.3试剂
三蒸水0.103MPa灭菌15min;
琼脂糖;
皂素;
一漠化乙锭;
-Taq酶(5U/μL);
10XPCR反应缓冲液;
氯化镁(MgClz)25mmol/L;
1 mmol/L dNTP;
酚-三氯甲烷-异戊醇(25:24:1):分子量指示物(100bp~2000bpDNAMarker);除另有规定,所用化学试剂均为分析纯。4.2.2.2.4溶液的配制
3.8%柠檬酸钠、1.5%乙二胺四乙酸二钠(EDTA二钠)、AIsever's液、TNE、RNA酶A、10%SDS、20mg/mL蛋白酶K、70%乙醇、10mg/mL溴化乙锭(EB)、1.5%琼脂糖凝胶、6X加样缓冲液的配制见附录 C。
4.2.2.3引物
引物序列见表1。引物用灭菌三蒸水配成100μmol/L母液,一20℃冻存。使用时用灭菌三蒸水配成5μmol/L的工作液。
SN/T 2021—2007
AMOC5b
AMOC3%
AMOC4b
表1试验所用引物序列
核苷酸序列
5′-GCTCCCTACTTGTTAGTGG-3
5'-TTAGCTGAACAGGAATCTTG-3
5'-CGTAGTGGCATCTCCCATG-3
5-ACTGAGGCTTTTGCTTCTCC-3
5'-GGAGCCAGAGTGGAATTG-3
5'-GAGGCTTTTGCTTCTCCAGA-3
5'-CAAGCAGAGAGACCTCGTAT-3
5'-GGCTTTTGCTTCTCCGGG-3
5-AAGAGACTTCCTACGTCAAG-3
5'-GTGTTTATAATTTCGTCCACC-3'
a上游引物forwardprimer。
b下游引物reverseprimer。
cNucleotide location inAY786993d Nucleotide location in AY702924。eNucleotidelocationinAYo543834.2.2.4样品采集
56-749
830-8499
78-975
772-7934
358-377
769-788
206-226d
772-789d
127-147
416-436°
无菌采牛血,用3.8%柠檬酸钠或1.5%EDTA二钠抗凝作为临床检测样品。4.2.2.5样品处理
产物大小/bp
采集的血液1mL与等体积的Alsevers混合,4℃,2500×g离心20min,去上清液。以相同的条件用Alsevers液洗5次。压积细胞37℃预温10min,加人等体积37℃预温的含皂素Alsevers液,37℃孵育2min加1.2mL预冷的TNE,混匀。4℃.2500Xg离心15min去沉淀。4℃.7000Xg离心20min去上清液。沉淀溶于700LTNE中:加10%SDS35uL和10mg/mLRNA酶A7uL.37℃作用1h~2h。然后加20mg/mL蛋白酶K4uL,50℃作用2h~3h。加等体积饱和酚,混匀,4℃,12000×g离心5min;取上清液,加人等体积的酚-三氯甲烷-异戊醇(25:24:1),混勾,4℃,12000×g离心5min,取上清液,重复抽提一次;取上清液,加人等体积的三氯甲烷,混匀,4℃,12000×g离心5min。取上清液.加人2倍体积无水乙醇,冰上放置30min,4℃15000×g离心15min,弃上清液,沉淀用70%冷乙醇洗2次,空气干燥,加人50μL三蒸水溶解,一20℃保存备用。4.2.2.6PCR反应
4.2.2.6.1对照设立
阳性对照用A.marginale.A.centrale,A.ovis三种无浆体DNA(10ng~20ng)。阴性对照用健康牛血的抽提物。空白对照用无菌三蒸水。
4.2.2.6.2PCR反应体系
第一轮:总体积30uL.10XPCR反应缓冲液3uL:氯化镁(MgCl)3uL:dNTP3uL:引物AMOC9和AMOC5各1uL;样品(或对照)3μL0.2μLTaqDNA聚合酶,16μL三蒸水,第二轮:总体积30μL,10XPCR反应缓冲液3μL氯化镁(MgCl)3μL;dNTP3uL;引物AMOC3和AMOC4各1μL;样品(或对照)1μL;0.1μLTaqDNA聚合酶,18μL三蒸水。4.2.2.6.3循环参数
引物AMOC9/AMOC5用于第一轮PCR扩增,PCR反应循环参数为94℃3min;94℃30s,58℃30s.72℃1min,25个循环,最后72℃3min。HiiKANiKAca
SN/T2021—2007
引物AMOC3/AMOC4用于第二轮PCR扩增,PCR反应循环参数为94℃3min;94℃30s,58℃30s,72℃1min,35个循环;最后72℃3min。阳性样品再分别用特异引物AM1/AM5,AO1/AO6,AC2/AC4扩增其第一轮产物进行鉴别.循环参数与引物AMOC3/AMOC4进行的第二轮PCR扩增相同。4.2.2.6.4电泳
取产物10uL与2uL6×加样缓冲液混合,加样于含EB的1.5%琼脂糖凝胶中。在1XTAE缓冲液中,3V/cm~4V/cm电泳约30min,当溴酚蓝到达底部时停止电泳,用凝胶成像系统分析
阳性、阴性、空白对照和DNA分子量指示物同样电泳。4.2.2.7结果判定
4.2.2.7.1通用引物结果判定
阳性对照出现716bp的DNA片段;阴性、空白对照不出现任何DNA片段:对照成立才能进行判定;
无核酸带或带的大小不在716bp位置上的样品判为无浆体阴性:-在716bp位置上有核酸带的样品,判为无浆体阳性。阳性样品用特异性引物进行鉴定。4.2.2.7.2特异引物结果判定
阳性、阴性、空白对照成立,样品在431bP位置上有核酸带,判为边缘无浆体阳性:阳性、阴性、空白对照成立,样品在584bp位置上有核酸带,判为绵羊无浆体阳性;一阳性、阴性、空白对照成立,样品在310bp位置上有核酸带,判为中央无浆体阳性;一阳性样品进行测序,将序列与Genbank中无浆体MSP4序列进行比较确诊。4.3血清学检测
4.3.1概述
动物一旦感染无浆体,通常持续终生。然而,除了偶尔有少数再复发外,急性菌血症消失后血液涂片中检测不到无浆体。因此,一系列血清学试验可用于测定隐性感染。一般来说,动物没有进行治疗或非感染的早期阶段(感染14d以后),用ELISA或卡片凝集试验进行血清学诊断是理想的方法。需要强调的是·血清学检测中边缘无浆体和中央无浆体有高度的交叉。4.3.2设备和材料
4.3.2.1仪器设备
具有650nm、492nm波长的酶标仪;洗板机;
普通冰箱;
恒温培养箱:
多通道、单通道可调移液器。
4.3.2.2耗材
—96孔微量ELISA板;
移液器滴头。
4.3.3样品采集
被检动物无菌采血5mL,待血液凝固后,以2500×g离心10min,分离血清,血清一20℃保存备用。
SN/T2021—2007
4.3.4竞争酶联免疫吸附试验(cELISA)4.3.4.1原理
用MSP5重组抗原(rMSP5)及MSP5特异的单克隆抗体建立的cELISA方法原理是:用rMSP5包被ELISA板,加人血清样品,再加入辣根过氧化物酶标记的抗MSP5的单克隆抗体,竞争反应后再加人底物。通过测定吸光值计算样品抑制单克隆抗体与rMSP5结合的程度。颜色深表明无抑制或很少抑制,样品为阴性。无色或颜色浅表明有抑制,样品为阳性。已有商业化的试剂盒出售。4.3.4.2试剂盒组成
包被有rMSP5抗原的96孔微量板;包被有祛除血清非特异性结合的96孔吸附/转移板;10倍的浓缩洗液;
即用型酶稀释缓冲液和浓缩酶结合物;一即用型底物和终止液;
阳性对照血清和阴性对照血清。4.3.4.3试验程序
试验前,血清样品、试剂和反应板均恢复到室温;加70uL未稀释的血清样品到吸附/转移板,每个样品做一孔。同时设立两孔阳性对照,三孔阴性对照,阴性对照最好分布在不同的区域,室温孵育30 min;从吸附板吸50μL到包被有rMSP5的反应板,室温孵育60min;洗板2次;
每孔加50uL工作浓度的单克隆抗体酶结合物,室温孵育20min;洗板4次;
每孔加50uL底物,铝箔盖板,室温孵育20min;每孔加50uL终止液,轻轻混勾;在酶标仪上于650nm处读吸光值。4.3.4.4结果判定
阴性对照平均吸光值必须在0.40~2.10之间,阳性对照的抑制百分率大于或等于30%;抑制百分率按照式(1)计算:
式中:
I抑制百分率,%;
A——样品吸光值;
B一阴性对照平均吸光值。
X100%.......
样品抑制百分率小于30%的为阴性,大于或等于30%的为阳性。4.3.5间接酶联免疫吸附试验(iELISA)4.3.5.1原理
....(1)
使用正常红细胞作为阴性抗原,边缘无浆体感染红细胞作为阳性抗原。分别将阴性抗原和阳性抗原包被酶标板,加人被检血清,再加人抗牛的酶标抗体,然后加人底物。根据净吸光值判定被检血清是否含抗无浆体的抗体。净吸光值高表明抗体含量高,样品为阳性,净吸光值低表明抗体含量低,样品为阴性。
4.3.5.2试剂
阴性抗原(蛋白含量150μg/mL200μg/mL):阳性抗原(蛋白含量150μg/mL~200μg/mL);6
阳性对照血清;
阴性对照血清;
正常马血清;
酶结合物(辣根过氧化物酶标记的抗牛IgG);底物;
终止液。
4.3.5.3试验程序
HiiKANiKAca
SN/T2021—2007
取96孔微量ELISA板,每孔加200uL工作浓度抗原。奇数列加阳性抗原,偶数列加阴性抗原,封板膜封板后4℃过夜;
倒去抗原,用PBST(配制方法见附录D)洗板3次:用1%正常马血清(马血清用PBS稀释PBS配制见附录D)在37℃封闭60min;封闭后用PBST洗5次;
加200uL待检血清(用含1%马血清的PBST1:800稀释).封板37℃孵育2h;PBST洗板5次;
每孔加200uL用含1%马血清PBS1:400稀释的酶结合物,封板后37℃孵育2h;PBS洗板5次;
加200μL新配制的底物(配制方法见第D.3章),封板,置22℃轻轻地振荡30min;加50μL终止液(配制方法见第D.4章)终止反应;立即用酶标仪以492nm读板。
4.3.5.4结果判定
每个样品的阳性抗原的吸光值减去阴性抗原的吸光值为净吸光值;每批试验做20份已知的阴性血清,1份阳性血清。这20份阴性血清的平均净吸光值加2个标准差为阈值:
阳性对照血清的净吸光值应大于阈值。对照成立才能进行判定;样品净吸光值大于阈值的判为阳性,否则判为阴性。4.3.6斑点酶联免疫吸附试验(dot-ELISA)4.3.6.1原理
将抗原点于硝酸纤维素膜上,通过与相应的抗体和SPA(葡萄球菌蛋白A)标记的碱性磷酸酶的一系列免疫反应,形成酶标记抗原抗体复合物,加入底物后,结合物上的酶催化底物使其水解、氧化成另一种带色物质,沉着于抗原抗体复合物吸附的部位,呈现出肉眼可见的颜色斑点。试验结果可通过颜色斑点的出现与否和色泽深浅进行判定。4.3.6.2试剂
抗原(蛋白浓度25μg/mL);
阳性对照血清;
阴性对照血清;
碱性磷酸酶-蛋白A结合物;
一底物(硝蓝四唑/5-漠-4-氯吲哚磷酸盐)4.3.6.3试验程序
制备抗原片:取硝酸纤维膜用打孔器切成直径为6mm小圆片,点加抗原1L/圆片,空气于燥,重复3次。该膜上抗原一20℃或4℃可保存2年有效,25℃至少保存3个月;所有操作在25℃进行,用200uL反应体系;将抗原片置于平底微量反应板孔中;设立阳性、阴性血清和抗原对照;7
SN/T2021—2007
用含0.5%吐温-20PBS(PBS配制方法见第D.1章),孵育30min封闭;待检血清用含0.05%吐温-20的PBS1:200稀释,孵育1h;用含0.1%吐温-20的PBS洗3次,每次10min;加人碱性磷酸酶-蛋白A结合物(用含0.5%吐温-20PBS1:500稀释),室温孵育30min;用PBS洗涤3次,每次10min;
加人底物(配制方法见第D.5章)显色10min20min;—蒸馏水洗涤终止反应。
4.3.6.4结果判定
阳性对照血清为紫色圆点,阴性血清和抗原对照为无色圆点。对照成立才能进行判定;样品为紫色圆点判为阳性,样品为无色圆点判为阴性。o
附录A
(资料性附录)
牛无浆体病概述
HiiKAoNiiKAca
SN/T2021—2007
牛无浆体病(Bovineanaplasmosis)是由无浆体寄生于牛红细胞内,引起发热、贫血、黄疽和渐进性消瘦,甚至死亡的一种疾病。无浆体分为边缘无浆体(A.marginale)、中央无浆体(A.centrale)及绵羊无浆体(A.ouis)。在一些分离的边缘无浆体上可见附属物,这种微生物被命名为尾形无浆体(A.caudatum),但它不是一个独立的种。几乎所有爆发牛无浆体病的临床病例都是由边缘无浆体引起的。牛感染中央无浆体可产生中等程度的贫血·但田间爆发的临床病例很少。绵羊无浆体主要引起羊的无浆体病,也有从牛红细胞检测到A.ovis的报道。三种无浆体都不感染家免、海猪、小鼠、猫和狗等试验动物。无浆体在分类上属于立克次氏体目(Rickettsiales),无浆体科(Anaplasmataceae),无浆体属(Anaplasma)。遗传学上,无浆体群属于艾立希体族基因Ⅱ组。最初认为无浆体是原虫,但随后的研究表明,他们没有本属的重要特征。1957年,无浆体被划分为立克次氏体目的无浆体科。该科有4个属,分别是无浆体属、埃及小体属,血巴通氏体属和附红细胞体属。最近,建议根据16SrRNA、groesl和表面蛋白基因序列进行分类。在重组科里,无浆体科现在包括所有含α类菌体蛋白的艾立希体属、无浆体属、可体属,沃氏巴克体属和新立克次体属·并暂时保留埃及小体属。
无浆体通过节肢动物进行机械或生物传播,经胎盘垂直感染也有报道。研究发现有14种不同的螂能实验传播边缘无浆体。它们是:波斯锐缘蜱(Argaspersicus),拉合尔钝缘蜱(Ornithodoroslahorensis),环型牛蜱(Boophilusannulatus),消色牛蜱(B.decoloratus),微小牛蜱(B.microplus),白染革蜱(Dermacentoralbipictus),安氏革蜱(D.Andersoni),西方革蜱(D.occidentalis),变异革蜱(D.variabilis),凿洞璃眼蜱(Hyalommaezcavatum),葩子硬蜱(Irodesricinus),囊形扇头蜱(Rhipicephalusbursa),血红扇头蜱(R.sanguineus)和拟态扇头蜱(R.simus)。推测囊形扇头蜱、凿洞璃眼蜱、拉合尔钝缘蜱还不能完全认定是无浆体的传播媒介。另外,埃沃茨氏扇头蜱(Rhipicephalusevertsi)和赤足璃眼蜱(Hyalommarufipes)在南非已列为可试验传播媒介。雄蜱作为传播媒介尤其重要。能实验传播井不暗示着在自然传播中的作用。然而,微小牛蜱属在澳大利亚、非洲等国已证实是无浆体重要的传播媒介。有些革蜱在美国也是有效的传播媒介。实验证实,原蛇属的许多种蛇、鳞蚊属的蚊可传播该病。叮咬昆虫在自然传播无浆体的重要性还没有被证实。似乎地区与地区有很大的差异。在注射其他疫苗时,如果使用不洁针头或不是一针注射一头动物时,也可能传递边缘无浆体。未消毒的外科器械也引起相似传播。中央无浆体主要的生物传播媒介是多宿主蜱,在非洲包括拟态扇头蜱。普通牛蜱(微小牛蜱)不是传播媒介。因此,在微小牛蜱流行地区使用中央无浆体作为疫苗是恰当的,边缘无浆体主要分布于热带、亚热带国家和一些气候温和的地区。如非洲、南美洲、中美洲、北美洲、地中海沿岸、巴尔干半岛、中亚各国、印度、缅甸、东南亚地区、朝鲜半岛和澳大利亚北部均有分布。只有欧洲北部一些国家、加拿大和新西兰至今未发现有病原感染的动物。在中国主要见于广东、广西、湖南、湖北、江西、江苏、四川、云南、贵州、河南、山东、河北、上海、甘肃、北京、吉林、黑龙江、新疆等地中央无浆体于1911年首次在南非分离到,此后,澳大利亚、南美、东南亚和中东的一些国家引进中央无浆体,用于生产预防边缘无浆体的活疫苗,它为中等毒力的边缘无浆体流行区(如澳大利亚)提供部分,但足够的保护力。二次免疫接种后6周~8周产生部分免疫力,并可持续几年。中央无浆体疫苗并非完全安全,建议尽可能地限制在特牛中使用,因为非特异性的免疫反应会有降低疫苗的作用,而这种非特异的反应可能需要用四环素或咪唑苯脲进行治疗。在潮湿的热带地区,边缘无浆体似乎毒力很强,中央无浆体不能为动物提供足够的保护。北美洲不应用中央无浆体疫苗。其他免疫方法之一是使用边缘无浆体在鹿、绵羊等非牛动物进行传代减毒后制备疫苗。9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- 商检行业标准(SN)
- SN/T1509-2005 异尖线虫病诊断规程
- SN/T1395.2-2005 禽衣原体病琼脂免疫扩散试验操作规程
- SN/T0328-94 出口氟石中氟化钙的化学分析方法
- SN/T3079.1-2012 进出口安全技术防范产品检验规程第1部分:安全防范报警设备
- SN/T0877-2000 进出口发菜检验规程
- SN/T1083.1-2002 焦炭分析试样水分、灰分的快速测定
- SN029-93 出口水果中双甲脒残留量检验方法
- SN/T4381-2015 食品接触材料纸、再生纤维材料使用改性聚苯醚测定纸和纸板迁移物的试验方法
- SN/T1443.2-2004 食品安全管理体系 审核指南
- SN0665-1997 出口肉及肉制品中雌三醇残留量检验方法放射免疫法
- SN0530-1996 出口肉中呋喃唑酮残留量的检验方法液相色谱法
- SN/T0380-1995 出口活鱼检验规程
- SN/T0794-1999 进出口西洋参检验规程
- SN/T0772-1999 出口真空软包装云腿片检验规程
- SN/T0801.6-1999 进出口动植物油脂沉积物检验方法
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2