- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 18935-2003 口蹄疫诊断技术
标准号:
GB/T 18935-2003
标准名称:
口蹄疫诊断技术
标准类别:
国家标准(GB)
标准状态:
现行-
发布日期:
2003-01-10 -
实施日期:
2003-05-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
533.81 KB
标准ICS号:
医药卫生技术>>11.220兽医学中标分类号:
农业、林业>>畜牧>>B41动物检疫、兽医与疫病防治
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了口蹄疫病毒(foot-and-mouth disease virus,FMDV)的微量补体结合试验、食道探杯查毒试验、反转录聚合酶链反应(RT-PCR),病毒中的试验、液相阻断酶联免疫吸附试验、病毒感染相关抗原(VIA)琼脂凝胶免疫扩散(AGID)试验的技术要求。本标准所规定的试验技术适用于检测各种不同样品中的口蹄疫病毒抗原或抗体。 GB/T 18935-2003 口蹄疫诊断技术 GB/T18935-2003
部分标准内容:
ICS 11.220
中华人民共和国国家标准
GB/T18935—2003
口蹄疫诊断技术
Diagnostic techniques for foot-and-mouth disease2003-01-10发布
中华人民共和国
国家质量监督检验检疫总局
2003-05-01实施
GB/T18935---2003
口蹄疫(food-and-mouthdisease,简称FMD)是哺乳动物的---种接触烈性传染病,可引起易感偶蹄兽潜在的严重经济损失。被世界动物卫生组织【World OrganizationforAnimalHealth(英),OfficeInternational desEpizooties(法),O)IF)列为A类疾病,我国列为一类动物疫病。FMD病毒有7个血清型,分别为(、A、C、SAT1、SAT2、SAT3和Asial。本病临床上表现为口、舌、唇、鼻、蹄、乳房等部位发生水泡、破溃形成烂斑。FMD在临床上不易与其他水泡性疾病(猪水泡病、水泡性疹和水泡性口炎)区别。
本标准的诊断方法参考()IE《诊断试验和疫苗标准手册》(2000版)的推荐方法,并结合我国有关动物防疫法,以及相关政策和法规制定的。在技术上与国际先进技术保持一致。其中病毒中和试验、液相阻断-酶联免疫吸附试验是国际贸易指定试验,本标准的附录A、附录B和附录C是规范性附录。本标准由中华人民共和国农业部提出。本标准由全动物检疫标准化技术委员会归口。本标准起草单位:中国农业科学院兰州兽医研究所。本标准主要起草人:朱彩珠、卢永干。236
iikAoNiKAca
1范围
口蹄疫诊断技术
GB/T18935-2003
本标准规定了口蹄疫病毒(foot-and-mouthdiseasevirus,FMDV)的微量补体结合试验、食道探杯查毒试验、反转录-聚合酶链反应(RT-PCR),病毒中和试验、液相阻断-酶联免疫吸附试验、病毒感染相关抗原(VIA)琼脂凝胶免疫扩散(AGID)试验的技术要求。本标准所规定的试验技术适用于检测各种不同样品中的口蹄疫病毒抗原或抗体。2微量补体结合试验
2.1材料
2.1.1样品采集和抗原制备
2.1.1.1样品的采集、保存和运送的方法和要求见附录A。2.1.1.2抗原制备:在无菌室内将水泡皮或乳鼠嗣体用磷酸盐缓冲液(PBS)洗净,用灭菌滤纸吸干后称重。放在灭菌研钵中先剪碎,后加灭菌石英砂研磨。加磷酸盐缓冲液(PBS)(pH7.4)制成1:4悬液。水泡液也以PBS作1:4稀释,可与组织悬液合并。室温浸毒2h以上,或4℃冰箱过夜。3000r/min离心10min。分离出上清液;58℃水浴灭活40min。再3000r/min离心10min。取上清液为待检抗原。
2.1.2抗体
口蹄疫病毒O、A和亚洲-1型,及猪水泡病病毒(SVDV)豚鼠高免血清。2.1.3补体
健康成年公豚鼠新鲜血清。加保存液(Richardson液)后,可4℃保存6个月。使用前滴定效价。2.1.4溶血素
兔抗绵羊红细胞抗血清,使用前滴定效价。2.1.5红细胞
成年健康绵羊红血球。试验当天制备2.8%工作液和敏化红细胞。2.1.6主要仪器和器材
“U”形底96孔微量滴定板,微量可调移液器及配套尖头,转头经改装可插入微量板的离心机,光电比色计。
2.1.7缓冲液配制方法(见附录B)2.2预备试验
2.2.12.8%红细胞悬液的制备
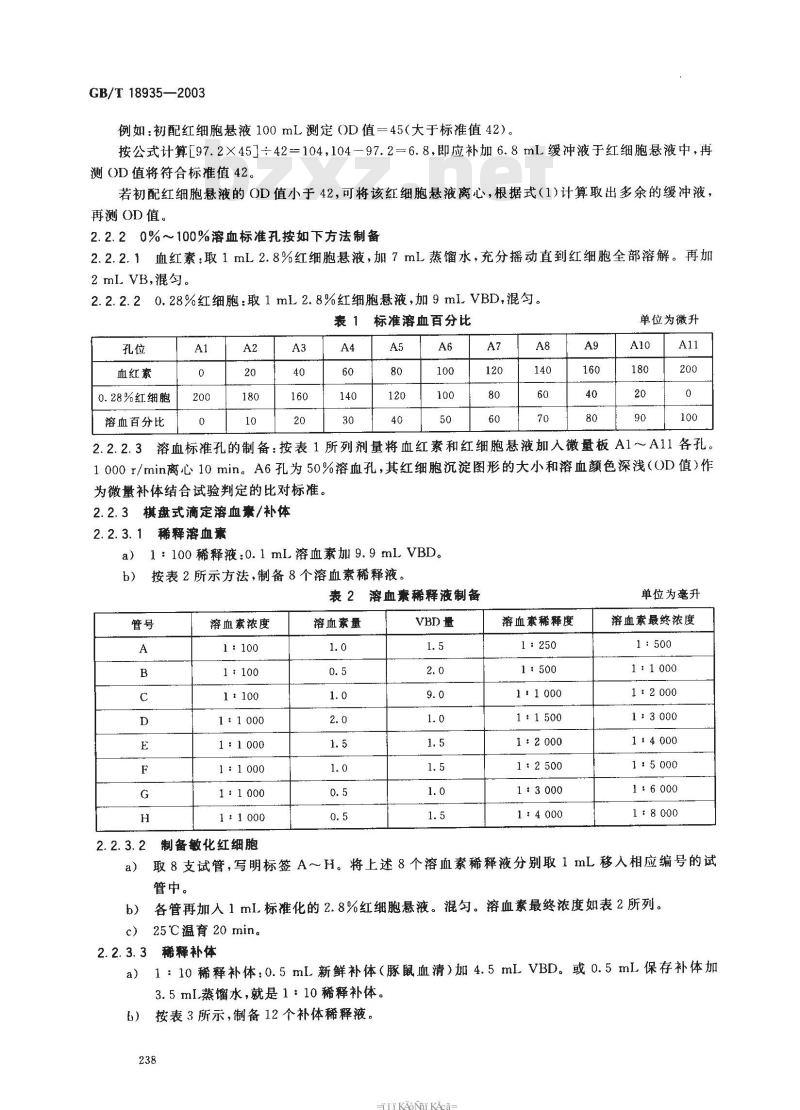
将脱纤的(绵羊)红细胞用VBD洗涤3次。每次加5倍于红细胞体积的VBD轻摇混匀,1500r/min离心10min。吸去上清液后再加人VBD,反复3次。最后吸取2.8mL红细胞泥加入盛有97.2ml.VBD的兰角瓶中,充分混匀。取0.5mL红细胞悬液,加4.5mL蒸馏水。对照管加5mL蒸馏水。用波长625nm滤光片的光电比色计测定该初配制的红细胞悬液的(0D值。按标准2.8%红细胞悬液的标准OD值=42,用式(1)校正该初配红细胞悬液的浓度。应加缓冲液的总数(mL)=初配红细胞悬液用YBD量(mL)×OD 值×( 1)标准OD值(42)
GB/T18935—2003
例如:初配红细胞悬液100mL测定OD值=45(大于标准值42)。按公式计算[97.2×45]42=104,104-97.2=6.8,即应补加6.8mL缓冲液于红细胞悬液中,再测OD值将符合标准值42。
若初配红细胞悬液的OD值小于42,可将该红细胞悬液离心,根据式(1)计算取出多余的缓冲液,再测OD值。
2.2.20%~100%溶血标准孔按如下方法制备2.2.2.1血红素:取1mL2.8%红细胞悬液,加7mL蒸馏水,充分摇动直到红细胞全部溶解。再加2 mL VB,混匀。
0.28%红细胞:取1 mL 2.8%红细胞悬液,加 9 mlVBD,混匀。2. 2. 2. 2
表1标准溶血百分比
血红素
0.28%红细胞
溶血百分比
单位为微升
2.2.2.3溶血标准孔的制备:按表1所列剂量将血红素和红细胞悬液加人微量板A1~A11各孔。1000r/min离心10min。A6孔为50%溶血孔,其红细胞沉淀图形的大小和溶血颜色深浅(OD值)作为微量补体结合试验判定的比对标准。2.2.3棋盘式滴定溶血素/补体
稀释溶血素
1:100稀释液:0.1mL溶血素加9.9mLVBD按表2所示方法,制备8个溶血素稀释液。b)
表2溶血素稀释液制备
溶血素浓度
1:100
1:100
1:1000
1:1000
1:1000
1:1000
溶血素量
VBD 量
溶血素稀释度
1:250
1:1500
1:2000
1:2500
1:3000
1:4000
单位为毫升
溶血素最终浓度
1:1000
1:2000
1:3000
1:6000
1:8000
制备敏化红细胞
取8支试管,写明标签A~H。将上述8个溶血素稀释液分别取1mL移入相应编号的试a)
管中。
各管再加入1mL标准化的2.8%红细胞悬液。混匀。溶血素最终浓度如表2所列。b
c)25℃温育20min。
2.2.3.3稀释补体
a)1:10稀释补体:0.5mL新鲜补体(豚鼠血清)加4.5mLVBD。或0.5mL保存补体加3.5mI蒸馏水,就是1:10稀释补体。按表3所示,制备12个补体稀释液6)
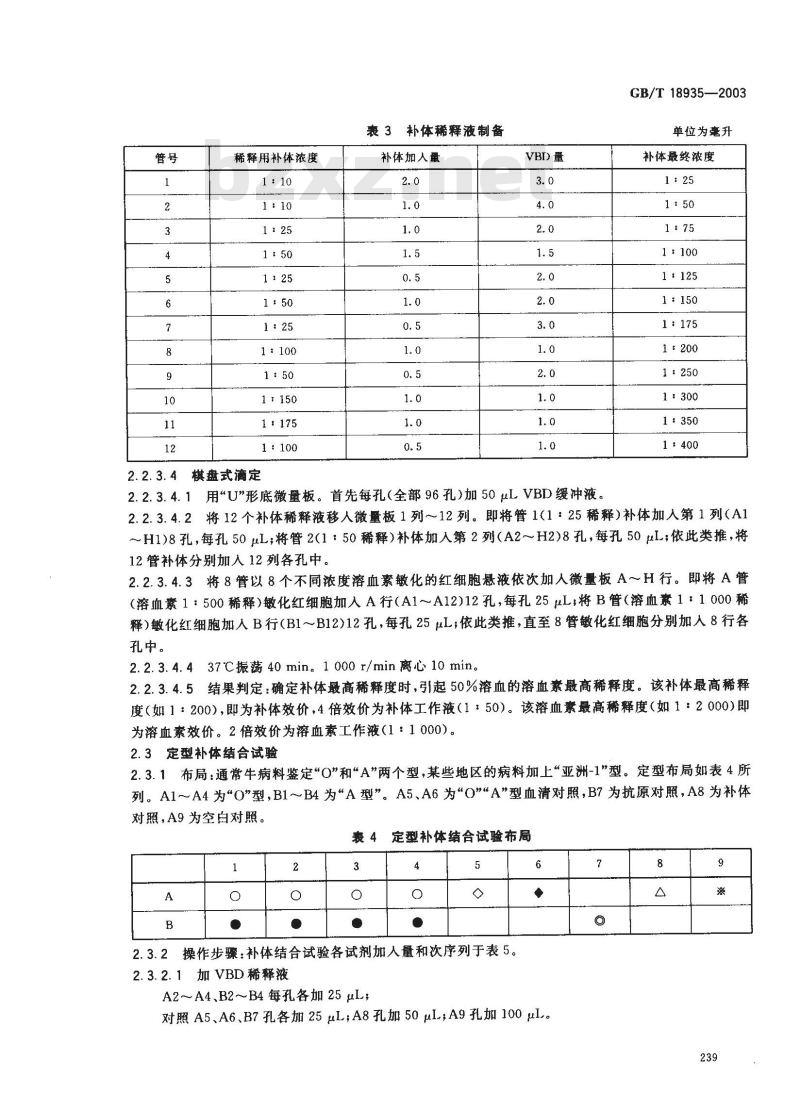
KAONrKAca-
稀释用补体浓度
1:25
1:100www.bzxz.net
1:175
1:100
棋盘式滴定
2. 2. 3. 4. 1
表3补体稀释液制备
补体加人量
VBD量
用“U”形底微量板。首先每孔(全部96孔)加50uLVBD缓冲液。GB/T18935—2003
单位为毫升
补体最终浓度
1:25
1:150
1:175
1:350
将12个补体稀释液移人微量板1列~12列。即将管1(125稀释)补体加人第1列(A12.2. 3.4.2
~H1)8孔,每孔50μL;将管2(1:50稀释)补体加人第2列(A2~H2)8孔,每孔50uL;依此类推,将12管补体分别加人12列各孔中。2. 2. 3. 4.3 将 8 管以 8 个不同浓度溶血素敏化的红细胞悬液依次加人微量板 A~H 行。即将 A 管(溶血素1:500稀释)敏化红细胞加人A行(A1~A12)12孔,每孔25μL将B管(溶血素1:1000稀释)敏化红细胞加人B行(B1~B12)12孔,每孔25μL;依此类推,直至8管敏化红细胞分别加人8行各孔中。
2.2.3.4.437℃振荡40min。1000r/min离心10min。2.2.3.4.5结果判定:确定补体最高稀释度时,引起50%溶血的溶血素最高稀释度。该补体最高稀释度(如1:200),即为补体效价,4倍效价为补体工作液(1:50)。该溶血素最高稀释度(如1:2000)即为溶血素效价。2倍效价为溶血素工作液(1:1000)。2.3定型补体结合试验
2.3.1布局:通常牛病料鉴定“O\和“A”两个型,某些地区的病料加上“亚洲-1\型。定型布局如表4所列。A1~A4为\O”型,B1~B4为“A型”。A5、A6 为\O\\A”型血清对照,B7为抗原对照,A8为补体对照,A9 为空白对照。
定型补体结合试验布局
2.3.2操作步骤:补体结合试验各试剂加人量和次序列于表5。2.3.2.1加VBD稀释液
A2~A4、B2~~B4每孔各加25μL;6
对照A5、A6、B7孔各加25μL,A8孔加50μI,A9孔加100uL。7
GB/T18935--2003
2.3.2.2加高免抗血清
a)稀释血清:将“(”“A\两型血清分别以VBD作1:8稀释。A1、A5孔加1:8\O”型血清25μL/孔,A2孔加50μL/孔。b)
B1孔加1:8\A”型血清25μL/孔,B2孔加50μL/孔。表5FMDV微量补体结合试验
血清型
血清稀释度
缓冲液
高免血清量
被检抗原
补体量
敏化红细胞
21:181:27
[1:181-27
37C振荡60 min
37℃振荡30min
++++++→+
注,“”完全溶血,“++++”完全不溶血,“++”50%溶血,“+”75%溶血。A6
单位为微升
c)从A2-A4孔作1:1.5连续稀释:用微量移液器先将A2孔中的25μLVBD和50μL血清混匀,然后吸出50μl移入A3孔,混勾后再吸出50μL移入A4孔;混匀后吸出50μL弃去。A1→A4孔的血清稀释度分别为1:8、1:12、1:18、1:27。B2→B4孔作同样连续稀释。2.3.2.3加抗原:除对照A5、A6、A8、A9孔外,各孔加待检样品25uL。2.3.2.4加补体:除空白对照A9孔外,各孔加补体工作液50μL。2.3.2.537℃振荡60min。
2.3.2.6制备敏化红细胞和加样:2.8%红细胞悬液与溶血素工作液等体积混合,25℃敏化20min。各反应孔加25uL./孔。
2.3.2.737C振荡30min,1000r/min离心30min。2.4结果判定
2.4.1试验成立的条件
当空白对照孔(A9)完全不溶血(++++);a)
补体对照孔(A8)完全溶血(一);b))
c)血清对照孔(A5和A6)和抗原对照孔(B7)完全溶血(一),试验才成立。2.4.2判定血清型
2.4.2.1若某血清型4孔完全溶血(一),或仅含最高浓度血清的第1孔,被阻止溶血不足50%,如表5所示A1~A4孔,则判定为“阴性”,即不是“O\型。2.4.2.2若某血清型4孔中3孔或4孔50%以上被阻止溶血(++、+++)或完全不溶血(++++),如表5所示B1~B4孔,则判定为阳性,即该病料为FMDV\A”型。3查毒试验
3.1样品的采集和处理
3.1.1()-P液样品的采集、保存和运送方法和要求见附录A。240
T KAONr KAca-
GB/T 18935--2003
3.1.2O-P液的处理:先将O-P液样品解冻。在无菌室内将O-P液(1份)倒人灭菌塑料离心管(100 ml.容量)内,再加人不少于该样品三分之一量(体积)的TTE(三氯三氟乙烷,分析纯)。用高速(10000r/min)组织匀浆机搅拌3min使其乳化,然后3000r/min离心10min。将上层水相分装人灭菌小瓶中,作为RT-PCR检测萃取总RNA或分离病毒(接种细胞管)的材料。3.2操作程序
3.2.1制备单层细胞
按常规法将仔猪肾(IB-RS-2)或幼仓鼠肾(BHKz)传代细胞分装在25mL培养瓶中,每瓶分装细胞悬液5ml。细胞浓度2×105/mL~3×105/mL。37℃静止培养48h。接种样品前挑选已形成单层,细胞形态正常的细胞瓶。
3.2.2样品接种
每份样品接种2瓶~4瓶细胞;另设细胞对照2瓶~4瓶。接种样品时,先倒去细胞培养瓶中的营养液,加人1mI.已经TTE处理过的O-P液,室温静置30min。然后再加4mL细胞维持液(pH7.6~7.8)。细胞对照瓶不接种样品,倒去营养液后加5ml.细胞维持液。37℃静止培养48h~~72h。3.2.3观和记录
每天观察并记录。对照细胞单层完好,细胞形态基本正常或稍有衰老,接种O-P液的细胞如出现FMDV典型CPE,及时取出并置一30℃冻存。无CPE的细胞瓶观察至72h,全部-30℃冻存,作为第1代细胞/病毒液再作盲传。
3.2.4盲传
将第1代细胞/病毒液再接种2日龄单层细胞培养物,即1mL.第1代细胞/病毒液加4mL细胞维持液。37℃静止培养48h~~72h。接种后每天观察1次~2次。对上一代出现可疑CPE的样品更要注意观察。记录病变细胞形态和单层脱落程度,及时收集细胞/病毒液以备进行诊断鉴定试验。未出现CPE的观察至72h,置30℃冻存,作为第2代细胞/病毒液,再作盲传。至少盲传3代。3.3结果判定
3.3.1以接种O-P液样品的细胞出现典型CPE为判定依据。凡出现CPE的样品判定为阳性,无CPE的为阴性。
3.3.2为了进一步确定分离病毒的血清型,将出现CPE的细胞/病毒液作间接夹心ELISA定型。或接种3日~4日龄乳鼠,视乳鼠发病及死亡时间盲传1代~3代。再以发病致死乳鼠组织为抗原材料作微量补体结合试验,鉴定病毒的血清型。4反转录-聚合酶链反应(RT-PCR)技术4.1材料
4.1.1样品的采集和处理
4.1.1.1样品的采集,保存和运送方法见附录A。4.1.1.2处理:在无菌室内将采集的动物组织,如淋巴结、脊髓、肌肉等除去被膜及其他结缔组织,尽量选取中心洁净的部分。依据检测试验的要求,将各种组织分别剪碎,用研钵加灭菌石英砂磨碎;或将组织样品分组合成大样,用组织捣碎机磨碎。然后加0.04mol/LPBS(pH7.4)制成1:5悬液。置室温(20℃左右)2h以上,或4℃冰箱过夜。3000r/min离心10min,取上清液作为检测材料。4.1.1.3阳性对照:以已知病毒材料,如FMDV感染乳鼠或细胞为阳性对照。与待检病料同时萃取总RNA,再反转录-PCR扩增。其扩增产物作为电泳对照样品。4.1.2试剂
总RNA萃取试剂盒,有商品出售。也可自行配制。包括:a)变性液:6 mol/I.异硫氰酸胍。241
GB/T 18935--2003
b)2mol/L乙酸钠(pH4.0)。
酚-三氟甲烷-异戊醇(25:24:1)混合液。d)异丙醇。
AMV反转录酶:300U/支,10U/ul。e)
f)5×RT缓冲液:500μL(1支)。g)台克(Taq)DNA聚合酶:100U/支,5U/uL。h)10XPCR缓冲液:500 μL(1支)。i)25mmol/l,氯化镁:500μL(1支)。j)dNTP:包括100 mmol/L脱氧腺苷三磷酸(dATP)、胞苷三磷酸(dTTP)、脱氧胞苷三磷酸(dCTP)、脱氧三磷酸乌苷 dGTP各 1支。用DEPC-ddH,O配制成2.5mmol/LdNTP,方法是4种脱氧核苷酸各取10uL,加人360μLDEPC双蒸水中,混匀即可。k)无水乙醇:用(焦碳酸二乙酯)DEPC-ddH,O配制成75%乙醇。1)DEPC:一种 RNA酶的强烈抑制剂。按 0.1%含量加人蒸馏水(DEPC-ddH,O),作为 RT-PCR反应用试剂。也用于浸泡移液器尖头、塑料管等接触RNA的试验器材,以减少试验过程中萃取RNA的失活和断裂。
m)矿物油。
n)引物:检测FMDV的引物对。
4.1.3专用仪器设备
台式高速(12000r/min)离心机,DNA扩增仪;稳压稳流电泳仪和水平电泳槽;电泳凝胶成相分析系统(或紫外透射仪);可调移液器-套,包括1μL20μL2支,20μL~200μL1支,200μL1000μL1支;与移液器匹配的滴头;1.5mL带盖塑料离心管(Eppendorf管)0.5mL或0.2mL(与扩增仪配套)带盖塑料管。
4.1.4电泳缓冲液
4. 1. 4. 15 × TBE缓冲液
三羟甲基氨基甲烷(Tris)
0. 5 mol/L 乙二胺四乙酸(EDTA)(pH8. 0)加双蒸水(ddH,O)至
4.1.4.21×TBE(电泳缓冲液)
1 000. 0 mL
临用时将5×TBE缓冲液1份加蒸馏水4份,混匀即可。4.1.4.3电泳加样缓冲液
溴酚蓝
双蒸水
4.2操作程序
4.2.1总RNA萃取
4.2.1.1用1.5mL带盖塑料离心管。取300μL待检样品,再加300uL变性液混匀,冰水浴5min。4.2.1.2加60μL2mol/L乙酸钠(pH4.0),混。4.2.1.3加800μL酚-三氯甲烷-异戊醇混和液,混勾,冰水浴5min。4.2.1.48000r/min离心10min。将上清液转人另一洁净管。242
HiiKAoNiKAca
4.2.1.5加800μl.异丙醇。混勾后置—80℃1h,或-30℃4h以上(或过夜)。4.2.1.612000r/min。离心10min。尽量倒干液体,留下RNA沉淀。4.2.1.7加800μl.75%乙醇。轻轻摇荡2次~3次,12000r/min离心8min。4.2.1.8倒干液体。晾干后的RNA即可用于反转录。4.2.2反转录
反应液总量20μL。向RNA沉淀管中依次加入下列反应物:模板:300uL待检样品萃取的总RNA。a)
b)引物VP1A(5 pmol/μL):5 μL。c)加DEPC-双蒸水:9 μL。
高速(10000r/min以上,下同)离心10s。70℃水浴5min,然后再加:d)5XRT缓冲液:4μL。
e)底物 dNTP(2.5 mmol/μL):1 μL。f) AMV RT酶(10 U/μL):1 μL。高速离心10s,置42℃水浴至少1h。4.2.3PCR扩增
GB/T18935—2003
反应液总量50μl。试验开始,首先将反转录产物转人PCR专用小塑料管中。然后如下操作:a)模板:反转录产物20μL。
b)引物:VP1A(12.5 pmol/μL)2 μl-,VP1B(12.5 pmol/μI)2 μL。c) DEPC-ddH,O:18. 5 μl.。
高速离心10s。沸水浴5min后,转人冰水中骤冷。然后再加:d)10XPCR缓冲液:3μL。
底物 dNTP(2.5 mmol/μL):4 μL。e)
f)TaqDNA聚合酶(5U/μL):0.5μL(高速离心10s,或不离心)。g)矿物油:40 μl。
高速离心10s。
将反应管插人扩增仪中,指令设定程序开始工作。30个循环。每个循环包括:变性94℃1min,退火55℃1min,聚合72℃1.5min。最后个循环的聚合延长为 10 min。
4.3结果分析和判定
4.3.11%琼脂糖凝胶板的制备
称取1g琼脂糖,加人100ml.1×TBE缓冲液中。加热融化后加5μL(10mg/mL)溴乙锭,混勾后倒入放置在水平台面上的凝胶盘中,胶板厚5mm左右。依据样品数选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TBE缓冲液淹没胶面。4.3.2加样
取6ul.~8μLPCR扩增产物和2μuL~3μI.加样缓冲液混勾后加人一个加样孔。每次电泳至少加1孔阳性对照的扩增产物作为对照。4.3.3电泳
电压80V~100V,或电流40mA~50mA,电泳30min~~40min。4.3.4结果观察和判定
电泳结束后,取出凝胶板置于紫外透射仪上打开紫外灯观察。如某一待检样品扩增产物的DNA带与阳性对照的带在一条直线上,即它们与加样孔的距离相同,则该样品判定为阳性。243
GB/T 18935—-2003
5病毒中和试验(VN)
5.1材料
5. 1. 1标准阳性血清
5.1.2血清样品的采集和处理
动物血清样品的采集,保存和运送方法和要求详见附录A。待检血清56℃水浴灭能30min。5.1.3病毒
口蹄疫病毒O、A、亚洲-1型及SVDV中和试验用种毒分别适应于BHK21或IB-RS-2单层细胞。收获的病毒液测定TCID5后,分成1mL装的小管,一60℃保存备用。5.1.4细胞
BHK21或IB-RS-2传代细胞。
5.1.5细胞营养液和维持液
细胞维持液:Eagle-MEM(最低限度必须氨基酸营养液)与0.5%水解乳蛋白/Earle液等量混合配成,pH7.6~~7.8。在中和试验中作稀释液用。细胞营养液:细胞维持液加10%犊牛血清(pH7.4)。培养细胞用。5.2操作程序
5.2.1稀释血清
将血清作2倍连续稀释。一般含4个稀释度(如1:4~1:32)。如有特殊需要,可作6个稀释度(1 : 4~1: 128)。
稀释方法:
a)先向96孔微量板A2~A4、B2~B4各孔加稀释液,25μL/孔。b)将1:4稀释的待检血清加人A1、B1和A2、B2孔,25μL/孔。稀释:将A2、B2孔中的稀释液和血清混匀后吸出25μL移至A2、B2孔。再混匀后吸出25uI)
移至A4、B4孔。混勾后吸出25μL弃去。5.2.2对照
a)血清对照。如A5、B5为血清对照孔,先加稀释液25μL/孔,再加1/4稀释的标准阳性血清25μL/孔(血清1/8稀释)。
b)空白对照。至少2孔,如A6、B6孔,加稀释液100μL/孔。c)细胞对照。至少2孔,如A7、B7孔,加稀释液50μL/孔。d)病毒对照。至少2孔,如A8、B8孔,加稀释液25μL/孔。5.2.3稀释病毒和加样
按TCIDs/50ul.滴定结果,稀释病毒至200TCIDso/50μL。然后加入各血清稀释度孔和病毒及阳性对照孔(A8、B8),每孔25μL。5.2.4中和作用
加盖,37℃振荡1h。
5.2.5加入细胞
将2日龄~3日龄单层丰满,形态正常的BHK21或IB-RS-2细胞按常规消化,离心(1000r/min10min)收集细胞,加细胞营养液制成1×10°/mL~2×10°%/ml细胞悬液(pH7.4)。然后加入除空白对照(A6、B6)孔外的各试验孔,每孔50uL。5.2.6加盖
37℃振荡10min。置二氧化碳培养箱37℃静止培养2d~3d。5.3结果判定
FMDV致BHK21或IB-RS-2细胞的CPE很典型,在普通显微镜下易于识别,通常在48h后用倒置244
-TKAONi KAca-
显微镜观察即可判定结果。
试验成立的条件:
a)标推阳性血清孔无CPE出现。b)细胞对照孔中细胞生长已形成单层,形态正常。c)病毒对照孔无细胞生长,或有少量病变细胞存留。血清中和滴度为1:45或更高者判为阳性。GB/T18935—2003
血清中和滴度为1:16~1:32判为可疑,需进一步采样作试验,如第二次血清滴度1:6或高于1:16判为阳性。
斑清中和滴度为1:8判为阴性。6液相阻断-酶联免疫吸附试验(LpB-ELISA)6.1材料
6.1.1样品采集见附录A,所需试剂见附录C。6.1.2捕获抗体:用FMD病毒7个血清型146S抗原的兔抗血清,将该血清用pH9.6碳酸盐/重碳酸盐缓冲液稀释成最适浓度。
6.1.3抗原:用BHD-21细胞培养增殖FMD毒株制备,并进行预滴定,以达到某一稀释度,加人等体积稀释剂后,滴定曲线上线大约1.5,稀释剂为含0.05%吐温-20、酚红指示剂的PBS(PBST)。6.1.4检测抗体:豚鼠抗FMDV146S血清,预先用NBS(正常牛血清)阻断,稀释剂为含0.05%吐温-20、5%脱脂奶的PBS(PBSTM)。将该检测抗体稀释成最适浓度。6.1.5酶结合物:兔抗豚鼠Ig-辣根过氧化物酶(HRP)结合物,用NBS阻断,用PBSTM稀释成最适浓度。
6.2试验程序
6.2.1包被:ELISA板每孔用50μL免抗病毒血清包被,室温下置湿盒过夜。6.2.2洗涤:用PBS液洗板5次。
6.2.3加被检血清,在另一酶标板中加人50μL被检血清(每份血清重复做2次),2倍连续稀释起始为1:4。
6.2.4加抗原:向6.2.3酶标板中加抗原,每孔内加入相应的同型病毒抗原50μL,混合过置4℃过夜,或在37℃孵育1h,加人抗原后使血清的起始稀释度为18。6.2.5将50μuI.的血清/抗原混合物转移到兔血清包被的ELISA板中,置37C孵育1h。6.2.6洗板同6.2.3。
6.2.7每孔滴加50±1.前一步使用的同型病毒抗原的豚鼠抗血清,置37℃孵育1h。6.2.8洗板:每孔加50μl.酶结合物,置37℃孵育1h。6.2.9再洗板:每孔加50μL含0.05%H02(3%质量浓度)的邻苯二胺。6.2.10加50ul1.25mol/L硫酸中止反应,15min后,将板置于分光光度计上,在492nm波长条件下读取光吸收值。
6.2.11每次试验时,设立强阳性、弱阳性和132牛标准血清以及没有血清的稀释剂抗原对照孔,阴性血清对照孔。
6.3结果判定
抗体滴度以50%终滴度表示,即该稀释度50%孔的抑制率大于抗原对照孔抑制率均数的50%。滴度大于1:40为阳性,滴度接近1:40应用病毒中和试验重检。245
GB/T 18935--2003
7病毒感染相关(VIA)抗原琼脂凝胶免疫扩散试验(VIA-AGID)7.1材料
7.1.1血清样品的采集和处理见附录A。7.1.2 VIA抗原。
7.1.3VIA抗体阳性(对照)血清。7.1.4缓冲液
0.02 mol/L, Tris-0.15 mol/1.氯化钠Tris
氯化钠(NaCI)
蒸馏水
1000.0mL用浓盐酸调整pH为7.6。7.1.5模板:用有机玻璃板制作。本试验设计了两种不同孔数的模板(图1和图2所示)。I型由1个中央孔和6个均匀分布的周边孔组成,孔径和孔间距均为4mm。ⅡI型为适应大批量检测需要设计的,由4组I型模板组成。
①②?4
一抗原孔;
③—阳性对照孔:
一特检样品孔
图1 I型模板
7.1.6打孔器:与模板配套制作的,外径为4mm的不锈钢管。7.1.7平Ⅲ:常用直径6cm的平皿,要求底面平整光滑。7.2试验操作
@②?④
●抗原孔;
阳性对照孔:
①—待检样品孔
图2Ⅱ型模板
7.2.1琼脂糖凝胶板的制备
称取1.0g琼脂糖(电泳用),置于150mL容量的三角烧瓶中,再加人100ml缓冲液。将三角烧瓶置于磁力搅拌器上,边搅拌边加热至沸腾使琼脂糖完全熔化。将熔化的琼脂糖溶液注人平血中,每个平血加8mL,凝胶板厚约3mm。待自然冷却凝固后,盖好平Ⅲ后倒置放在湿盒中,4℃冰箱保存。7.2.2打孔
按检测样品的数量选用模板。揭开平皿,将模板放在凝胶板上方,打孔器垂直插入模板孔中并穿透凝胶直至底面。打完孔后拿开模板,用细针头轻轻挑出孔中的凝胶块,将平皿底部在酒精灯上略烤封底。
7.2.3加样
用微量移液器每孔加样20uL。抗原孔(中央孔)加VIA抗原;对照孔(I型中央孔左、右侧的2个周边孔,Ⅱ型2个中央孔之间的孔)加VIA阳性对照血清,其余各孔(1型4孔/板,Ⅱ型20孔/板)加待246
T KAONr KAca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T18935—2003
口蹄疫诊断技术
Diagnostic techniques for foot-and-mouth disease2003-01-10发布
中华人民共和国
国家质量监督检验检疫总局
2003-05-01实施
GB/T18935---2003
口蹄疫(food-and-mouthdisease,简称FMD)是哺乳动物的---种接触烈性传染病,可引起易感偶蹄兽潜在的严重经济损失。被世界动物卫生组织【World OrganizationforAnimalHealth(英),OfficeInternational desEpizooties(法),O)IF)列为A类疾病,我国列为一类动物疫病。FMD病毒有7个血清型,分别为(、A、C、SAT1、SAT2、SAT3和Asial。本病临床上表现为口、舌、唇、鼻、蹄、乳房等部位发生水泡、破溃形成烂斑。FMD在临床上不易与其他水泡性疾病(猪水泡病、水泡性疹和水泡性口炎)区别。
本标准的诊断方法参考()IE《诊断试验和疫苗标准手册》(2000版)的推荐方法,并结合我国有关动物防疫法,以及相关政策和法规制定的。在技术上与国际先进技术保持一致。其中病毒中和试验、液相阻断-酶联免疫吸附试验是国际贸易指定试验,本标准的附录A、附录B和附录C是规范性附录。本标准由中华人民共和国农业部提出。本标准由全动物检疫标准化技术委员会归口。本标准起草单位:中国农业科学院兰州兽医研究所。本标准主要起草人:朱彩珠、卢永干。236
iikAoNiKAca
1范围
口蹄疫诊断技术
GB/T18935-2003
本标准规定了口蹄疫病毒(foot-and-mouthdiseasevirus,FMDV)的微量补体结合试验、食道探杯查毒试验、反转录-聚合酶链反应(RT-PCR),病毒中和试验、液相阻断-酶联免疫吸附试验、病毒感染相关抗原(VIA)琼脂凝胶免疫扩散(AGID)试验的技术要求。本标准所规定的试验技术适用于检测各种不同样品中的口蹄疫病毒抗原或抗体。2微量补体结合试验
2.1材料
2.1.1样品采集和抗原制备
2.1.1.1样品的采集、保存和运送的方法和要求见附录A。2.1.1.2抗原制备:在无菌室内将水泡皮或乳鼠嗣体用磷酸盐缓冲液(PBS)洗净,用灭菌滤纸吸干后称重。放在灭菌研钵中先剪碎,后加灭菌石英砂研磨。加磷酸盐缓冲液(PBS)(pH7.4)制成1:4悬液。水泡液也以PBS作1:4稀释,可与组织悬液合并。室温浸毒2h以上,或4℃冰箱过夜。3000r/min离心10min。分离出上清液;58℃水浴灭活40min。再3000r/min离心10min。取上清液为待检抗原。
2.1.2抗体
口蹄疫病毒O、A和亚洲-1型,及猪水泡病病毒(SVDV)豚鼠高免血清。2.1.3补体
健康成年公豚鼠新鲜血清。加保存液(Richardson液)后,可4℃保存6个月。使用前滴定效价。2.1.4溶血素
兔抗绵羊红细胞抗血清,使用前滴定效价。2.1.5红细胞
成年健康绵羊红血球。试验当天制备2.8%工作液和敏化红细胞。2.1.6主要仪器和器材
“U”形底96孔微量滴定板,微量可调移液器及配套尖头,转头经改装可插入微量板的离心机,光电比色计。
2.1.7缓冲液配制方法(见附录B)2.2预备试验
2.2.12.8%红细胞悬液的制备
将脱纤的(绵羊)红细胞用VBD洗涤3次。每次加5倍于红细胞体积的VBD轻摇混匀,1500r/min离心10min。吸去上清液后再加人VBD,反复3次。最后吸取2.8mL红细胞泥加入盛有97.2ml.VBD的兰角瓶中,充分混匀。取0.5mL红细胞悬液,加4.5mL蒸馏水。对照管加5mL蒸馏水。用波长625nm滤光片的光电比色计测定该初配制的红细胞悬液的(0D值。按标准2.8%红细胞悬液的标准OD值=42,用式(1)校正该初配红细胞悬液的浓度。应加缓冲液的总数(mL)=初配红细胞悬液用YBD量(mL)×OD 值×( 1)标准OD值(42)
GB/T18935—2003
例如:初配红细胞悬液100mL测定OD值=45(大于标准值42)。按公式计算[97.2×45]42=104,104-97.2=6.8,即应补加6.8mL缓冲液于红细胞悬液中,再测OD值将符合标准值42。
若初配红细胞悬液的OD值小于42,可将该红细胞悬液离心,根据式(1)计算取出多余的缓冲液,再测OD值。
2.2.20%~100%溶血标准孔按如下方法制备2.2.2.1血红素:取1mL2.8%红细胞悬液,加7mL蒸馏水,充分摇动直到红细胞全部溶解。再加2 mL VB,混匀。
0.28%红细胞:取1 mL 2.8%红细胞悬液,加 9 mlVBD,混匀。2. 2. 2. 2
表1标准溶血百分比
血红素
0.28%红细胞
溶血百分比
单位为微升
2.2.2.3溶血标准孔的制备:按表1所列剂量将血红素和红细胞悬液加人微量板A1~A11各孔。1000r/min离心10min。A6孔为50%溶血孔,其红细胞沉淀图形的大小和溶血颜色深浅(OD值)作为微量补体结合试验判定的比对标准。2.2.3棋盘式滴定溶血素/补体
稀释溶血素
1:100稀释液:0.1mL溶血素加9.9mLVBD按表2所示方法,制备8个溶血素稀释液。b)
表2溶血素稀释液制备
溶血素浓度
1:100
1:100
1:1000
1:1000
1:1000
1:1000
溶血素量
VBD 量
溶血素稀释度
1:250
1:1500
1:2000
1:2500
1:3000
1:4000
单位为毫升
溶血素最终浓度
1:1000
1:2000
1:3000
1:6000
1:8000
制备敏化红细胞
取8支试管,写明标签A~H。将上述8个溶血素稀释液分别取1mL移入相应编号的试a)
管中。
各管再加入1mL标准化的2.8%红细胞悬液。混匀。溶血素最终浓度如表2所列。b
c)25℃温育20min。
2.2.3.3稀释补体
a)1:10稀释补体:0.5mL新鲜补体(豚鼠血清)加4.5mLVBD。或0.5mL保存补体加3.5mI蒸馏水,就是1:10稀释补体。按表3所示,制备12个补体稀释液6)
KAONrKAca-
稀释用补体浓度
1:25
1:100www.bzxz.net
1:175
1:100
棋盘式滴定
2. 2. 3. 4. 1
表3补体稀释液制备
补体加人量
VBD量
用“U”形底微量板。首先每孔(全部96孔)加50uLVBD缓冲液。GB/T18935—2003
单位为毫升
补体最终浓度
1:25
1:150
1:175
1:350
将12个补体稀释液移人微量板1列~12列。即将管1(125稀释)补体加人第1列(A12.2. 3.4.2
~H1)8孔,每孔50μL;将管2(1:50稀释)补体加人第2列(A2~H2)8孔,每孔50uL;依此类推,将12管补体分别加人12列各孔中。2. 2. 3. 4.3 将 8 管以 8 个不同浓度溶血素敏化的红细胞悬液依次加人微量板 A~H 行。即将 A 管(溶血素1:500稀释)敏化红细胞加人A行(A1~A12)12孔,每孔25μL将B管(溶血素1:1000稀释)敏化红细胞加人B行(B1~B12)12孔,每孔25μL;依此类推,直至8管敏化红细胞分别加人8行各孔中。
2.2.3.4.437℃振荡40min。1000r/min离心10min。2.2.3.4.5结果判定:确定补体最高稀释度时,引起50%溶血的溶血素最高稀释度。该补体最高稀释度(如1:200),即为补体效价,4倍效价为补体工作液(1:50)。该溶血素最高稀释度(如1:2000)即为溶血素效价。2倍效价为溶血素工作液(1:1000)。2.3定型补体结合试验
2.3.1布局:通常牛病料鉴定“O\和“A”两个型,某些地区的病料加上“亚洲-1\型。定型布局如表4所列。A1~A4为\O”型,B1~B4为“A型”。A5、A6 为\O\\A”型血清对照,B7为抗原对照,A8为补体对照,A9 为空白对照。
定型补体结合试验布局
2.3.2操作步骤:补体结合试验各试剂加人量和次序列于表5。2.3.2.1加VBD稀释液
A2~A4、B2~~B4每孔各加25μL;6
对照A5、A6、B7孔各加25μL,A8孔加50μI,A9孔加100uL。7
GB/T18935--2003
2.3.2.2加高免抗血清
a)稀释血清:将“(”“A\两型血清分别以VBD作1:8稀释。A1、A5孔加1:8\O”型血清25μL/孔,A2孔加50μL/孔。b)
B1孔加1:8\A”型血清25μL/孔,B2孔加50μL/孔。表5FMDV微量补体结合试验
血清型
血清稀释度
缓冲液
高免血清量
被检抗原
补体量
敏化红细胞
21:181:27
[1:181-27
37C振荡60 min
37℃振荡30min
++++++→+
注,“”完全溶血,“++++”完全不溶血,“++”50%溶血,“+”75%溶血。A6
单位为微升
c)从A2-A4孔作1:1.5连续稀释:用微量移液器先将A2孔中的25μLVBD和50μL血清混匀,然后吸出50μl移入A3孔,混勾后再吸出50μL移入A4孔;混匀后吸出50μL弃去。A1→A4孔的血清稀释度分别为1:8、1:12、1:18、1:27。B2→B4孔作同样连续稀释。2.3.2.3加抗原:除对照A5、A6、A8、A9孔外,各孔加待检样品25uL。2.3.2.4加补体:除空白对照A9孔外,各孔加补体工作液50μL。2.3.2.537℃振荡60min。
2.3.2.6制备敏化红细胞和加样:2.8%红细胞悬液与溶血素工作液等体积混合,25℃敏化20min。各反应孔加25uL./孔。
2.3.2.737C振荡30min,1000r/min离心30min。2.4结果判定
2.4.1试验成立的条件
当空白对照孔(A9)完全不溶血(++++);a)
补体对照孔(A8)完全溶血(一);b))
c)血清对照孔(A5和A6)和抗原对照孔(B7)完全溶血(一),试验才成立。2.4.2判定血清型
2.4.2.1若某血清型4孔完全溶血(一),或仅含最高浓度血清的第1孔,被阻止溶血不足50%,如表5所示A1~A4孔,则判定为“阴性”,即不是“O\型。2.4.2.2若某血清型4孔中3孔或4孔50%以上被阻止溶血(++、+++)或完全不溶血(++++),如表5所示B1~B4孔,则判定为阳性,即该病料为FMDV\A”型。3查毒试验
3.1样品的采集和处理
3.1.1()-P液样品的采集、保存和运送方法和要求见附录A。240
T KAONr KAca-
GB/T 18935--2003
3.1.2O-P液的处理:先将O-P液样品解冻。在无菌室内将O-P液(1份)倒人灭菌塑料离心管(100 ml.容量)内,再加人不少于该样品三分之一量(体积)的TTE(三氯三氟乙烷,分析纯)。用高速(10000r/min)组织匀浆机搅拌3min使其乳化,然后3000r/min离心10min。将上层水相分装人灭菌小瓶中,作为RT-PCR检测萃取总RNA或分离病毒(接种细胞管)的材料。3.2操作程序
3.2.1制备单层细胞
按常规法将仔猪肾(IB-RS-2)或幼仓鼠肾(BHKz)传代细胞分装在25mL培养瓶中,每瓶分装细胞悬液5ml。细胞浓度2×105/mL~3×105/mL。37℃静止培养48h。接种样品前挑选已形成单层,细胞形态正常的细胞瓶。
3.2.2样品接种
每份样品接种2瓶~4瓶细胞;另设细胞对照2瓶~4瓶。接种样品时,先倒去细胞培养瓶中的营养液,加人1mI.已经TTE处理过的O-P液,室温静置30min。然后再加4mL细胞维持液(pH7.6~7.8)。细胞对照瓶不接种样品,倒去营养液后加5ml.细胞维持液。37℃静止培养48h~~72h。3.2.3观和记录
每天观察并记录。对照细胞单层完好,细胞形态基本正常或稍有衰老,接种O-P液的细胞如出现FMDV典型CPE,及时取出并置一30℃冻存。无CPE的细胞瓶观察至72h,全部-30℃冻存,作为第1代细胞/病毒液再作盲传。
3.2.4盲传
将第1代细胞/病毒液再接种2日龄单层细胞培养物,即1mL.第1代细胞/病毒液加4mL细胞维持液。37℃静止培养48h~~72h。接种后每天观察1次~2次。对上一代出现可疑CPE的样品更要注意观察。记录病变细胞形态和单层脱落程度,及时收集细胞/病毒液以备进行诊断鉴定试验。未出现CPE的观察至72h,置30℃冻存,作为第2代细胞/病毒液,再作盲传。至少盲传3代。3.3结果判定
3.3.1以接种O-P液样品的细胞出现典型CPE为判定依据。凡出现CPE的样品判定为阳性,无CPE的为阴性。
3.3.2为了进一步确定分离病毒的血清型,将出现CPE的细胞/病毒液作间接夹心ELISA定型。或接种3日~4日龄乳鼠,视乳鼠发病及死亡时间盲传1代~3代。再以发病致死乳鼠组织为抗原材料作微量补体结合试验,鉴定病毒的血清型。4反转录-聚合酶链反应(RT-PCR)技术4.1材料
4.1.1样品的采集和处理
4.1.1.1样品的采集,保存和运送方法见附录A。4.1.1.2处理:在无菌室内将采集的动物组织,如淋巴结、脊髓、肌肉等除去被膜及其他结缔组织,尽量选取中心洁净的部分。依据检测试验的要求,将各种组织分别剪碎,用研钵加灭菌石英砂磨碎;或将组织样品分组合成大样,用组织捣碎机磨碎。然后加0.04mol/LPBS(pH7.4)制成1:5悬液。置室温(20℃左右)2h以上,或4℃冰箱过夜。3000r/min离心10min,取上清液作为检测材料。4.1.1.3阳性对照:以已知病毒材料,如FMDV感染乳鼠或细胞为阳性对照。与待检病料同时萃取总RNA,再反转录-PCR扩增。其扩增产物作为电泳对照样品。4.1.2试剂
总RNA萃取试剂盒,有商品出售。也可自行配制。包括:a)变性液:6 mol/I.异硫氰酸胍。241
GB/T 18935--2003
b)2mol/L乙酸钠(pH4.0)。
酚-三氟甲烷-异戊醇(25:24:1)混合液。d)异丙醇。
AMV反转录酶:300U/支,10U/ul。e)
f)5×RT缓冲液:500μL(1支)。g)台克(Taq)DNA聚合酶:100U/支,5U/uL。h)10XPCR缓冲液:500 μL(1支)。i)25mmol/l,氯化镁:500μL(1支)。j)dNTP:包括100 mmol/L脱氧腺苷三磷酸(dATP)、胞苷三磷酸(dTTP)、脱氧胞苷三磷酸(dCTP)、脱氧三磷酸乌苷 dGTP各 1支。用DEPC-ddH,O配制成2.5mmol/LdNTP,方法是4种脱氧核苷酸各取10uL,加人360μLDEPC双蒸水中,混匀即可。k)无水乙醇:用(焦碳酸二乙酯)DEPC-ddH,O配制成75%乙醇。1)DEPC:一种 RNA酶的强烈抑制剂。按 0.1%含量加人蒸馏水(DEPC-ddH,O),作为 RT-PCR反应用试剂。也用于浸泡移液器尖头、塑料管等接触RNA的试验器材,以减少试验过程中萃取RNA的失活和断裂。
m)矿物油。
n)引物:检测FMDV的引物对。
4.1.3专用仪器设备
台式高速(12000r/min)离心机,DNA扩增仪;稳压稳流电泳仪和水平电泳槽;电泳凝胶成相分析系统(或紫外透射仪);可调移液器-套,包括1μL20μL2支,20μL~200μL1支,200μL1000μL1支;与移液器匹配的滴头;1.5mL带盖塑料离心管(Eppendorf管)0.5mL或0.2mL(与扩增仪配套)带盖塑料管。
4.1.4电泳缓冲液
4. 1. 4. 15 × TBE缓冲液
三羟甲基氨基甲烷(Tris)
0. 5 mol/L 乙二胺四乙酸(EDTA)(pH8. 0)加双蒸水(ddH,O)至
4.1.4.21×TBE(电泳缓冲液)
1 000. 0 mL
临用时将5×TBE缓冲液1份加蒸馏水4份,混匀即可。4.1.4.3电泳加样缓冲液
溴酚蓝
双蒸水
4.2操作程序
4.2.1总RNA萃取
4.2.1.1用1.5mL带盖塑料离心管。取300μL待检样品,再加300uL变性液混匀,冰水浴5min。4.2.1.2加60μL2mol/L乙酸钠(pH4.0),混。4.2.1.3加800μL酚-三氯甲烷-异戊醇混和液,混勾,冰水浴5min。4.2.1.48000r/min离心10min。将上清液转人另一洁净管。242
HiiKAoNiKAca
4.2.1.5加800μl.异丙醇。混勾后置—80℃1h,或-30℃4h以上(或过夜)。4.2.1.612000r/min。离心10min。尽量倒干液体,留下RNA沉淀。4.2.1.7加800μl.75%乙醇。轻轻摇荡2次~3次,12000r/min离心8min。4.2.1.8倒干液体。晾干后的RNA即可用于反转录。4.2.2反转录
反应液总量20μL。向RNA沉淀管中依次加入下列反应物:模板:300uL待检样品萃取的总RNA。a)
b)引物VP1A(5 pmol/μL):5 μL。c)加DEPC-双蒸水:9 μL。
高速(10000r/min以上,下同)离心10s。70℃水浴5min,然后再加:d)5XRT缓冲液:4μL。
e)底物 dNTP(2.5 mmol/μL):1 μL。f) AMV RT酶(10 U/μL):1 μL。高速离心10s,置42℃水浴至少1h。4.2.3PCR扩增
GB/T18935—2003
反应液总量50μl。试验开始,首先将反转录产物转人PCR专用小塑料管中。然后如下操作:a)模板:反转录产物20μL。
b)引物:VP1A(12.5 pmol/μL)2 μl-,VP1B(12.5 pmol/μI)2 μL。c) DEPC-ddH,O:18. 5 μl.。
高速离心10s。沸水浴5min后,转人冰水中骤冷。然后再加:d)10XPCR缓冲液:3μL。
底物 dNTP(2.5 mmol/μL):4 μL。e)
f)TaqDNA聚合酶(5U/μL):0.5μL(高速离心10s,或不离心)。g)矿物油:40 μl。
高速离心10s。
将反应管插人扩增仪中,指令设定程序开始工作。30个循环。每个循环包括:变性94℃1min,退火55℃1min,聚合72℃1.5min。最后个循环的聚合延长为 10 min。
4.3结果分析和判定
4.3.11%琼脂糖凝胶板的制备
称取1g琼脂糖,加人100ml.1×TBE缓冲液中。加热融化后加5μL(10mg/mL)溴乙锭,混勾后倒入放置在水平台面上的凝胶盘中,胶板厚5mm左右。依据样品数选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TBE缓冲液淹没胶面。4.3.2加样
取6ul.~8μLPCR扩增产物和2μuL~3μI.加样缓冲液混勾后加人一个加样孔。每次电泳至少加1孔阳性对照的扩增产物作为对照。4.3.3电泳
电压80V~100V,或电流40mA~50mA,电泳30min~~40min。4.3.4结果观察和判定
电泳结束后,取出凝胶板置于紫外透射仪上打开紫外灯观察。如某一待检样品扩增产物的DNA带与阳性对照的带在一条直线上,即它们与加样孔的距离相同,则该样品判定为阳性。243
GB/T 18935—-2003
5病毒中和试验(VN)
5.1材料
5. 1. 1标准阳性血清
5.1.2血清样品的采集和处理
动物血清样品的采集,保存和运送方法和要求详见附录A。待检血清56℃水浴灭能30min。5.1.3病毒
口蹄疫病毒O、A、亚洲-1型及SVDV中和试验用种毒分别适应于BHK21或IB-RS-2单层细胞。收获的病毒液测定TCID5后,分成1mL装的小管,一60℃保存备用。5.1.4细胞
BHK21或IB-RS-2传代细胞。
5.1.5细胞营养液和维持液
细胞维持液:Eagle-MEM(最低限度必须氨基酸营养液)与0.5%水解乳蛋白/Earle液等量混合配成,pH7.6~~7.8。在中和试验中作稀释液用。细胞营养液:细胞维持液加10%犊牛血清(pH7.4)。培养细胞用。5.2操作程序
5.2.1稀释血清
将血清作2倍连续稀释。一般含4个稀释度(如1:4~1:32)。如有特殊需要,可作6个稀释度(1 : 4~1: 128)。
稀释方法:
a)先向96孔微量板A2~A4、B2~B4各孔加稀释液,25μL/孔。b)将1:4稀释的待检血清加人A1、B1和A2、B2孔,25μL/孔。稀释:将A2、B2孔中的稀释液和血清混匀后吸出25μL移至A2、B2孔。再混匀后吸出25uI)
移至A4、B4孔。混勾后吸出25μL弃去。5.2.2对照
a)血清对照。如A5、B5为血清对照孔,先加稀释液25μL/孔,再加1/4稀释的标准阳性血清25μL/孔(血清1/8稀释)。
b)空白对照。至少2孔,如A6、B6孔,加稀释液100μL/孔。c)细胞对照。至少2孔,如A7、B7孔,加稀释液50μL/孔。d)病毒对照。至少2孔,如A8、B8孔,加稀释液25μL/孔。5.2.3稀释病毒和加样
按TCIDs/50ul.滴定结果,稀释病毒至200TCIDso/50μL。然后加入各血清稀释度孔和病毒及阳性对照孔(A8、B8),每孔25μL。5.2.4中和作用
加盖,37℃振荡1h。
5.2.5加入细胞
将2日龄~3日龄单层丰满,形态正常的BHK21或IB-RS-2细胞按常规消化,离心(1000r/min10min)收集细胞,加细胞营养液制成1×10°/mL~2×10°%/ml细胞悬液(pH7.4)。然后加入除空白对照(A6、B6)孔外的各试验孔,每孔50uL。5.2.6加盖
37℃振荡10min。置二氧化碳培养箱37℃静止培养2d~3d。5.3结果判定
FMDV致BHK21或IB-RS-2细胞的CPE很典型,在普通显微镜下易于识别,通常在48h后用倒置244
-TKAONi KAca-
显微镜观察即可判定结果。
试验成立的条件:
a)标推阳性血清孔无CPE出现。b)细胞对照孔中细胞生长已形成单层,形态正常。c)病毒对照孔无细胞生长,或有少量病变细胞存留。血清中和滴度为1:45或更高者判为阳性。GB/T18935—2003
血清中和滴度为1:16~1:32判为可疑,需进一步采样作试验,如第二次血清滴度1:6或高于1:16判为阳性。
斑清中和滴度为1:8判为阴性。6液相阻断-酶联免疫吸附试验(LpB-ELISA)6.1材料
6.1.1样品采集见附录A,所需试剂见附录C。6.1.2捕获抗体:用FMD病毒7个血清型146S抗原的兔抗血清,将该血清用pH9.6碳酸盐/重碳酸盐缓冲液稀释成最适浓度。
6.1.3抗原:用BHD-21细胞培养增殖FMD毒株制备,并进行预滴定,以达到某一稀释度,加人等体积稀释剂后,滴定曲线上线大约1.5,稀释剂为含0.05%吐温-20、酚红指示剂的PBS(PBST)。6.1.4检测抗体:豚鼠抗FMDV146S血清,预先用NBS(正常牛血清)阻断,稀释剂为含0.05%吐温-20、5%脱脂奶的PBS(PBSTM)。将该检测抗体稀释成最适浓度。6.1.5酶结合物:兔抗豚鼠Ig-辣根过氧化物酶(HRP)结合物,用NBS阻断,用PBSTM稀释成最适浓度。
6.2试验程序
6.2.1包被:ELISA板每孔用50μL免抗病毒血清包被,室温下置湿盒过夜。6.2.2洗涤:用PBS液洗板5次。
6.2.3加被检血清,在另一酶标板中加人50μL被检血清(每份血清重复做2次),2倍连续稀释起始为1:4。
6.2.4加抗原:向6.2.3酶标板中加抗原,每孔内加入相应的同型病毒抗原50μL,混合过置4℃过夜,或在37℃孵育1h,加人抗原后使血清的起始稀释度为18。6.2.5将50μuI.的血清/抗原混合物转移到兔血清包被的ELISA板中,置37C孵育1h。6.2.6洗板同6.2.3。
6.2.7每孔滴加50±1.前一步使用的同型病毒抗原的豚鼠抗血清,置37℃孵育1h。6.2.8洗板:每孔加50μl.酶结合物,置37℃孵育1h。6.2.9再洗板:每孔加50μL含0.05%H02(3%质量浓度)的邻苯二胺。6.2.10加50ul1.25mol/L硫酸中止反应,15min后,将板置于分光光度计上,在492nm波长条件下读取光吸收值。
6.2.11每次试验时,设立强阳性、弱阳性和132牛标准血清以及没有血清的稀释剂抗原对照孔,阴性血清对照孔。
6.3结果判定
抗体滴度以50%终滴度表示,即该稀释度50%孔的抑制率大于抗原对照孔抑制率均数的50%。滴度大于1:40为阳性,滴度接近1:40应用病毒中和试验重检。245
GB/T 18935--2003
7病毒感染相关(VIA)抗原琼脂凝胶免疫扩散试验(VIA-AGID)7.1材料
7.1.1血清样品的采集和处理见附录A。7.1.2 VIA抗原。
7.1.3VIA抗体阳性(对照)血清。7.1.4缓冲液
0.02 mol/L, Tris-0.15 mol/1.氯化钠Tris
氯化钠(NaCI)
蒸馏水
1000.0mL用浓盐酸调整pH为7.6。7.1.5模板:用有机玻璃板制作。本试验设计了两种不同孔数的模板(图1和图2所示)。I型由1个中央孔和6个均匀分布的周边孔组成,孔径和孔间距均为4mm。ⅡI型为适应大批量检测需要设计的,由4组I型模板组成。
①②?4
一抗原孔;
③—阳性对照孔:
一特检样品孔
图1 I型模板
7.1.6打孔器:与模板配套制作的,外径为4mm的不锈钢管。7.1.7平Ⅲ:常用直径6cm的平皿,要求底面平整光滑。7.2试验操作
@②?④
●抗原孔;
阳性对照孔:
①—待检样品孔
图2Ⅱ型模板
7.2.1琼脂糖凝胶板的制备
称取1.0g琼脂糖(电泳用),置于150mL容量的三角烧瓶中,再加人100ml缓冲液。将三角烧瓶置于磁力搅拌器上,边搅拌边加热至沸腾使琼脂糖完全熔化。将熔化的琼脂糖溶液注人平血中,每个平血加8mL,凝胶板厚约3mm。待自然冷却凝固后,盖好平Ⅲ后倒置放在湿盒中,4℃冰箱保存。7.2.2打孔
按检测样品的数量选用模板。揭开平皿,将模板放在凝胶板上方,打孔器垂直插入模板孔中并穿透凝胶直至底面。打完孔后拿开模板,用细针头轻轻挑出孔中的凝胶块,将平皿底部在酒精灯上略烤封底。
7.2.3加样
用微量移液器每孔加样20uL。抗原孔(中央孔)加VIA抗原;对照孔(I型中央孔左、右侧的2个周边孔,Ⅱ型2个中央孔之间的孔)加VIA阳性对照血清,其余各孔(1型4孔/板,Ⅱ型20孔/板)加待246
T KAONr KAca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 其它标准
- 热门标准
- 国家标准(GB)
- GB/T5204-2008 核电厂安全系统定期试验与监测
- GB/T42822-2023 美术用品中初级芳香胺的测定方法
- GB/T42854-2023 民用飞机客户培训飞行模拟机通用技术规范
- GB/T12293-1990 水果、蔬菜制品 可滴定酸度的测定
- GB/T1413-2023 系列1集装箱 分类、尺寸和额定质量
- GB50752-2012 电子辐射工程技术规范
- GB/T15449-1995 管壳额定开关用场效应晶体管空白详细规范
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB8552-1987 电子器件详细规范 低功率非线绕固定电阻器 RJ13型金属膜固定电阻器评定水平E(可供认证用)
- GB5606.3-2005 卷烟 第3部分:包装、卷制技术要求及贮运
- GB50194-2014 建设工程施工现场供用电安全规范
- GB∕T40032-2021 电动汽车换电安全要求
- GB/T43880.3-2024 服务型制造 导则 第3部分:资源管理
- GB/T11839-1989 二氧化铀芯块中硼的测定 姜黄素萃取光度法
- GB5864-1993 内河助航标志的主要外形尺寸
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2