- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0110-1993 医用超声压电陶瓷材料
标准号:
YY/T 0110-1993
标准名称:
医用超声压电陶瓷材料
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
111.36 KB
点击下载
标准简介:
YY/T 0110-1993.
1主题内容与适 用范围
YY/T 0110规定了医用超声压电陶瓷材料(以下简称材料)的技术要求、试验方法、检验规则。
YY/T 0110适用于医用超声压电陶瓷材料。
2引用标准
GB 2413压电陶瓷材料体积密度测悬方法
GB2414压电陶瓷材料性能测试方法四片的径向仲缩振动.长条的横向长度仲缩振动
GB 2828连批检查计数抽 样程序及抽样表(适用于连续批的检查)
GB2829周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)
GB 3388压电陶 瓷材料型号命名方法
GB 3389.1压电陶瓷材料性能测试方法常用名词术语
GB 3389.3压电陶 交材料性能测试方法居里温度T,的到试
GB 3389.5压电陶瓷材料性能测试方法圆片厚度仲缩报动模式
GB 11309压 电陶瓷材料性能判试方法压电应变常 數d33的准静态测试
3符号.代号
YY/T 0110采用GB 3389. 1中所规定的符号,代号。.
4材料的分类
4.1材料型 号命名应符合GB 3388中的要求,型号的第四部分即序号定为2.
4.2医用超声 压电陶交材料按其性能特征分为发射型压电陶兗材料和接收型压电向充材料。
4.2.1发射型压电陶毖材料分为大功率发射型压电肉瓷材料P-82和中.小功率发射型压电陶瓷材料P-42或PT-42.
4.2.2接收型压电陶瓷材料为 P-52。
5技术要求
5.1医用超声压电陶瓷村料应按规定 程序批准的技术文件进行生产,并应符合本标准的要求。
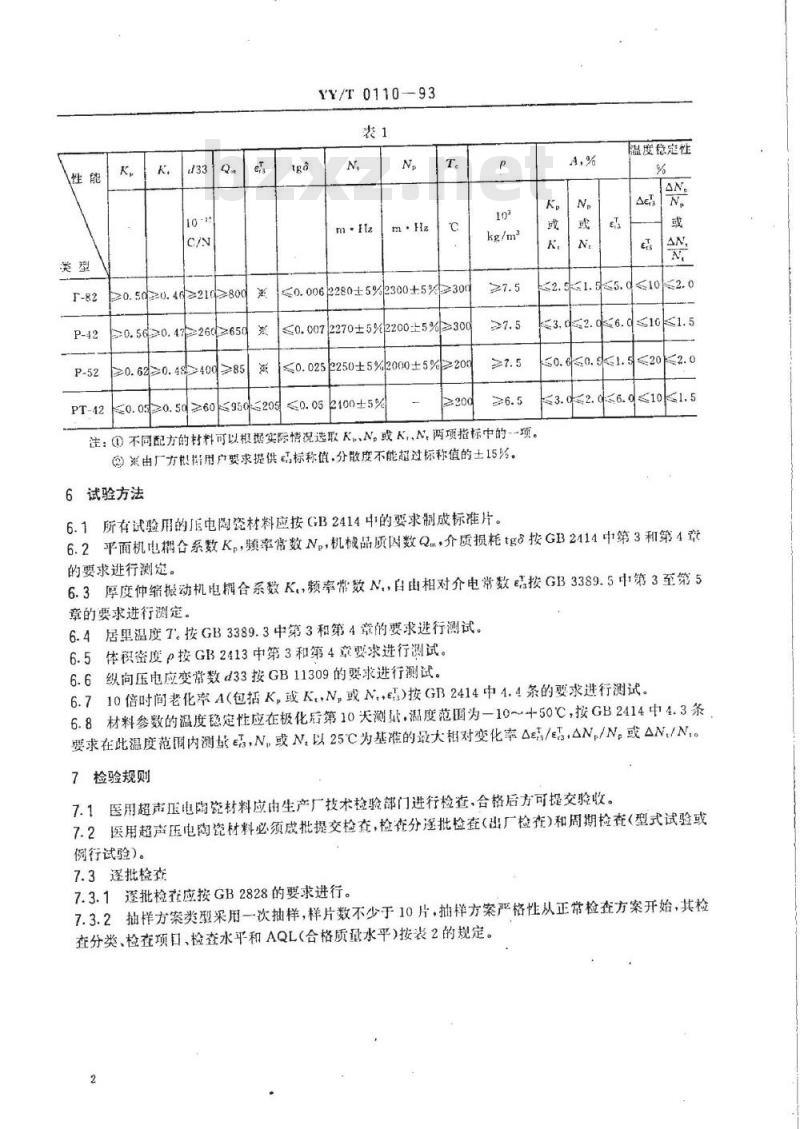
5.2医用超声压电陶 峦材料各性能应符合表1的规定。
部分标准内容:
YY/T0110—93wwW.bzxz.Net
医用超声压电陶瓷材料
1993-02-10发布
国家医药管理局发布
1993-05-01实施
中华人民共和国医药行业标准
医用超声压电陶瓷材料
主题内容与适用范围
YY/T0110-93
本标准规定了医用超声压电陶瓷材料(以下简称材料)的技术要求、试验方法、检验规则。本标准适用于医用超声压电陶瓷材料。引用标准
GB2413
压电陶瓷材料体积密度测基方法GB2414
GB2828
GB2829
压电陶瓷材料性能测试方法圆片的径向仲缩振动、长条的横向长度伸缩振动逐批检查计数抽样程序及抽样表(适用于连续批的检查)周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)GB3388压电陶瓷材料型号命名方法GB3389.1
压电陶瓷材料性能测试方法常用名词术语GB3389.3
3压电陶瓷材料性能测试方法居里温度T.的测试GB3389.5
压电陶瓷材料性能测试方法圆片厚度伸缩报动模式GB11309
压电陶瓷材料性能测试方法压电应变常数d33的准静态测试3符号、代号
本标准采用GB3389.1中所规定的符号、代号。4材料的分类
4.1材料型号命名应符合GB3388中的要求,型号的第四部分即序号定为2。4.2医用超声压电陶瓷材料按其性能特征分为发射型压电陶瓷材料和接收型压电陶施材料。4.2.1发射型压电陶瓷材料分为大功率发射型压电陶瓷材料P-82和中、小功率发射型压电陶瓷材料P-42或PT-42。
4.2.2接收型压电陶瓷材料为P-52。5技术要求
5.1医用超声压电陶瓷材料应按规定程序批准的技术文件进行生产,并应符合本标准的要求。5.2医用超声压电陶瓷材料各性能应符合表1的规定。国家医药管理局1993-02-10批准1993-05-01实施
20.5020.402102800
20.5620.4726≥650
20.62≥0.48400
YY/T0110-93
0.0062280±5%2300±5%300
≤0.0072270±5%2200±5%≥300≤0.0252250±5%2000±5%≥20
950205
≤0.052100±5%
≥200
注:①不同配方的材料可以根据实际情况选取K,N,或K,、N,两项指标中的--项。③关由厂方想据用户要求提供品标称值,分散度不能故过标称值的士15%。6试验方法
温度稳定性
2.51.55.d10
3.2.06.010
50.640.51.520
八3.02.06.0101.5
6.1所有试验用的压电陶瓷材料应按GB2414中的要求制成标准片。6.2平面机电耦合系数K,,频率常数N,,机械品质内数Qm,介质损耗tgo按GB2414中第3和第4章的要求进行测定。
6.3厚度仲缩振动机电相合系数K.,频率常数N,白由相对介电常数品按GB3389.5中第3至第5章的要求进行测定。
6.4居里温度T。按GB3389.3中第3和第4章的要求进行测试。6.5体积密度p按GB2413中第3和第4章要求进行测试。6.6纵向压电应变常数d33按GB11309的要求进行测试。6.710倍时间老化率A(包括K,或K,,N,或N,e)按GB2414中4.4条的要求进行测试。6.8材料参数的温度稳定性应在极化后第10天测,温度范围为-10~~+50℃,按GB2414中4.3条要求在此温度范围内测长e,N,或N.以25℃为基准的最大相对变化率As/e,△N,/N,或AN./N.。7检验规则
7.1医用超声压电陶瓷材料应由生产厂技术检验部门进行检查,合格后方可提交验收。7.2医用超声压电陶瓷材料必须成批提交检查,检查分逐批检查(出厂检在)和周期检查(型式试验或例行试验)。
7.3逐批检变
7.3.1逐批检在应按GB2828的要求进行。7.3.2抽样方案类型采用一次抽样,样片数不少于10片,抽样方案严格性从正常检查方案开始,其检查分类、检查项口、检查水平和AQL(合格质量水平)按装2的规定。检花分类
检查项目
检查水平
7.3.3转移规则
YY/T0110--93
K,或K..d33.Qm,
et,tga
7.3.3.1材料在正常检在时,若在不多于连续五批中有二批经初次检套(不包括再次提交检在批)不符合表1的要求,则从下批检查转到加严检在。在修正缺陷时,若影响其他试验组,再检套哪些项目,出质量部门和接收方决定。
7.3.3.2从加严检查到正常检查,从正常检查到放宽检查,从放宽检查到正常检查.从加严检在到暂停检查应符合GB2828的规定。
7.4周期检查
7.4.1在下列情况应进行周期检查:a.
新产品或老产品转厂生产的试制定型鉴定:正式生产后,如原材料、工艺有较大改变时;连续正常生产后,应周期性(一般为--年)进行一次检变;产品停产一年后,恢复生产时;出厂检查结果与上次型式检验有较大差异时;国家质量监督机构提出进行周期检验的要求时。7.4.2
2周期检查按GB2829的要求进行。7.4.3
周期检查前应先进行逐批检查,从逐批检查合格的批中抽样本进行周期检在周期检变采用次抽样方案,判别水平为1,其检查项目、判定数组和RQL(不合格质点水平)7.4.4
按表3的规定。
检在项
判定数组
不合格质基水平(RQL)
附加说明:
本标准由国家医药管理提出。
本标准由全国医用超声设备标准化分技术委员会归口。本标准由广州市职工电子超声研究所负资起草。本标准主要起草人很庆、虞秀月、黄丽眉、征新佳。TaP,A.品度稳定能
n2CA.-0,R-1)
(京)新登字023号
中华人民共和国医药
行业标准
医用超声压电陶瓷材料
YY/T0110-93
中国标准出版社出版
(北京复外三里河)
中国标准出版社北京印刚广印剧新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16印张1/2字数6千字1993年8月第一版1993年8月第一次印则印数1-2500
标日219—68
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY1122-2005 咬骨钳(剪)通用技术条件
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY0345-2002 骨接合植入物金属骨针
- YY/T0452-2003 止血钳
- YY0320-2000 麻醉机
- YY0003-1990 病床
- 行业新闻
网站备案号:湘ICP备2025141790号-2