- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0653-2008 血液分析仪
标准号:
YY/T 0653-2008
标准名称:
血液分析仪
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
7.75 MB
点击下载
标准简介:
YY/T 0653-2008.Hematology analyzer.
1范围
YY/T 0653规定了血液分析仪的术语和定义、分类.要求、试验方法、标签和使用说明、包装、运输和贮存。
YY/T 0653适用于对人类血液中有形成分进行定性、定量分析,并提供相关信息的血液分析仪(以下简称分析仪)。
YY/T 0653不适用于网织红细胞分析仪。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注8期的引用文件,其最新版本适用于本标准.
GB/T 191- -2008 包装储运 图示标志
GB 4793.1测量 、控制和试验室用电气设备的安全要求第 1部分:通用要求(GB 4793. 1-2007 ,IEC 61010-1:2001,IDT)
GB/T 14710医用电气设 备环境要求及试验方法
YY 0466- -2003医疗器械用于 医疗器械标签、标记和提供信息的符号(ISO 15223 :2000 ,IDT)
3术语和定义
下列术语和定义适用于本标准.
3.1
血液分析仪hematology analyzer血细胞分析仪主要用于检测人类血液标本,能对血液中有形成分进行定性、定量分析,并提供相关信息的仪器称为血液分析仪。半自动semi-automatic需要进行机外稀释功能用于血细胞分析的装置。指仪器或测试系统的某些分析步骤实现了机械化,其他步骤仍需操作者参与。[42 CFR Part 405,CLIA of 1988 ; final rule, 1992]
3.3
全自动automatic具有机内稀释功能的用于血细胞分析的装置.
部分标准内容:
中华人民共和国医药行业标准
YY/T0653—2008
血液分析仪
Hematologyanalyzer
2008-04-25发布
国家食品药品监督管理局
2009-06-01实施
本标准的附录A为规范性附录。
本标准由国家食品药品监督管理局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口。YY/T0653-2008
本标准起草单位:希森美康医用电子(上海)有限公司、北京市医疗器械检验所、美国贝克曼库尔特有限公司、深圳迈瑞生物医疗电子股份有限公司、江西特康科技有限公司、桂林高新区宝利泰医疗电子有限公司、美国雅培公司。
本标准主要起草人:丛玉隆、张宏、凌励、何延蜂、颜策、续勇、唐雪辉、张斯桦。I
1范围
血液分析仪
YY/T0653-2008
本标准规定了血液分析仪的术语和定义、分类、要求、试验方法、标签和使用说明、包装、运输和贮存。
本标准适用于对人类血液中有形成分进行定性、定量分析,并提供相关信息的血液分析仪(以下简称分析仪)。
本标准不适用于网织红细胞分析仪。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191—2008包装储运图示标志GB4793.1测量、控制和试验室用电气设备的安全要求第1部分:通用要求(GB4793.1一2007,IEC61010-1:2001,IDT)
GB/T14710医用电气设备环境要求及试验方法YY0466—2003医疗器械用于医疗器械标签、标记和提供信息的符号(ISO15223:2000,IDT)3术语和定义
下列术语和定义适用于本标准。3.1
血液分析仪hematologyanalyzer血细胞分析仪
主要用于检测人类血液标本,能对血液中有形成分进行定性、定量分析,并提供相关信息的仪器称为血液分析仪。
半自动
semi-automatic
需要进行机外稀释功能用于血细胞分析的装置。指仪器或测试系统的某些分析步骤实现了机械化,其他步骤仍需操作者参与。[42CFRPart405,CLIAof1988;finalrule.1992]3.3
全自动automatic
具有机内稀释功能的用于血细胞分析的装置。指仪器或测试系统的所有分析步骤都实现了机械化,包括样品和试剂添加、样品/试剂互相反应、化学/生物学分析、结果计算和结果读出。[42CFRPart405,CLIAof1988;finalrule.1992]3.4
准确性accuracy
一个测量值与可接受的参考值之间的一致程度。1
YY/T0653—2008
[ISO3534-1:1993,定义3.11]
注:此处引用ISO3534-1,在JJF1001一1998中,使用“真值”而不是“可接受的参考值”的概念。3.5
重复性repeatability
在相同测量条件下,对同一被测量物进行连续多次测量所得结果之间的一致性。[JJF1001—1998,定义5.6]
线性linearity
两组测量值的状态或两种方法所得的测量值之间成比例性相关。[NCCLSEP10-A2]
携带污染
carry-over
由测量系统将一个检测样品反应携带到另一个检测样品反应的分析物不连续量,由此错误地影响了另一个检测样品的表现量。
[NCCLSEP10-A2]
4产品分类
4.1无白细胞分群功能的血液分析仪。4.2两分群血液分析仪:能将白细胞分成大、小两群细胞的半自动血液分析仪。4.3三分群血液分析仪:能将白细胞分成大、中、小三群细胞的全自动血液分析仪。4.4五分类血液分析仪:能将白细胞分成五类(中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞)的全自动血液分析仪。5技术要求
5.1正常工作条件
5.1.1电源电压:220V±22V;50Hz±1Hz。5.1.2环境温度:18℃~25℃。
5.1.3相对湿度:80%。
5.1.4大气压力:厂家声称的大气压力条件。5.2空白计数
WBC<0.5×10°/L,RBC<0.05×1012/L,HGB≤2g/L,PLT≤10×10°/L5.3线性
分析仪的线性范围和线性误差应符合表1的要求。表1分析仪线性要求
线性范围
1.0×10/L~10.0×10/L
10.1×10/L~99.9×10°/L
0.30×10/L~1.00×1012/L
1.01×10/L~7.00×10/L
20g/L~70g/L
71g/L~240g/L
20×10°/L~100×10°/L
101×10*/L~999×10/L
线性误差
不超过±0.5×10°/L
不超过±5%
不超过±0.05×10/L
不超过士5%
不超过士2g/L
不超过±3%
不超过士10×10*/L
不超过士10%
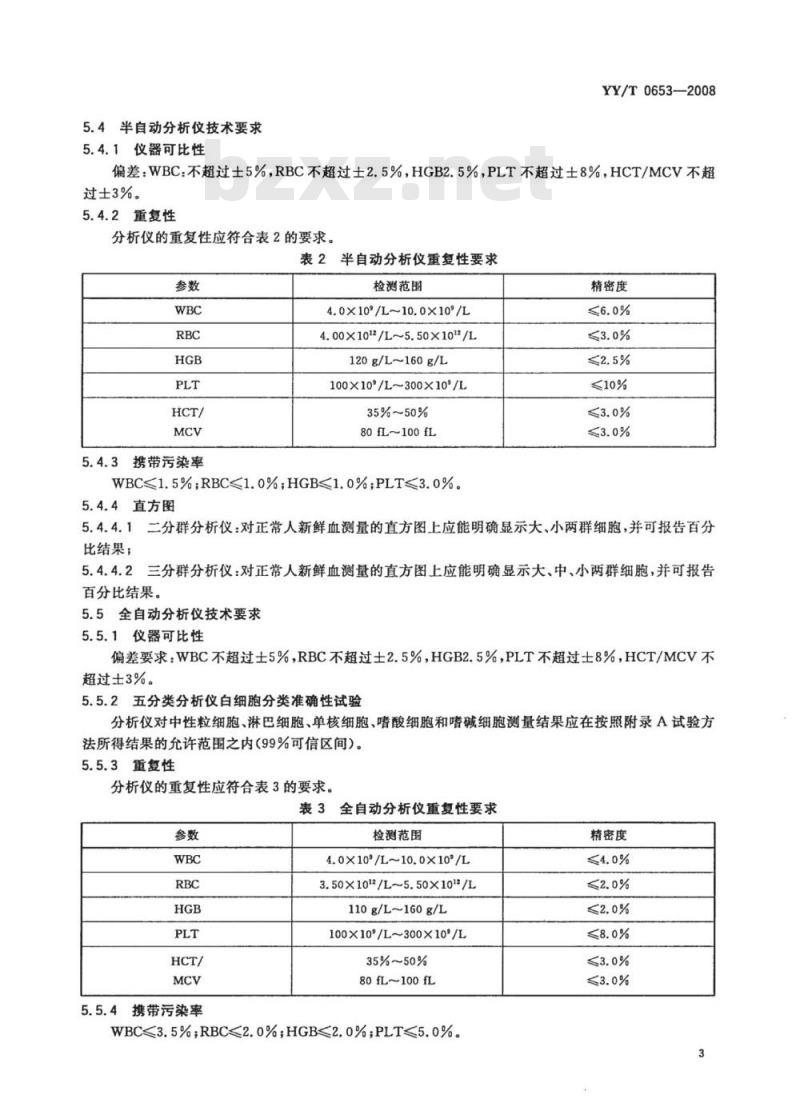
5.4半自动分析仪技术要求
5.4.1仪器可比性
YY/T0653—2008
偏差:WBC.不超过士5%,RBC不超过士2.5%,HGB2.5%,PLT不超过士8%,HCT/MCV不超过士3%。
5.4.2重复性
分析仪的重复性应符合表2的要求。表2半自动分析仪重复性要求
5.4.3携带污染率
检测范围
4.0×10°/L~10.0×10%/L
4.00×10/L~5.50×10/L
120g/L~160g/L
100×10/L~300×10/
35%~50%
80fL~100fL
WBC<1.5%;RBC<1.0%;HGB<1.0%;PLT≤3.0%5.4.4直方图
精密度
《10%
5.4.4.1二分群分析仪:对正常人新鲜血测量的直方图上应能明确显示大、小两群细胞,并可报告百分比结果;
三分群分析仪:对正常人新鲜血测量的直方图上应能明确显示大、中、小两群细胞,并可报告5.4.4.2
百分比结果。
5.5全自动分析仪技术要求
5.5.1仪器可比性
偏差要求:WBC不超过士5%,RBC不超过士2.5%,HGB2.5%,PLT不超过士8%,HCT/MCV不超过士3%。
5.5.2五分类分析仪白细胞分类准确性试验分析仪对中性粒细胞、淋巴细胞、单核细胞、嗜酸细胞和嗜碱细胞测量结果应在按照附录A试验方法所得结果的允许范围之内(99%可信区间)。5.5.3重复性
分析仪的重复性应符合表3的要求。表3全自动分析仪重复性要求
5.5.4携带污染率
检测范围
4.0×10°/L~10.0×10°/L
3.50×10/L~5.50×10*/L
110g/L~160g/L
100×10/L~300×10/L
35%~50%
80fL~100fL
WBC3.5%;RBC<2.0%;HGB<2.0%;PLT<5.0%精密度
YY/T0653-2008
5.6分析仪基本功能
分析仪应具有下列基本功能:
应提供中文报告;
b)具有异常报警功能;
c)具有与实验室信息系统进行通信的功能。5.7外观
外观应符合下列规定:
a)文字和标志应清晰可见;表面应色泽均勾、无磕碰、无划痕等缺陷;b)紧固件连接应牢固可靠,不得有松动。5.8安全
符合GB4793.1中适用条款的要求。5.9环境试验
符合GB/T14710中适用条款的要求。6试验方法
6.1试验条件
试验条件应符合下列规定:
a)应符合5.1规定的正常工作条件;使用厂家认可的试剂、质控品和校准品,校准品应具有溯源性;b)
使用厂家推荐的标本抗凝方法;e
分析仪在试验之前应达到稳定状态。6.2空白计数
用稀释液作为样本在分析仪上连续进行三次测试,取三次测试结果中的最大值。6.3线性
6.3.1使用线性质控品
按照线性质控品的使用说明进行操作,并计算偏差结果。6.3.2使用高值样品
取抗凝全血,离心去血浆,使之成浓缩的血细胞,再将浓缩的血细胞用自身的泛血小板血浆/稀释液进行梯度稀释,至少稀释为5个浓度,使高浓度值接近线性范围上限,使低浓度值接近线性范围的下限。以各浓度梯度的血样品上机测定,每份标本测定3次,各取测量平均值。然后以稀释度为自变量,以各稀释度的测量平均值为因变量,计算回归方程。由回归方程求出各稀释浓度点对应的理论值,计算测量平均值与理论值的绝对误差或相对百分误差。6.4仪器可比性
用一个状态良好的血液分析仪测量一份新鲜血样本或具有溯源性的校准品,连续测量5次并计算各参数的均值。以这些均值为靶值,再用上述样本或校正品校准待检的血液分析仪。在校正结束后,选用另一份新鲜血液样本在这两台仪器上分别测量5次,计算两台血液分析仪各检测参数均值间的偏差百分比。
6.5五分类分析仪白细胞分类准确性试验试验方法见附录A(规范性附录)。6.6重复性bzxz.net
取表2规定范围内的1份样本,按常规方法重复测定10次,按照式(1)计算变异系数(CV,%)。4
式中:
样品测试值的标准差;
样品测试值的平均值。
6.7携带污染
CV = s/±×100%
YY/T0653—2008
..(1)
取表4范围内的高值血液样本,混合均匀后连续测定三次,测定值分别为i,i2,i;再取一份表4范围内的低值血液样本,连续测定3次,测定值分别为j1,j2,j3。按式(2)计算携带污染率。携带污染率
×100%
(is —js)
表4携带污染率试验用样品浓度范围参数
6.8分析仪基本功能
通过检查,予以验证。
6.9外观
目视检查,予以验证。
6.10安全
高浓度范围
>15.0×10°/L
>6.00×10/L
>200g/L
>300×10°/L
安全实验方法应符合GB4793.1中适用条款的要求。6.11环境试验
环境试验方法应符合GB/T14710中适用条款的要求。7标签和使用说明
7.1总则
低浓度范围
<3.0×10°/L
<2.00×10/L
<40g/L
<100×10°/L
·(2)
标志、标签和使用说明书应使用中文,其他语言可备选使用。中文的使用应当符合国家通用的语言文字规范。标志、标签和使用说明书的文字、符号、图形、表格、数字、照片、图片等应当准确、清晰、规范。标志、标签和使用说明书中应尽量使用符号或图示,所使用的符号还需满足YY0466一2003的要求。7.2标志、标签
分析仪的标志、标签应清晰地标注在显著位置,并至少提供如下信息:a)产品名称、型号;
b)生产企业名称、注册地址、生产地址、联系方式;c)直接标注在贴于仪器上的标签上的编号或序列号;d)电源连接条件、输人功率。
注:只要适用,以上信息应采用符号表示。所使用的任何符号应该符合适用的法规和国家标准,如使用的符号没有现有的标准,应该在相关文件中对这些符号进行说明。7.3使用说明
使用说明应该清晰、简洁,词语应简单易于使用者理解。使用说明至少包括以下内容:a)产品名称、型号;
b)生产企业名称、注册地址、生产地址、联系方式及售后服务单位;c)《医疗器械生产企业许可证》编号、医疗器械注册证书编号;5
YY/T0653-2008
产品标准编号;
产品的性能、主要结构、适用范围、检测方法的原理;使用分析仪时应遵循的测量程序;注意事项以及其他需要警示或者提示的内容;分析仪标签所用的图形、符号、缩写等内容的解释;安装和使用说明或者图示(包括:产品安装说明及技术图、线路图;产品正确安装所必须的环境条件及鉴别是否正确安装的技术信息;其他特殊安装要求等);分析仪维护和保养方法,特殊储存条件、方法;使用说明发行的年月或修订版本号。包装、运输和贮存
包装所使用的图示标志应符合GB/T191一2008的规定;包装应能保证分析仪免受自然和机械性损坏;b)
包装箱内应附有使用说明书。
8.2运输
按照制造商规定的要求进行运输。贮存
按照制造商规定的要求进行贮存。6
A.1试验操作
附录A
(规范性附录)
五分类试验方法\
A.1.1参考方法必须由实验室内具备资格的检验人员操作。A.1.2仪器必须事先校准,每天进行质控测试。A.1.3取20位患者样本,每位患者取2份样本分别用于参考方法和仪器法的测试。YY/T0653--2008
A.1.4研究样本应统一标记。如参考方法,血涂片标记为A、B和备用;仪器法,按仪器操作说明书进行,结果标记为C和D。
A.1.5用参考方法进行五分类计数时,每份患者样本分析400个细胞,由两位具备资格的检验人员,按照参考方法步骤,对每张血涂片分析200个细胞。其中,一位检验人员使用血涂片A,另一位检验人员使用血涂片B。
A.1.6参考方法步骤:首先在低倍镜下(10倍~40倍)进行浏览,观察有无异常细胞和细胞分布情况。然后,在100倍油镜下,观察细胞浆内的颗粒和核分叶情况。检查从约50%的红细胞互相重叠区域开始,向红细胞完全散开的区域推移。采用“城垛式”方法检查血涂片。每个明确识别的细胞必须归人下列分类中:中性粒细胞;淋巴细胞;单核细胞;嗜酸性粒细胞;嗜碱性粒细胞;其他有核细胞。A.1.7仪器法应对20份样本进行双份测定,按仪器操作说明书进行。数据采集
每份样本的分类计数结果登记在数据汇总表上(见表A,1)。表A.1淋巴细胞分类数据记录表
参考方法(X)
样本号
玻片A玻片B
均值(工)
可信范围
99%下限
99%上限
注:应建立每种细胞类型评价的表格。仪器法(Y)
记录C
记录D
均值()
结果判断
不合格
按照99%可信区间计算方法,得到参考方法结果的可信范围。将仪器法测量结果平均值与可信范围比较,≥99%可信范围下限或<99%可信范围上限的判定为合格,超出此范围的判定为不合格。A.3可信区间计算
A.3.1标准误计算
计算公式:SE,
1)本试验方法参考NCCLSH20-A制定。YY/T0653-2008
按上所述,其中:n=200;p=参考方法均值;q=100一p;当自由度为199时,99%可信限的t分布因子=2.57。
A,3.2可信区间计算
某一参数百分率的99%可信区间:p士2.57×SE,。A.3.3可信区间工作表
常用可信区间工作表(由SE,导出99%可信限)表A2
99%上限
99%下限
细胞/%
WS/T122—1999
WS/T123—1999
ISO15198:2004
参考文献
全血中血红蛋白的测定
红细胞比积的测定
临床实验室医学
IEC61010-2-101:2002
疗设备的专用要求
IEC62366
[6]EN980
医疗器械
体外诊断医疗器械
YY/T0653-2008
制造商对用户质量控制程序的
第2-101部分:体外诊断医
测量、控制和实验室用电气设备的安全安全和基本性能的通用要求
可用性
医疗器械标记用图形符号
YY/T0653-2008
中华人民共和国医药
行业标准
血液分析
YY/T0653—2008
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张1
字数17千字
反2008年10月第一次印刷
2008年10月第一版
书号:155066·2-19044
如有印装差错
由本社发行中心调换
版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- YY医药标准
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0649-2016 电位治疗设备
- YY0004-1990 普通胸腔镊
- YY0345-2002 骨接合植入物金属骨针
- YY/T0454-2003 无菌塑柄手术刀
- YY0762-2009 眼科光学囊袋张力环
- YY/T0452-2003 止血钳
- YY0286.6-2009 专用输液器 第6部分:-次性使用流量设定微调式输液器
- YY/T0457.6-2003 医用电气设备 光电X射线影像增强器特性 第6部分:对比度及炫光系数的测定
- YY0450.1-2003 一次性使用无菌血管内导管辅件第1部分:导引器械
- YY/T0184-1994 输精管分离钳
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY0650-2008 妇科射频治疗仪
- YY0464-2009 一次性使用血液灌流器
- 行业新闻
网站备案号:湘ICP备2025141790号-2