- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 26426-2010 饲料中副溶血性弧菌的检测
标准号:
GB/T 26426-2010
标准名称:
饲料中副溶血性弧菌的检测
标准类别:
国家标准(GB)
标准状态:
现行出版语种:
简体中文下载格式:
.rar .pdf下载大小:
部分标准内容:
ICS65.120
中华人民共和国国家标准
GB/T26426-2010
饲料中副溶血性弧菌的检测
Method for determination of Vibrio parahaemolyticus in feeds(ISO/TS 21872-1:2007,Microbiology of food and animal feeding stuffs-Horizontal method for the detection of potentially enteropathogenicVibrio spp. --Part 1:Detection of Vibrio parahaemolyticus andVibriocholerae,MOD)
2011-01-14发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-07-01实施
本标准按照GB/T1.1—2009给出的规则起草。GB/T26426—2010
本标准使用重新起草法修改采用ISO/TS21872-1:2007《食品和动物饲料的微生物学潜在肠道致病性弧菌属检测的水平方法第1部分:副溶血性弧菌和霍乱弧菌的检测》(英文版)。本标准与ISO/TS21872-1:2007相比在结构上有较多调整,附录B中列出了本标准与ISO/TS21872-1:2007的章条编号对照一览表。本标准与ISO/TS21872-1:2007相比存在技术性差异,这些差异涉及的条款已通过在其外侧页边空白位置的垂直单线()进行了标识,附录C中给出了相应技术性差异及其原因的一览表。本标准还做了下列编辑性修改:删除了ISO7937:2004的目次;
删除了ISO7937:2004的引言;
删除了ISO7937:2004的参考文献,本标准由全国饲料工业标准化技术委员会(SAC/TC76)归口。本标准起草单位:广东省微生物分析检测中心。本标准主要起草人:朱红惠、孙晓棠、羊宋贞、黎志坤。1范围
饲料中副溶而性弧菌的检测
本标准规定了饲料中副溶面性弧菌的检验方法。本标准适用于饲料中副溶血性弧菌的检测。2规范性引用文件
GB/T26426—2010
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T14699.1饲料采样(GB/T14699.1—2005,ISO6497:2002,IDT)GB/T20195动物何料试样的制备(GB/T20195—2006,ISO6498:1998,IDT)3原理
3.1概述
检测副溶血性弧菌包括4个步骤。注:副溶血性弧菌可以少量存在,而且往往伴随着大量的其他弧菌或其他属的细菌。因此,要检测副溶血性弧菌,连续两次选择性增菌是必要的。3.2在选择性培养液中第一次增菌称取25g试样加人到选择性培养液中,室温接种增菌培养基(碱性盘蛋白陈水,ASPW),对于深度冷冻的样品于37℃培养6h士1h对于新鲜的或干燥的样品于41.5℃培养6h士1h。3.3在选择性培养液中第二次增菌吸取3.2获得的培养液重新接种新的增菌液ASPW管内,于41.5℃培养18h土1h。3.4分离
用3.2和3.3获得的培养液接种下面两种固体选择性培养基:硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS);可选择另一适当的能检测副溶血性弧菌的固体选择性培养基,作为TCBS的补充。TCBS在37℃培养24h士3h后检查结果。第二种选择性培养基按产品说明培养后检查结果。3.5确证
转接3.4中分离的可疑菌落,培养纯化,然后过适当的生化检验确证。4稀释液、培养基及试剂
除非另有说明,在分析中仅使用确认为分析纯的试剂,实验室用水采用蒸馏水或去离子水,或相当GB/T26426—2010
纯度的水。
4.1增菌培养基:碱性盐蛋白陈水(ASPW),参见附录A中的A.1。4.2固体选择性分离培养基
4.2.1第一种培养基:硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS),参见附录A中的A.2。4.2.2第二种培养基:科玛嘉弧菌显色培养基(CV)或大豆蛋白陈-三苯基氯化四氨唑琼脂(TSAT),两者可选择其一。严格按照厂商说明制备培养基。4.3含盐营养琼脂(SNA):参见附录A中的A.3。4.4检测氧化酶试剂:参见附录A中的A.4。4.5革兰氏染色液:参见附录A中的A.5。4.6含盐三糖铁琼脂(TSI):参见附录A中的A.6。4.7检测鸟氨酸脱羧酶(ODC)含盐培养基:参见附录A中的A,7。4.8检测赖氨酸脱羧酶(LDC)含盐培养基:参见附录 A中的 A.8。4.9精氨酸双水解酶(ADH)含盐培养基参见附录A中的A.9。4.10
检测β半乳糖苷酶试剂:参见附录A中的A.10。4.11
检测吲哚含盐培养基:参见附录A中的A.11。4.12
蛋白陈盐水:参见附录A中的A.12。氯化钠溶液:参见附录A中的A.13。5设备和玻璃器血
需配备微生物学常规设备和以下设备。5.1恒温培养箱:37℃士1℃。
5.2恒温培养箱或水浴:41.5℃土1℃。5.3水浴锅:44℃~47℃。
5.4水浴锅37℃±1℃。
5.5干热灭菌烘箱或湿热高压灭菌锅。5.6玻璃或塑料培养血:直径9cm~10cm。5.7刻度吸管:标记容量为1mL和10mL,最小刻度分别为0.1mL和0.5mL。5.8,pH计:25℃最小检测单位为0.01,精度到士0.1个单位。5.9显微镜。
6采样
实验室样品真实、具有代表性。采样工具,如铲子、匙、采样器、试管、广口瓶、剪子等,应是灭菌的。样品送到微生物检验室应越快越好。采样数量和方式按照GB/T14699.1执行。7样品的制备
按照GB/T20195进行试样的制备,样品制备后应尽快检验。8检验程序
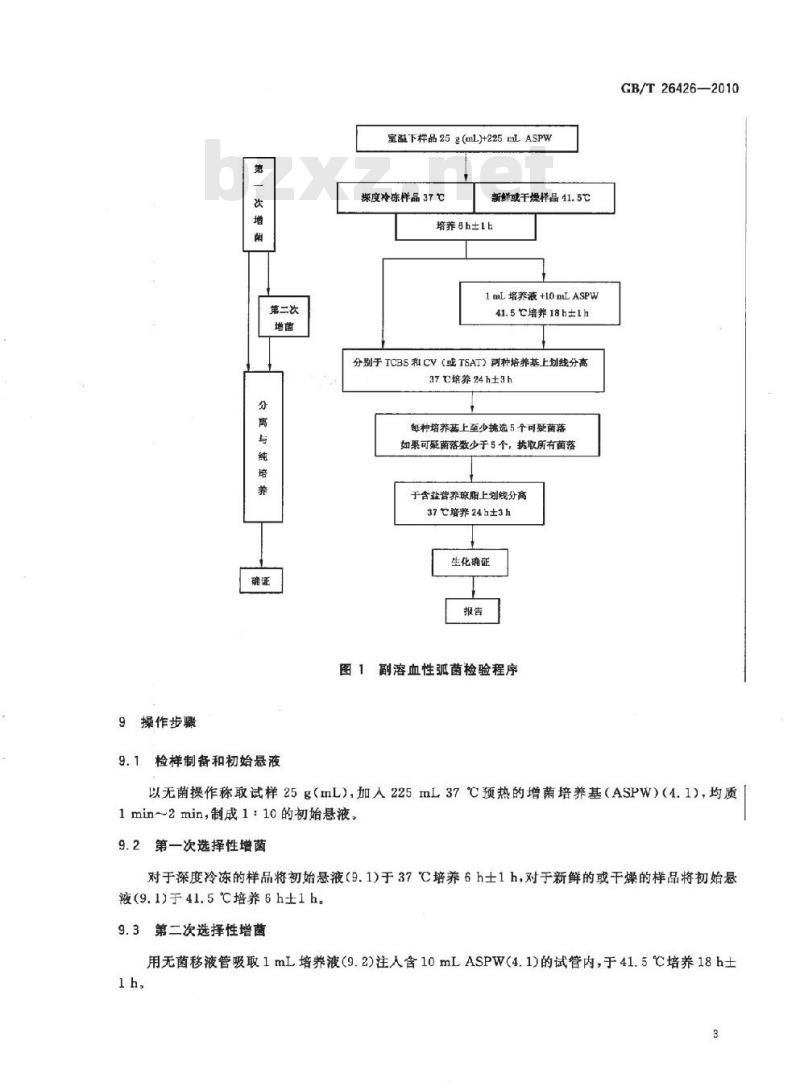
副溶血性弧菌检验程序见图1。
9操作步骤
第二次
9.1检样制备和初始悬液
室溢下样品25g(mL)+225mLASPW
深度冷冻样品37℃
新鲜或干燥样品41.5℃
培养8h1b
1mL培养液+10mLASPW
41.5C培养18h±1h
分别于TCBS和CV(或TSAT)两种培养基上划线分高37c培养24h±3h
每种培养基上至少挑选5个可熨菌籍如果可疑菌落数少于5个,挑取所有菌落于含盐营养琼脂上划线分高
37培养24h±3h
生化确证
图1副溶血性弧菌检验程序
GB/T26426—2010
以无菌操作称取试样25g(mL),加人225mL37℃预热的增菌培养基(ASPW))(4.1),均质1min~2min,制成1:10的初始悬液。9.2第一次选择性增菌
对于深度冷冻的样品将初始悬液(9.1)于37℃培养6h士1h,对于新鲜的或干燥的样品将初始悬液(9.1)于41.5℃培养6h士1h。
9.3第二次选择性增菌
用无菌移液管吸取1mL培养液(9.2)注含10mLASPW(4.1)的试管内,于41.5℃培养18h士1h,
GB/T26426--2010
9.4分离
9.2和9.3培养的两次增菌液,分别用接种环各划线接种在两种培养基上,一块TCBS琼脂平板(4.2.1)和一块科玛嘉弧菌显色培养基(或TSAT)琼脂平板(4.2.2)。翻转上述平Ⅲ置37℃C培养箱中培养。24h士3h后,检查平板上的可疑菌落,在平血底部标记要挑取的菌落。典型的副溶血性弧菌在TCBS琼脂平板上表面光滑,菌落绿色(蔗糖阴性),直径2mm~3mm。典型的副溶血性弧菌在科玛嘉弧菌显色培养基上表面光滑,菌落粉紫色,直径2mm~3mm。典型的副溶血性弧菌在TSAT琼脂平板上表面光滑,菌落暗红色,直径2mm~3mm。9.5确证试验
9.5.1菌落挑桃选和纯化
挑选每个平板(9.4)上的至少5个可疑菌落,如果平板上的可疑菌落数少于5个,挑选平板上所有可疑菌落。将挑选的菌落划线接种在含盐营养琼脂(4.3)平板表面,翻转上述平皿置37℃培养箱中培养24h士3h,获得单菌落。用纯培养物进行确证试验。9.5.2可凝菌落初步监定
9.5.2.1氧化酶试验
用铂金丝接种环或玻璃棒挑取在含盐营养琼脂平板(9.5.1)上纯培养的单菌落,在浸有氧化酶试剂(4.4)的滤纸上划线。也可按照说明使用商业上的测试片。不可用镍铬丝或金属丝接种环取样。如果在10 s内变为紫红色、紫罗兰色或深紫色为阳性。9.5.2.2显微镜观察
挑取在含盐营养琼脂平板上纯培养的单菌落(9.5.1),按9.5.2.2a)和9.5.2.2b)所述进行确证试验:
进行革兰氏染色(4.5),显微镜观察菌体形态和革兰氏染色反应,记录结果。b)接种含有ASPW的试管,37℃培养1h~6h,滴一滴菌液在洁净的玻片中央,在菌液上轻覆以盖玻片,显微镜下观察运动性,记下运动呈阳性的结果。9.5.2.3选择培养物进行生化试验保留氧化酶反应呈阳性、革兰氏染色阴性、无芽孢,运动性呈阳性的菌落,进行9.5.3所述的生化确证试验。
9.5.3生化确证
9.5.3.1概述
挑取9.5.2.3保留的纯培养物,接种9.5.3.2~9.5.3.8中需要的培养基。9.5.3.2含盐三糖铁琼脂试验
先穿刺含盐三糖铁琼脂(4.6)斜面底层,然后在斜面划线,37℃培养24h士3h。观察结果。a)琼脂培养基斜面
黄色:乳糖和/或蔗糖阳性(利用乳糖和/或蔗糖);红色或无变化:乳糖和蔗糖阴性(不利用乳糖和蔗糖)。b)琼脂培养基底层
黄色:葡萄糖阳性(发醇葡萄糖):一-红色或无变化:葡萄糖阴性(不发酵葡萄糖);黑色:产生硫化氢;
一泡沫或破裂:从葡萄糖产气。GB/T26426—2010
典型的副溶血性弧菌反应为斜面星碱性(红色,不利用乳糖和蔗糖)和底层皇酸性(黄色,发醇葡萄糖),不产生硫化氢,不产气,有动力。9.5.3.3鸟氨酸脱羧酶检测
接种培养物于液体含盐培养基(4.7)略低于表面层,加1mL灭菌矿物油于表面,37℃培养24h士3h。
培养后混浊紫罗兰色者为阳性反应(细菌生长并产生鸟氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.4赖氨酸脱羧酶检测
接种培养物于液体含盐培养基(4.8)略低于表面层,加1mL灭菌矿物油于表面,37C培养24h土3h.
培养后呈混独且紫罗兰色者为阳性反应(细菌生长并产生赖氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.5精氨酸双水解酶检测
接种培养物于液体含盐培养基(4.9)略低于表面层,加1mL灭菌矿物油于表面。37℃培养24h士3h.
培养后呈混浊且紫罗兰色者为阳性反应(细菌生长并产生精氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.6β-半乳糖苷酶检测
接种培养物于含0.25mL盐溶液(4.13)的管中,加一滴甲苯,振荡混勾。37℃水浴5min。加0.25mL检测β-半乳糖节酶的试剂(4.10),混匀。37℃水浴24h士3h。不时观察结果。呈黄色者为阳性反应(产生β-半乳糖苷酶),一般20min可见。如果24h不变色为阴性反应。如果用商业的测试片,按照说明书操作。9.5.3.7吲哚检测
接种培养物于含5mL胰蛋白陈-色氨酸含盐培养基(4.11)。37℃培养24h士3h。然后加1mLKovacs'试剂。
在液层界面形成红色环者为阳性反应(产生吲哚),黄褐色环为阴性反应。9.5.3.8嗜盐性检测
接种培养物于0%,2%,6%,8%和10%不同盐浓度的蛋白陈水(4.12)中,制备菌悬液。37℃培养24h±3h。
观察液体混浊度判断细菌生长情况。9.5.3.9生化试验结果
副溶血性弧菌生化反应结果见表1。GB/T26426—2010
1%的含盐三糖铁琼脂上
蛋白陈盐水生长
注:十为阳性,一为阴性。
致病性固素确定(选做项)
表1生化试验结果
葡萄糖发酵
产气(葡萄糖)
产生硫化氢
乌氨酸脱羧酶检测
赖氨酸脱羧酶检测
精氨酸双水解酶检测
ONPG水解
吲哚产生
0%氮化钠
2%氯化钠
6%氟化钠
8%氟化钠
10%氯化钠
副溶血性弧菌
V.parahaemolyticus
副溶血性弧菌都是致病性的,为了确定菌株的致病性,需要检测菌株是否含有耐热直接溶血素(TDH)或TDH相关溶血素基因,这些检测应该在经认可的有能力的实验室进行。将分离出的副溶血性弧菌阳性菌株接种到含盐营养琼脂斜面(4.3)送至经认可的有能力的实验室进行确证。应同时提供尽可能多的关于分离菌株的信息。警告:副溶血性弧菌为对人和环境有中度潜在危险的病原,微生物操作、废弃物处理及个人防护等生物安全保障规定参见GB19489。10报告
根据所分离菌株是否符合9.5.3.9所述的生化确证特性,报告25g(mL)样品中检出或未检出副溶血性弧菌。
A.1碱性盐蛋白陈水(ASPW)
A.1.1成分
蛋白陈
氯化钠
蒸馏水
A.1.2制法
附录A
(资料性附录)
培养基和试剂
1000mL
GB/T26426—2010
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为8.6士0.2,分装烧瓶和试管(9.1和9.3),121℃灭茵15min.A.2硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS)A.2.1成分
蛋白陈
酵母膏
柠檬酸钠
硫代硫酸钠
柠檬酸铁
氯化钠
牛胆汁粉
溴麝香草酚蓝
香草酚蓝
蒸馏水
A.2.2制法
12.0g~18.0gl)
1000mL
加热煮沸至各成分完全溶解,调整pH值,使培养基pH值在25℃时为8.6士0.2,不要使用高压灭菌器。
A2.3制备琼脂平板
冷却至50℃,每个灭菌平板倾注15mL~20mL,凝固各用。用之前,最好使琼脂表面干燥。1)据凝胶强度而定。
GB/T26426—2010
A.2.4培养基质量控制
用含盐营养琼脂(SNA)和下列菌株作对照,评估每批TCBS平板效率。-V.parahaemolyticuNCTC10885;V.furnissii NCTC 11218,
EscherichiacoliATCC25922,8739或11775.平板效率计算公式见式(A,1)。式中:
每批TCBS平板效率;
Nrch5×100
NTcRs-—TCBS培养基上产生的菌落数;-SNA培养基上产生的菌落数。
-(A.1)
对于副溶血性弧菌(阳性对照),平板效率至少应为50%,大肠杆菌的平板效率应小于1%(阴性对照)。副溶血性弧菌NCTC10885菌落应为绿色(蔗糖阴性),而弗氏弧菌NCTC11218菌落应为黄色(蔗糖阳性)。
A.3含盐营养琼脂(SNA)
A3.1成分
牛肉膏
蛋白陈
氯化钠
蒸馏水
A.3.2制法
12. 0 g~18. 0 g2)
1000mL
热溶解各成分,调整pH值,使培养基pH值在25℃时为7.2士0.2。分装到适当容量的烧瓶和试管中,121℃灭菌15min,试管需制成斜面。A.3.3制备琼脂平板
冷却至50℃,每个灭菌平板倾注15mL~20mL,凝固备用。用之前,最好使琼脂表面干燥。A.4检测氧化酶试剂
A.4.1成分
四甲基对苯二胺
蒸馏水
A.4.2制法
用之前迅速溶解各成分于冷的蒸馏水中。2)据凝胶强度而定。
A.5革兰氏染色液
结晶紫染色液
A.5.1.1成分
结晶紫
95%乙醇
1%草酸铵水溶液
A.5.1.2制法
将结晶紫溶解于乙醇中,然后与草酸铵溶液混合。革兰氏碘液
A.5.2.1成分
碘化钾
蒸馏水
GB/T26426—2010
将碘与碘化钾先进行混合,加人蒸馏水少许,充分拆摇,待完全溶解后,再加蒸馏水至300mL。A.5.3
沙黄复染液
A.5.3.1成分
95%乙醇
蒸馏水
将沙黄溶解于乙醇中,然后用蒸馏水稀释。A.5.4染色法
将涂片在火焰上固定,滴加结晶紫染色液,染色1min,水洗;滴加革兰氏碘液,作用1min,水洗;滴加95%乙醇脱色,约30s,水洗;滴加沙黄复染液,复染1min,水洗;待干,镜检。A.6
含盐三糖铁琼脂(TSD
A6.1成分
蛋白陈
牛肉膏
酵母膏
GB/T26426—2010
氯化钠
葡葡糖
柠檬酸铁
苯酚红
蒸馏水
A6.2制法
12. 0 g~18. 0 g3免费标准bzxz.net
1000mL
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为7.4士0.2。分装到适当容量的试管中,121℃灭菌15min。制成斜面,斜面长约4.5cm,底部深度约2.5cm。如果培养基放置超过8天,用之前先放人沸水浴10min使之融化,冷却制成斜面。检测鸟氨酸脱羧酶(ODC)含盐培养基A.7
A.7.1成分
L-鸟氨酸盐酸盐
酵母膏
葡萄糖
漠甲酚紫
氯化钠
蒸馏水
A.7.2制法
落解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为6.8士0.2。分装试管,每管2mL~5mL,121℃灭菌15min。A.8
3检测赖氨酸脱羧酶(LDC)含盐培养基A.8.1成分
L-赖氨酸盐酸盐
醇母膏
葡萄糖
溴甲酚紫
氯化钠
A.8.2制法
1000mL
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为6.8士0.2。分装试管,据凝胶强度而定,
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T26426-2010
饲料中副溶血性弧菌的检测
Method for determination of Vibrio parahaemolyticus in feeds(ISO/TS 21872-1:2007,Microbiology of food and animal feeding stuffs-Horizontal method for the detection of potentially enteropathogenicVibrio spp. --Part 1:Detection of Vibrio parahaemolyticus andVibriocholerae,MOD)
2011-01-14发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-07-01实施
本标准按照GB/T1.1—2009给出的规则起草。GB/T26426—2010
本标准使用重新起草法修改采用ISO/TS21872-1:2007《食品和动物饲料的微生物学潜在肠道致病性弧菌属检测的水平方法第1部分:副溶血性弧菌和霍乱弧菌的检测》(英文版)。本标准与ISO/TS21872-1:2007相比在结构上有较多调整,附录B中列出了本标准与ISO/TS21872-1:2007的章条编号对照一览表。本标准与ISO/TS21872-1:2007相比存在技术性差异,这些差异涉及的条款已通过在其外侧页边空白位置的垂直单线()进行了标识,附录C中给出了相应技术性差异及其原因的一览表。本标准还做了下列编辑性修改:删除了ISO7937:2004的目次;
删除了ISO7937:2004的引言;
删除了ISO7937:2004的参考文献,本标准由全国饲料工业标准化技术委员会(SAC/TC76)归口。本标准起草单位:广东省微生物分析检测中心。本标准主要起草人:朱红惠、孙晓棠、羊宋贞、黎志坤。1范围
饲料中副溶而性弧菌的检测
本标准规定了饲料中副溶面性弧菌的检验方法。本标准适用于饲料中副溶血性弧菌的检测。2规范性引用文件
GB/T26426—2010
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T14699.1饲料采样(GB/T14699.1—2005,ISO6497:2002,IDT)GB/T20195动物何料试样的制备(GB/T20195—2006,ISO6498:1998,IDT)3原理
3.1概述
检测副溶血性弧菌包括4个步骤。注:副溶血性弧菌可以少量存在,而且往往伴随着大量的其他弧菌或其他属的细菌。因此,要检测副溶血性弧菌,连续两次选择性增菌是必要的。3.2在选择性培养液中第一次增菌称取25g试样加人到选择性培养液中,室温接种增菌培养基(碱性盘蛋白陈水,ASPW),对于深度冷冻的样品于37℃培养6h士1h对于新鲜的或干燥的样品于41.5℃培养6h士1h。3.3在选择性培养液中第二次增菌吸取3.2获得的培养液重新接种新的增菌液ASPW管内,于41.5℃培养18h土1h。3.4分离
用3.2和3.3获得的培养液接种下面两种固体选择性培养基:硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS);可选择另一适当的能检测副溶血性弧菌的固体选择性培养基,作为TCBS的补充。TCBS在37℃培养24h士3h后检查结果。第二种选择性培养基按产品说明培养后检查结果。3.5确证
转接3.4中分离的可疑菌落,培养纯化,然后过适当的生化检验确证。4稀释液、培养基及试剂
除非另有说明,在分析中仅使用确认为分析纯的试剂,实验室用水采用蒸馏水或去离子水,或相当GB/T26426—2010
纯度的水。
4.1增菌培养基:碱性盐蛋白陈水(ASPW),参见附录A中的A.1。4.2固体选择性分离培养基
4.2.1第一种培养基:硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS),参见附录A中的A.2。4.2.2第二种培养基:科玛嘉弧菌显色培养基(CV)或大豆蛋白陈-三苯基氯化四氨唑琼脂(TSAT),两者可选择其一。严格按照厂商说明制备培养基。4.3含盐营养琼脂(SNA):参见附录A中的A.3。4.4检测氧化酶试剂:参见附录A中的A.4。4.5革兰氏染色液:参见附录A中的A.5。4.6含盐三糖铁琼脂(TSI):参见附录A中的A.6。4.7检测鸟氨酸脱羧酶(ODC)含盐培养基:参见附录A中的A,7。4.8检测赖氨酸脱羧酶(LDC)含盐培养基:参见附录 A中的 A.8。4.9精氨酸双水解酶(ADH)含盐培养基参见附录A中的A.9。4.10
检测β半乳糖苷酶试剂:参见附录A中的A.10。4.11
检测吲哚含盐培养基:参见附录A中的A.11。4.12
蛋白陈盐水:参见附录A中的A.12。氯化钠溶液:参见附录A中的A.13。5设备和玻璃器血
需配备微生物学常规设备和以下设备。5.1恒温培养箱:37℃士1℃。
5.2恒温培养箱或水浴:41.5℃土1℃。5.3水浴锅:44℃~47℃。
5.4水浴锅37℃±1℃。
5.5干热灭菌烘箱或湿热高压灭菌锅。5.6玻璃或塑料培养血:直径9cm~10cm。5.7刻度吸管:标记容量为1mL和10mL,最小刻度分别为0.1mL和0.5mL。5.8,pH计:25℃最小检测单位为0.01,精度到士0.1个单位。5.9显微镜。
6采样
实验室样品真实、具有代表性。采样工具,如铲子、匙、采样器、试管、广口瓶、剪子等,应是灭菌的。样品送到微生物检验室应越快越好。采样数量和方式按照GB/T14699.1执行。7样品的制备
按照GB/T20195进行试样的制备,样品制备后应尽快检验。8检验程序
副溶血性弧菌检验程序见图1。
9操作步骤
第二次
9.1检样制备和初始悬液
室溢下样品25g(mL)+225mLASPW
深度冷冻样品37℃
新鲜或干燥样品41.5℃
培养8h1b
1mL培养液+10mLASPW
41.5C培养18h±1h
分别于TCBS和CV(或TSAT)两种培养基上划线分高37c培养24h±3h
每种培养基上至少挑选5个可熨菌籍如果可疑菌落数少于5个,挑取所有菌落于含盐营养琼脂上划线分高
37培养24h±3h
生化确证
图1副溶血性弧菌检验程序
GB/T26426—2010
以无菌操作称取试样25g(mL),加人225mL37℃预热的增菌培养基(ASPW))(4.1),均质1min~2min,制成1:10的初始悬液。9.2第一次选择性增菌
对于深度冷冻的样品将初始悬液(9.1)于37℃培养6h士1h,对于新鲜的或干燥的样品将初始悬液(9.1)于41.5℃培养6h士1h。
9.3第二次选择性增菌
用无菌移液管吸取1mL培养液(9.2)注含10mLASPW(4.1)的试管内,于41.5℃培养18h士1h,
GB/T26426--2010
9.4分离
9.2和9.3培养的两次增菌液,分别用接种环各划线接种在两种培养基上,一块TCBS琼脂平板(4.2.1)和一块科玛嘉弧菌显色培养基(或TSAT)琼脂平板(4.2.2)。翻转上述平Ⅲ置37℃C培养箱中培养。24h士3h后,检查平板上的可疑菌落,在平血底部标记要挑取的菌落。典型的副溶血性弧菌在TCBS琼脂平板上表面光滑,菌落绿色(蔗糖阴性),直径2mm~3mm。典型的副溶血性弧菌在科玛嘉弧菌显色培养基上表面光滑,菌落粉紫色,直径2mm~3mm。典型的副溶血性弧菌在TSAT琼脂平板上表面光滑,菌落暗红色,直径2mm~3mm。9.5确证试验
9.5.1菌落挑桃选和纯化
挑选每个平板(9.4)上的至少5个可疑菌落,如果平板上的可疑菌落数少于5个,挑选平板上所有可疑菌落。将挑选的菌落划线接种在含盐营养琼脂(4.3)平板表面,翻转上述平皿置37℃培养箱中培养24h士3h,获得单菌落。用纯培养物进行确证试验。9.5.2可凝菌落初步监定
9.5.2.1氧化酶试验
用铂金丝接种环或玻璃棒挑取在含盐营养琼脂平板(9.5.1)上纯培养的单菌落,在浸有氧化酶试剂(4.4)的滤纸上划线。也可按照说明使用商业上的测试片。不可用镍铬丝或金属丝接种环取样。如果在10 s内变为紫红色、紫罗兰色或深紫色为阳性。9.5.2.2显微镜观察
挑取在含盐营养琼脂平板上纯培养的单菌落(9.5.1),按9.5.2.2a)和9.5.2.2b)所述进行确证试验:
进行革兰氏染色(4.5),显微镜观察菌体形态和革兰氏染色反应,记录结果。b)接种含有ASPW的试管,37℃培养1h~6h,滴一滴菌液在洁净的玻片中央,在菌液上轻覆以盖玻片,显微镜下观察运动性,记下运动呈阳性的结果。9.5.2.3选择培养物进行生化试验保留氧化酶反应呈阳性、革兰氏染色阴性、无芽孢,运动性呈阳性的菌落,进行9.5.3所述的生化确证试验。
9.5.3生化确证
9.5.3.1概述
挑取9.5.2.3保留的纯培养物,接种9.5.3.2~9.5.3.8中需要的培养基。9.5.3.2含盐三糖铁琼脂试验
先穿刺含盐三糖铁琼脂(4.6)斜面底层,然后在斜面划线,37℃培养24h士3h。观察结果。a)琼脂培养基斜面
黄色:乳糖和/或蔗糖阳性(利用乳糖和/或蔗糖);红色或无变化:乳糖和蔗糖阴性(不利用乳糖和蔗糖)。b)琼脂培养基底层
黄色:葡萄糖阳性(发醇葡萄糖):一-红色或无变化:葡萄糖阴性(不发酵葡萄糖);黑色:产生硫化氢;
一泡沫或破裂:从葡萄糖产气。GB/T26426—2010
典型的副溶血性弧菌反应为斜面星碱性(红色,不利用乳糖和蔗糖)和底层皇酸性(黄色,发醇葡萄糖),不产生硫化氢,不产气,有动力。9.5.3.3鸟氨酸脱羧酶检测
接种培养物于液体含盐培养基(4.7)略低于表面层,加1mL灭菌矿物油于表面,37℃培养24h士3h。
培养后混浊紫罗兰色者为阳性反应(细菌生长并产生鸟氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.4赖氨酸脱羧酶检测
接种培养物于液体含盐培养基(4.8)略低于表面层,加1mL灭菌矿物油于表面,37C培养24h土3h.
培养后呈混独且紫罗兰色者为阳性反应(细菌生长并产生赖氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.5精氨酸双水解酶检测
接种培养物于液体含盐培养基(4.9)略低于表面层,加1mL灭菌矿物油于表面。37℃培养24h士3h.
培养后呈混浊且紫罗兰色者为阳性反应(细菌生长并产生精氨酸脱羧酶),呈黄色者为阴性反应。9.5.3.6β-半乳糖苷酶检测
接种培养物于含0.25mL盐溶液(4.13)的管中,加一滴甲苯,振荡混勾。37℃水浴5min。加0.25mL检测β-半乳糖节酶的试剂(4.10),混匀。37℃水浴24h士3h。不时观察结果。呈黄色者为阳性反应(产生β-半乳糖苷酶),一般20min可见。如果24h不变色为阴性反应。如果用商业的测试片,按照说明书操作。9.5.3.7吲哚检测
接种培养物于含5mL胰蛋白陈-色氨酸含盐培养基(4.11)。37℃培养24h士3h。然后加1mLKovacs'试剂。
在液层界面形成红色环者为阳性反应(产生吲哚),黄褐色环为阴性反应。9.5.3.8嗜盐性检测
接种培养物于0%,2%,6%,8%和10%不同盐浓度的蛋白陈水(4.12)中,制备菌悬液。37℃培养24h±3h。
观察液体混浊度判断细菌生长情况。9.5.3.9生化试验结果
副溶血性弧菌生化反应结果见表1。GB/T26426—2010
1%的含盐三糖铁琼脂上
蛋白陈盐水生长
注:十为阳性,一为阴性。
致病性固素确定(选做项)
表1生化试验结果
葡萄糖发酵
产气(葡萄糖)
产生硫化氢
乌氨酸脱羧酶检测
赖氨酸脱羧酶检测
精氨酸双水解酶检测
ONPG水解
吲哚产生
0%氮化钠
2%氯化钠
6%氟化钠
8%氟化钠
10%氯化钠
副溶血性弧菌
V.parahaemolyticus
副溶血性弧菌都是致病性的,为了确定菌株的致病性,需要检测菌株是否含有耐热直接溶血素(TDH)或TDH相关溶血素基因,这些检测应该在经认可的有能力的实验室进行。将分离出的副溶血性弧菌阳性菌株接种到含盐营养琼脂斜面(4.3)送至经认可的有能力的实验室进行确证。应同时提供尽可能多的关于分离菌株的信息。警告:副溶血性弧菌为对人和环境有中度潜在危险的病原,微生物操作、废弃物处理及个人防护等生物安全保障规定参见GB19489。10报告
根据所分离菌株是否符合9.5.3.9所述的生化确证特性,报告25g(mL)样品中检出或未检出副溶血性弧菌。
A.1碱性盐蛋白陈水(ASPW)
A.1.1成分
蛋白陈
氯化钠
蒸馏水
A.1.2制法
附录A
(资料性附录)
培养基和试剂
1000mL
GB/T26426—2010
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为8.6士0.2,分装烧瓶和试管(9.1和9.3),121℃灭茵15min.A.2硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂(TCBS)A.2.1成分
蛋白陈
酵母膏
柠檬酸钠
硫代硫酸钠
柠檬酸铁
氯化钠
牛胆汁粉
溴麝香草酚蓝
香草酚蓝
蒸馏水
A.2.2制法
12.0g~18.0gl)
1000mL
加热煮沸至各成分完全溶解,调整pH值,使培养基pH值在25℃时为8.6士0.2,不要使用高压灭菌器。
A2.3制备琼脂平板
冷却至50℃,每个灭菌平板倾注15mL~20mL,凝固各用。用之前,最好使琼脂表面干燥。1)据凝胶强度而定。
GB/T26426—2010
A.2.4培养基质量控制
用含盐营养琼脂(SNA)和下列菌株作对照,评估每批TCBS平板效率。-V.parahaemolyticuNCTC10885;V.furnissii NCTC 11218,
EscherichiacoliATCC25922,8739或11775.平板效率计算公式见式(A,1)。式中:
每批TCBS平板效率;
Nrch5×100
NTcRs-—TCBS培养基上产生的菌落数;-SNA培养基上产生的菌落数。
-(A.1)
对于副溶血性弧菌(阳性对照),平板效率至少应为50%,大肠杆菌的平板效率应小于1%(阴性对照)。副溶血性弧菌NCTC10885菌落应为绿色(蔗糖阴性),而弗氏弧菌NCTC11218菌落应为黄色(蔗糖阳性)。
A.3含盐营养琼脂(SNA)
A3.1成分
牛肉膏
蛋白陈
氯化钠
蒸馏水
A.3.2制法
12. 0 g~18. 0 g2)
1000mL
热溶解各成分,调整pH值,使培养基pH值在25℃时为7.2士0.2。分装到适当容量的烧瓶和试管中,121℃灭菌15min,试管需制成斜面。A.3.3制备琼脂平板
冷却至50℃,每个灭菌平板倾注15mL~20mL,凝固备用。用之前,最好使琼脂表面干燥。A.4检测氧化酶试剂
A.4.1成分
四甲基对苯二胺
蒸馏水
A.4.2制法
用之前迅速溶解各成分于冷的蒸馏水中。2)据凝胶强度而定。
A.5革兰氏染色液
结晶紫染色液
A.5.1.1成分
结晶紫
95%乙醇
1%草酸铵水溶液
A.5.1.2制法
将结晶紫溶解于乙醇中,然后与草酸铵溶液混合。革兰氏碘液
A.5.2.1成分
碘化钾
蒸馏水
GB/T26426—2010
将碘与碘化钾先进行混合,加人蒸馏水少许,充分拆摇,待完全溶解后,再加蒸馏水至300mL。A.5.3
沙黄复染液
A.5.3.1成分
95%乙醇
蒸馏水
将沙黄溶解于乙醇中,然后用蒸馏水稀释。A.5.4染色法
将涂片在火焰上固定,滴加结晶紫染色液,染色1min,水洗;滴加革兰氏碘液,作用1min,水洗;滴加95%乙醇脱色,约30s,水洗;滴加沙黄复染液,复染1min,水洗;待干,镜检。A.6
含盐三糖铁琼脂(TSD
A6.1成分
蛋白陈
牛肉膏
酵母膏
GB/T26426—2010
氯化钠
葡葡糖
柠檬酸铁
苯酚红
蒸馏水
A6.2制法
12. 0 g~18. 0 g3免费标准bzxz.net
1000mL
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为7.4士0.2。分装到适当容量的试管中,121℃灭菌15min。制成斜面,斜面长约4.5cm,底部深度约2.5cm。如果培养基放置超过8天,用之前先放人沸水浴10min使之融化,冷却制成斜面。检测鸟氨酸脱羧酶(ODC)含盐培养基A.7
A.7.1成分
L-鸟氨酸盐酸盐
酵母膏
葡萄糖
漠甲酚紫
氯化钠
蒸馏水
A.7.2制法
落解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为6.8士0.2。分装试管,每管2mL~5mL,121℃灭菌15min。A.8
3检测赖氨酸脱羧酶(LDC)含盐培养基A.8.1成分
L-赖氨酸盐酸盐
醇母膏
葡萄糖
溴甲酚紫
氯化钠
A.8.2制法
1000mL
溶解各成分于水中,必要时加热。调整pH值,使培养基pH值在25℃时为6.8士0.2。分装试管,据凝胶强度而定,
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 国家标准
- GB/T2481.2-1998 固结磨具用磨料 粒度组成的检测和标记 第2部分:微粉F230?F1200
- GB/T40094.2-2021 电子商务数据交易第2部分:数据描述规范
- GB/T33588.3-2020 雷电防护系统部件(LPSC)第3部分:隔离放电间隙(ISG)的要求
- GB/T39275-2020 电力电子系统和设备有源馈电变流器(AIC)应用的运行条件和特性
- GB/T39570-2020 电子商务交易产品图像展示要求
- GB/T29077-2024 星箭界面飞行环境遥测数据处理要求
- GB4706.7-1999 家用和类似用途电器的安全真空吸尘器和吸水式清洁器的特殊要求
- GB/T3047.3-2003 高度进制为20mm的插箱、插件基本尺寸系列
- GB9075-1988 架空索道用钢丝绳检验和报废规范
- GB50203-2002 砌体工程施工质量验收规范
- GB15735-2004 金属热处理生产过程安全卫生要求
- GB17378.5-1998 海洋监测规范 第5部分:沉积物分析
- GB/T5190-1985 镍及白铜箔
- GB/T6934-1995 短波单边带接收机电性能测量方法
- GB/T13583-1992 红外探测器外形尺寸系列
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2