- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY/T 0979-2016 一次性使用流产吸引管
标准号:
YY/T 0979-2016
标准名称:
一次性使用流产吸引管
标准类别:
医药行业标准(YY)
标准状态:
现行出版语种:
简体中文下载格式:
.zip .pdf下载大小:
2.30 MB
点击下载
标准简介:
YY/T 0979-2016.Intra-uterine suction curettes for single use.
5.6.2双腔吸引管副管
取装水的注射器- - 支,用注射针从副管任一侧孔注水,另一侧应有水排出,应符合4.6的规定。
5.7无菌
按(中华人民共和国药典四部)(2015 年版)1101无菌检查法进行检验,应符合4.7的规定。
5.8环氧乙烷残留量
按GB/T 14233.1- -2008中的环氧乙烷残留量试验方法进行检验,应符合4.8的规定。
5.9生物学评价
5.9.1细胞毒性
按GB/T 16886.5中的浸提液试验方法进行测试,应符合4.9.1的规定。
5.9.2迟发型超敏反 应
按GB/T 16886.10中的方法进行测试,应符合4.9.2的规定。
5.9.3皮 内刺激试验
按GB/T 16886.10中的方法进行测试,应符合4.9.3 的规定。
6检验规则
6.1验收
吸引管应由制造厂质量检验部门进行检验,合格后方可提交验收。
6.2检验方法
吸引管应成批提交检验,检验分为逐批检验(出厂检验)和周期检验(型式检验)。
6.3逐批检验
6.3.1逐批检验按 GB/T 2828.1中的规定进行。
6.3.2抽样方案采用一次抽样,抽样方案的严格性从正常检验抽样方案开始,其不合格分类、检验组、
6.4周期检验
6.4.1在下列情况下 ,应进行周期检验: .
a)新产 品投产前(包括老产品转厂生产);
b)间隔- -年以上再投产时;
c) 在产品设计.工艺或材料上有重大改变时;
d)连续生产的产 品每两年1次;
e) 国家质量监督检验部门提出要求时。
6.4.2周期检验应 按GB/T 2829的规定进行。
6.4.3周期检验采用一 次抽样方案,其不合格分类、试验组、检验项目、判别水平.不合格质量水平(RQL)和抽样方案按表4的规定(按每百单位产品不合格品数计算)。
部分标准内容:
中华人民共和国医药行业标准
YY/T0979—2016
一次性使用流产吸引管
Intra-uterine suction curettes for single use2016-03-23发布
国家食品药品监督管理总局
2017-01-01实施
本标准按照GB/T1.1一2009给出的规则起草。YY/T0979—2016
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任本标准由国家食品药品监督管理总局提出。本标准由全国计划生育器械标准化技术委员会(SAC/TC169)归口。本标准起草单位:天津市医疗器械厂、国家食品药品监督管理局、上海市医疗器械质量监督检验中心、北京元皓华信科技有限公司。本标准主要起草人:简德洪、姚天平、贾福华、黄书泽、王世元,I
1范围
一次性使用流产吸引管
YY/T0979—2016
本标准规定了一次性使用流产吸引管的结构型式与材料、要求、试验方法、检验规则、标志和使用说明书、包装、运输和贮存。
本标准适用于连接在吸引器上,供早期妊娠的孕妇实行负压吸引手术用的一次性使用流产吸引管(以下简称吸引管)。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T2828.1计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB/T9969工业产品使用说明书总则GB/T14233.1一2008医用输液、输血,注射器具检验方法第1部分:化学分析方法GB/T16886.5医疗器械生物学评价第5部分:体外细胞毒性试验GB/T16886.10医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验YY/T0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求中华人民共和国药典四部(2015年版)3结构型式与材料
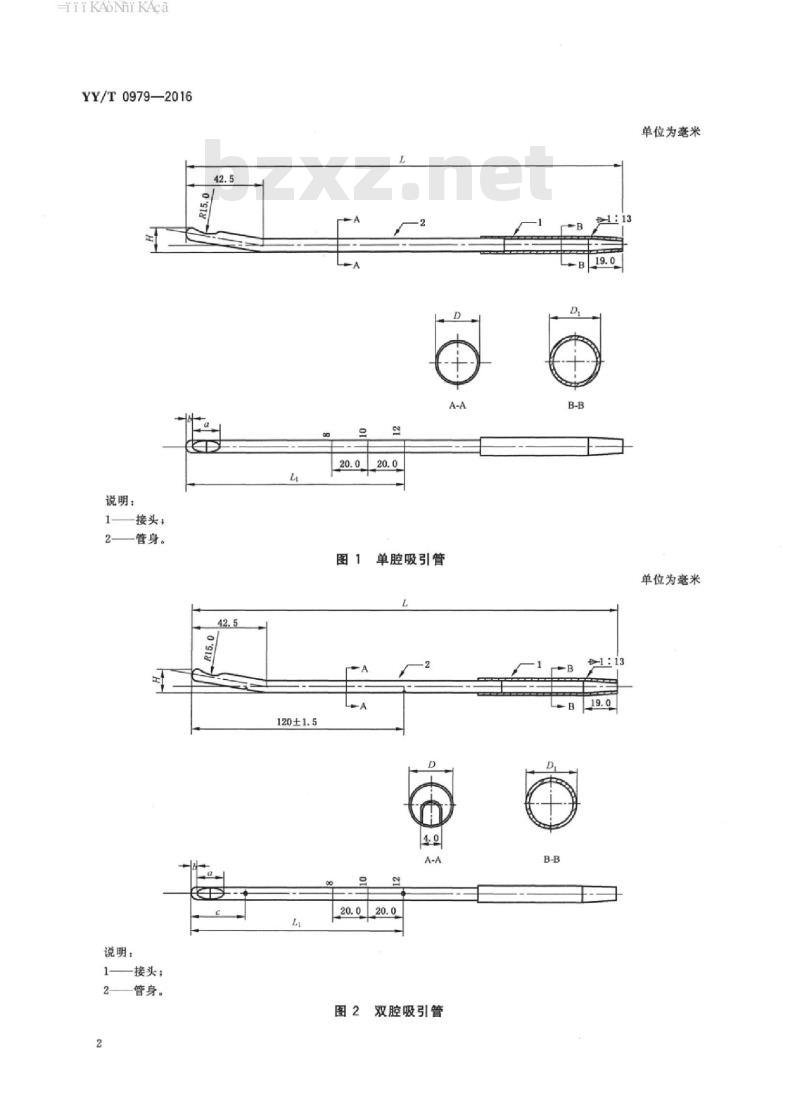
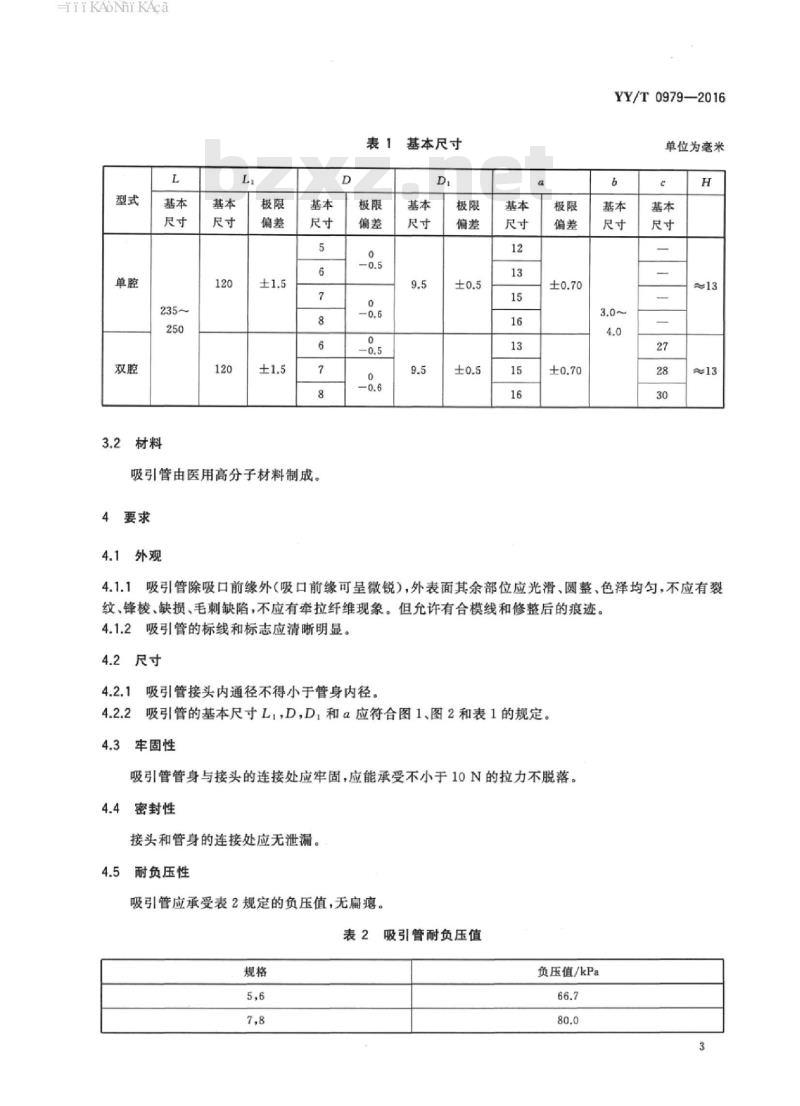
3.1结构型式与基本尺寸
3.1.1吸引管分为单腔吸引管和双腔吸引管。双腔吸引管包括主管和副管。3.1.2吸引管的结构型式和基本尺寸应符合图1、图2和表1的规定。3.1.3规格:
单腔(双腔)
表1或图1、图2中的基本尺寸D
示例:双腔8号表示一次性使用流产吸引管(双腔),规格为8号。1
HiiKAoNiKAca
YY/T0979—2016
说明:
接头,
2——管身。
说明:
一接头:
管身。
单腔吸引管
图2双腔吸引管
单位为毫米
单位为毫米
HiiKAoNiKAca
3.2材料
吸引管由医用高分子材料制成。4要求
4.1外观
表1基本尺寸
YY/T0979—2016
单位为毫米
4.1.1吸引管除吸口前缘外(吸口前缘可呈微锐),外表面其余部位应光滑、圆整、色泽均勾,不应有裂纹、锋棱、缺损、毛刺缺陷,不应有牵拉纤维现象。但允许有合模线和修整后的痕迹。2吸引管的标线和标志应清晰明显。4.1.2
4.2尺寸bzxZ.net
1吸引管接头内通径不得小于管身内径。4.2.2
吸引管的基本尺寸L1,D,D,和a应符合图1、图2和表1的规定。4.3牢固性
吸引管管身与接头的连接处应牢固,应能承受不小于10N的拉力不脱落。4.4密封性
接头和管身的连接处应无泄漏。4.5耐负压性
吸引管应承受表2规定的负压值,无扁癌。吸引管耐负压值
负压值/kPa
HiiKAoNiKAca
YY/T0979—2016
4.6腔道通畅性
吸引管内腔应通畅。
4.7无菌
经一确认过的灭菌过程灭菌,经灭菌后的吸引管应无菌。4.8环氧乙烷残留量
吸引管若采用环氧乙烷灭菌,环氧乙烷的残留量应不大于10μg/g4.9
生物相容性
细胞毒性
细胞毒性应不大于1级。
4.9.2迟发型超敏反应
应无迟发型超敏反应。
4.9.3皮内刺激试验
试验样品与溶剂对照平均记分之差应不大于1.0。5试验方法
5.1外观
用目力观察和脱脂棉擦拭进行检查,应符合4.1.1、4.1.2的规定。5.2尺寸
5.2.1用目力观察进行检查,应符合4.2.1的规定。5.2.2用通用或专用量具检验,应符合4.2.2的规定。5.3牢固性
固定吸引管的管身,在接头处加载10N的轴向拉伸载荷,持续30S,观察接头部位,应符合4.3的规定。
5.4密封性
将吸引管的一端及侧孔封死,浸入(25士2)℃的清水中,从另一端通人20kPa气压持续30S,连接处应无泄漏,应符合4.4的规定。5.5
耐负压性
将吸引管的一端与真空装置连接,另一端密封,在(25土2)℃下,按表2的规定施加负压持续30s,应符合4.5的规定。
HiiKANiKAca
5.6腔道通畅性
5.6.1单双腔吸引管
YY/T0979—2016
取不小于30mL的注射器一支,注射器吸水足量,将吸引管(或双腔吸引管主管)接头端与注射器锥头连接,推动芯杆,使注射器内的水从吸引管吸口端排出,推杆无明显阻力,应符合4.6的规定。5.6.2双腔吸引管副管
取装水的注射器一支,用注射针从副管任一侧孔注水,另一侧应有水排出,应符合4.6的规定。5.7无菌
按《中华人民共和国药典四部》(2015年版)1101无菌检查法进行检验,应符合4.7的规定。3环氧乙烷残留量
按GB/T14233.1一2008中的环氧乙烷残留量试验方法进行检验,应符合4.8的规定。9生物学评价
5.9.1细胞毒性
按GB/T16886.5中的浸提液试验方法进行测试,应符合4.9.1的规定。5.9.2迟发型超敏反应
按GB/T16886.10中的方法进行测试,应符合4.9.2的规定。5.9.3皮内刺激试验
按GB/T16886.10中的方法进行测试,应符合4.9.3的规定。6检验规则
6.1验收
吸引管应由制造广质量检验部门进行检验,合格后方可提交验收。6.2检验方法
吸引管应成批提交检验,检验分为逐批检验(出厂检验)和周期检验(型式检验)。6.3逐批检验
6.3.1逐批检验按GB/T2828.1中的规定进行。6.3.2抽样方案采用一次抽样,抽样方案的严格性从正常检验抽样方案开始,其不合格分类、检验组、检验项目、检验水平和接受质量限(AQL)按表3的规定(按每百单位产品不合格品数计算)。5
HiiKANiKAca
YY/T0979—2016
不合格分类
检验组
检验项目
检验水平
接收质量限(AQL)
周期检验
全部合格
在下列情况下,应进行周期检验:表3
逐批检验
4.3,4.4,4.5,4.6
新产品投产前(包括老产品转厂生产);a)
间隔一年以上再投产时;
在产品设计、工艺或材料上有重大改变时;连续生产的产品每两年1次;
国家质量监督检验部门提出要求时。e)
周期检验应按GB/T2829的规定进行。C类
周期检验采用一次抽样方案,其不合格分类、试验组、检验项目,判别水平、不合格质量水平(RQL)和抽样方案按表4的规定(按每百单位产品不合格品数计算)。表4周期检验
不合格分类
试验组
检验项目
判别水平
不合格质量水平(RQL)
抽样方案
4.7,4.8,4.9
全部合格
重新评价产品的生物学相容性
4.3,4.4,4.5,4.6
在下列任一情况下,应考虑对材料或最终产品重新进行生物学评价(无下列情况可以豁免):制造产品所用材料来源或技术规范改变时;a
产品配方、工艺、初级包装或灭菌改变时;涉及贮存的制造商使用说明书或要求的任何改变,如贮存期和(或)运输改变时;产品预期用途改变时;
有迹象表明产品用于人体后出现了产生不良时。标志和使用说明书
1标志
吸引管标志应符合附录A的规定。6
TiiKAoNiKAca
使用说明书
中包装内应有使用说明书。
使用说明书的编写应符合GB/T9969的规定。使用说明书应包含下列内容:
制造厂名称及地址;
产品批准文号和产品标准号;
产品的使用范围及有关注意事项;产品的性能、制造材料和可能带来的副作用;YY/T0979—2016
保证吸引管正确、安全使用的要求,若与其他器械配套使用的要求和注意事项;产品在使用过程中,当出现意外时,应采取的措施及注意事项;产品标准中规定应具备的内容及说明。8
包装,运输和贴存
8.1包装
吸引管包装应符合附录A的规定。8.2运输
运输要求按订货合同规定。
8.3贮存
包装后的吸引管应存放在相对湿度不大于80%、无腐蚀性气体、清洁和通风良好的常温室内。8.4灭菌失效期
经包装袋密封后灭菌的吸引管,在遵守贮存规则的条件下,应标明从灭菌之日起计算的灭菌失效期。
HiiKAoNiKAca
YY/T0979—2016
A.1标志
A.1.1吸引管的小包装上应有下列标志:a)
制造厂名称和商标;
b)产品名称、规格和数量;
生产批号和生产日期;
灭菌方法和灭菌失效期;
“一次性使用”的字样或图形符号;附录A
(规范性附录)
标志包装
产品注册证号、执行标准号和生产企业许可证号;吸引管标称尺寸(DXa);
醒目的“无菌”字样及“包装破损,严禁使用”字样。吸引管的中包装上应有下列标志:制造厂名称和商标及地址:
产品名称、规格和数量;
生产批号和生产日期;
灭菌方法和灭菌失效期:
产品注册证号、执行标准号和生产企业许可证号;使用说明书。
每个中包装内应附有产品合格证,合格证上应有下列标志:制造厂名称和商标及地址:
检验日期和结论;
执行标准;
d)检验员代号。
产品的外包装箱上标志应清晰,应有下列内容:A.1.4
制造厂名称和商标及地址:
b)产品名称、规格和数量;
c)毛重或净重;
d)体积(长×宽X高));
e)灭菌方法和灭菌失效期;
生产批号和生产日期;
g)产品注册证号、执行标准号和生产企业许可证号;“怕雨”“防湿”、“怕晒”、“堆码层数极限”等字样或标志,应符合YY/T0466.1的规定要求。h)
A.2.1小包装
小包装采用透析纸袋或纸塑袋包装。A.2.2
中包装
中包装采用塑料袋或纸盒包装。A.2.3
外包装
YY/T0979—2016
外包装箱应有封签(带),包装箱应能保证产品在正常的自然条件下不被损坏,并用打包带捆扎牢固。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 热门标准
- YY医药标准
- YY/T1523-2017 二氧化碳测定试剂盒(PEPC酶法)
- YY/T0735.1-2009 ISO 9360-1 :2000 麻醉和呼吸设备湿化人体呼吸气体.的热湿交换器(HME) 第1部分:用于最小潮气量为250 mL的HME
- YY/T0652-2008 ISO 17853 :2003 植入物材料的磨损聚合物和金属材料磨屑分离、表征和定量分析方法
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY0762-2009 眼科光学囊袋张力环
- YY0004-1990 普通胸腔镊
- YY/T0703-2008 IEC 61390: 1996 超声实时脉冲回波系统性能试验方法
- YY/T0211-1995 药用中间体 青霉素钾
- YY/T0663-2008 无源外科植入物 心脏和血管植入物的特殊要求 动脉支架的专用要求
- YY/T0452-2003 止血钳
- YY0003-1990 病床
- YY0476-2004 眼内冲洗灌注液
- YY0781-2010 血压传感器
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T0182-2013 宫内节育器取出钩
- 行业新闻
网站备案号:湘ICP备2025141790号-2