- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 20466-2006 水中微囊藻毒素的测定
标准号:
GB/T 20466-2006
标准名称:
水中微囊藻毒素的测定
标准类别:
国家标准(GB)
标准状态:
现行-
发布日期:
2006-08-24 -
实施日期:
2007-01-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
243.47 KB
标准ICS号:
环保、保健与安全>>>>13.060.50水的化学物质检验中标分类号:
环境保护>>环境保护采样、分析测试方法>>Z16水环境有毒物质分析方法
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了高效液相色谱法和间接竞争酶联免疫吸附法测定水中微囊藻毒素(环状七肽)的条件和详细分析步骤。 本标准适用于饮用水、湖泊水、河水、地表水中微囊藻毒素的测定。 GB/T 20466-2006 水中微囊藻毒素的测定 GB/T20466-2006
部分标准内容:
ICS 13. 060. 50
中华人民共和国国家标准
GB/T20466—2006
水中微囊藻毒素的测定
Determination of microcystins in water2006-08-24发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2007-01-01实施
本标由中国科学院提出,
本标准山全国食品工业标准化技术委员会归口。本标准起草单位:中国科学院水牛生物研究所,言
本标准主要起草人:片南琴、肖邦定、荣立荣、刘永定、陈伟GB/T20466—2006下载标准就来标准下载网
1范围
水中微嘉藻毒素的测定
GB/T20466—2006
本标准见定了高效液相色谱法和间接竞争酶联免疫吸附法测定水中微囊藻毒素(环状七肽)的条件和详细分析步骤。
本标准适用可饮用水、湖泊水、河水、地表水中微寒藻毒素的测定,样品中微囊藻毒素的检出限:高效疲相色谱法和酶联免接吸附法均为 0.1 g/L。2微囊藻毒素的分子式、分子质量及结构式2.1分子式
微龚藻毒素 RR(
LR(MC-LR): C,HA
2.2分子质量
MC RR:1
2.3结构式
MC-RR MC
.Ca,HN.,Oa,微囊藻莓素-YR(MCYR).H.N,O..微囊藻毒素-MC-YR:
MC-RR .MC
3高效液相色谱法
3.1方法提要
、MC-L 中的R, R
微衰藻毒素在波长238nm下有特异的吸收峰。不同的微囊藻毒素异构体在高效液相色谱中有不同的保留时间,与标准微囊毒素的保留时间相比较,可确定样品中微囊藻声素的组成。依据出峰面程,计算水样中微囊藻毒素的含量。3.2试剂和溶液
除非另有规定,仅使用分析纯试剂、蒸馏水或去离子水。1
GB/T 20466—2006
甲酵:色诺纯。
3.2.220%(体积分数)甲醇液:20mL醇(3.2.1)与8)mL水混合,50%(体积分数)甲醇落液:50ml.甲醇(3.2.1)与50ml.水混合3.2.35
磷酸一氢钾溶液(0.05mol/L),称取0.68g磷酸二氢钾,用水溶解,定容至100mL3.2.4
20%(体积分数)磷酸溶液:20ml.磷酸与80mL水混合。3. 2. 5
3.2.6三氟乙酸(TFA):色谱纯,
磷酸盐缓冲溶液:用20%(体积分数)磷酸溶液(3.2.5)将磷酸二氢钾液(3.2.4)调至pH3.0。3. 2.7
3.2.8淋洗溶液:10mL水;10ml.20%体秋分数)甲醇溶液(3.2.2),3.2.9洗脱溶液(酸化甲醇溶液);用中醇(3.2.1)将0.1miL三氟乙酸(3.2.6)定容至100ml。3.2.10微囊藻毒素标准品:微襄苏素-LR(MC-1.R).微囊藻毒素-RR(MC-RR)、微襄毒素-YR(MC-YR),纯度不低于95%。
3.2.11微囊菜毒素标准储备液:分别称取微囊藻毒素标准品(3.2.19)MC1.R、MC-RR、MC-YR各0.5mg(按实际含量折算)用500μL甲醇(3.2.1)溶解,再用纯水定容至50ml.,:20℃保存。此标推储备溶液的浓度约为10g/ml.
3.2.12标准系列溶液:用20(体积分数)甲醇(3.2.2)将微囊莱萨素标准储备溶液(3.2.11)分别稀释至约0.00μg/mL,0.1 μg/ml..0.2μg/mL,0.5μg/ml.,lμg/mL、2ug/ml.5μg/ml.,10μg/inl.(临用时配制):
3.3仪器和设备
3.3.1不锈钢筛:500日。
3.3.2不锈钢或玻璃杯式滤器:250mL,3.3.3抽滤瓶:带真空泵
3.3.4滤膜:GF/C玻璃纤维滤膜和0.45um乙酸纤维酯滤膜。3.3.5Cs固相萃取小柱:Sep-pak柱,500mg/6mL3.3.650mI.玻璃注射器.100ml.玻璃注射器或SPF固相萃取装置。3.3.7旋转蒸发器或吹氮浓缩器:3.3.8祸旋混合器。
3.3.9效液相色谱仪:配有紫外可见光检测器。3.3.10色谱柱:Ci反相柱,柱长250mm内径4.6mm,填料粒经5μm3.4分析步
3.4.1水样的采集和保存
用采水器采集1500ml.--2000ml.水样(水样采集后,应在4h内完成以下前处理步骤)。用500目的不锈钢筛(3.3.1)过滤,除去水样中大部分浮游生物和悬浮物.取过滤后的水样1200mL于玻璃杯式滤器(3.3.2)中.依次经滤膜(3.3.4)减压过滤。准确最取1000ml.滤液置于棕色试剂瓶中,注,如减压过滤后的水样不能立即分析,可置于玻璃容器中,在一20℃保存,30d内分析完哗。3.4.2水样的集和洗脱
3.4.2.1C1固相萃取小柱(3.3.5)预活化用玻璃注射器啵取1UmL甲醇(3.2.1),注人Ci固相萃取小柱(白然滴下)。当甲醇面接近小柱上层筛片时,加人10mL.15rL纯水活化(活化过程,不应使Cis固相萃取小柱变下,萃取小杜中应始终充满液体)。连接50ml.或100mL玻璃注射器,或连接SPE固相萃取装置(3.3.6)。3.4.2.2微囊藻毒素的富集和洗脱将1000mI.水样滤液(3.4.1)依注入50mL玻璃注射器、100mL玻璃注射器或SPE固相萃取装置(3.3.6)中,使水样滤液流经预先活化的C:固相萃取小柱(3.4.2.1)进行富集(控制流速为8mL/rrin--10ml./min)。富集完毕,依次用淋洗辫液(3.2.8)淋洗Ci固相萃取小柱。再用10mL洗2
CB/T20466—2006
脱溶液(3.2,9)洗脱微囊藻毒素(萃取过程.不应使C周相萃取小柱变下.萃取小柱中应始终充满液体。洗脱液收集在玻璃穿器中。保留富集后的水样,用于再次富集,3.4.2.3再次高集和洗脱
按3.4.2.2的操作步骤,再次富集,洗脱。注:有条件的实验室可选样较大柱睿盘的C周相萃取小柱,只需对水样富集、洗脱一次,3.4.3定容
将两次洗脱液混合:在40℃下用旋转蒸发器或吹氮浓缩器(3.3.7)浓缩至干。用1ml.甲醇(3.2.1)分两次(第一次,第二次各0.5mI.)溶解浓缩至十的物质,用涡旋混合器(3.3.8)充分涡旋混合1min。用尖嘴吸管取山,小股氮气流吹于(或离心T燥),加50%(体积分数)甲醇溶液(3.2.3)定容至100I。此步骤均应在玻璃容器中操作。3.4.4测定
3.4.4.1色谱条件
色谱柱温度:40℃;
—流动相:中醇(3.2.1)与磷酸盐缓冲溶液(3.2.7)按体积比(57:43)混合;流速;1 mL/minl
检测器:紫外可见光检测器波长238ntm。3. 4, 4. 2定量
用进样器分别吸取10pL标准系列溶液(3.2.12),注入高效液相色谱仪(3.3.9)。在上述色谱条件(3.1.4.1)下测定标准系列溶液的响应峰面积:以响应峰面积为纵坐标,标准系列溶液的浓度为横坐标,绘制标准曲线或计算回归方程。吸取10μL试样(3.4.3)注人液相色谱仪,在上述色谱条件(3.4.4.1)下测定试样的响应峰面积(应在仪器检测的线性范围内)。依据测定的响应峰面,在标准曲绒上查出(或用回归方程计算出)水样中微藻毒素的含量。
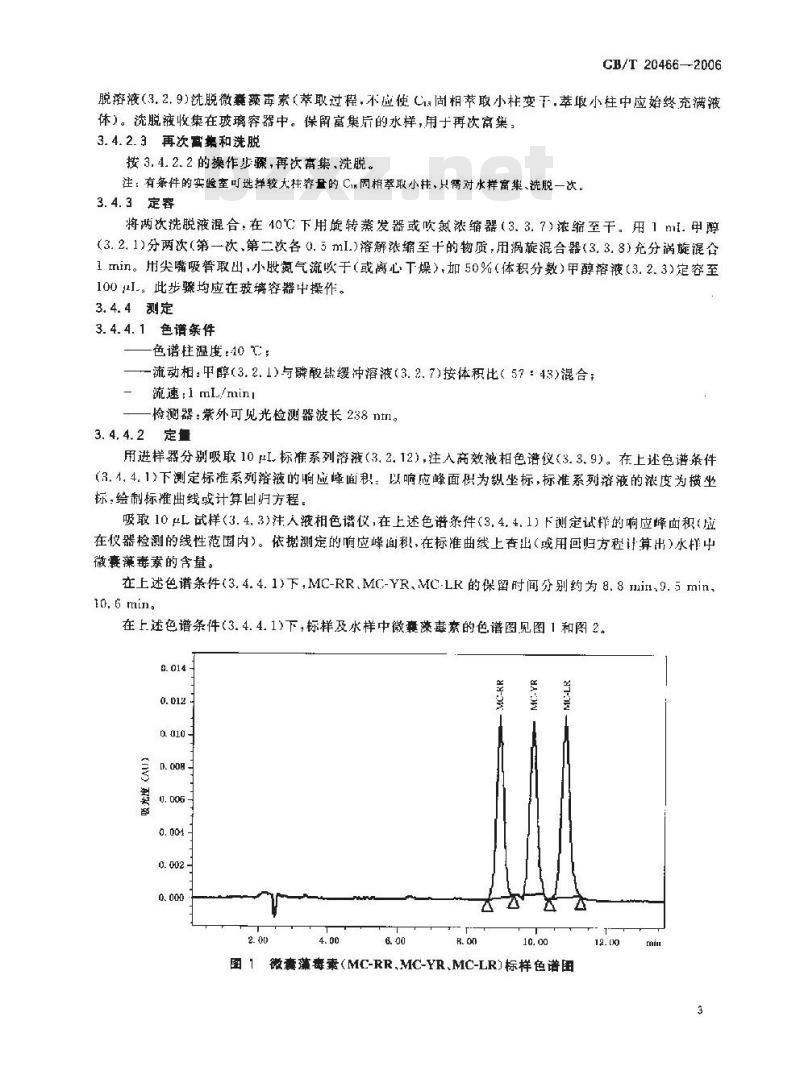
在上述色谱条件(3.4.4.1)下,MC-RR,MC-YR、MC-LK的保留时间分别约为8.8min.9.5 min、10.6mins
在上述色谱条件(3.4.4.1)下,标样及水样中微囊藻毒素的色谱图见图1和图20. 014 -
图1微囊藻毒素(MC-RR,MC-YR、MC-LR)标样色谱围12.00
GB/T20466—2006
-0. 010 -
3.5结果计算
水样中微藏
素的含量
分别西琴
MC-RR,M
从核谁曲线上查出
采集水
计算结果应表
3.6允许差
积数,单
积数值
数点后
1表示孩式(1)
吉果之差,不得超过平均值的10%。同一水样,两次平
间接竞争酶联免疫吸随泌S
每升(g/
C-LR)的含量,单位为微点每亳升方法提要
水中的微囊藻毒素经离心或过滤处理后与一定量的特异性抗体反应,多余的游离抗体则与酶标板内的包被抗原结合。加人酶标记物和底物显色~与标滩微斑莱素比较:计算水样中微囊藻毒素的含量。4.2试剂
除非另有规定仅使用分析纯试剂、蒸馏水或去离子水。4.2.1抗微囊藻毒素(MC-ILR)的单克隆抗体:杂交瘤技术制备,经亲和层析纯化。4.2.2人工抗原:MCI.R牛血清白蛋白结合物(MC-I.R-BSA)。4.2.320%(体积分数)乙醇溶液:20mL乙醇马80ml.水混合。4.2.4标准稀释液:称取0.005g明胶和0.1g登氮化钠,用水溶解,定容至100mL。4.2.5微囊藻毒素(MC-LR)标准系列溶液:称取适量微囊薄毒素(MCI.R)标准品(3.2.10),用20(体积分数)乙醇溶液(4.2.3)配制成MC-1.R含量为0.5mg/mL的溶液。再用标准稀释液(4.2.1)稀4
GB/T 20466-2006
释至MC-LR含量为10 μg/mI.的溶液,继续配制MC-[.R含量分别为0.1 μg/L,0.2 μg/L,0.5μg/I.1g/L、2g/L的标准系列溶液。
4.2.6牛血清白蛋白(BSA):生化试剂。4.2.7酶标一抗:辣根过氧化物酶(HRP)标记山羊抗小鼠1gG。4.2.8磷酸盐缓冲溶液(pH7.1):分别称取0.2磷酸氮二钾、2.9磷酸氢二钠(VazHPO。12H.U)、8.0 g氛化钠,0.2 氯化钾,混合,用水溶解,定容至 1 000 ml4.2.9乙酸钠溶液(0.1m10l/):称取1.36三水合乙酸钠,用水解,定容至100mL。4.2.10乙酸溶液(lml/1.):量取5.88ml.冰乙酸,加水定容至100mL4.2.11硫酸溶波(lma1/1.):量取55.6mlL浓抗酸,措玻棒缓注人约200mL水中,搅拌,冷却至室湿:加水定容至1000mL:
4. 2. 12 包被溶液;称吸 1 mg人至航原(4. 2. 2)解于+gg0 mL磷酸盖缓冲溶羧(4. 2. 8)中。4.2. 13
封闭浴液:你取 0.5R剪膝加少厘磷酸盐缓冲溶液(4.2.8%加热溶解冷却后定容至1 000 mL mL吐温 20,用磷酸盐缓冲溶液~4.2. 8)素容至1 000 rLL。洗漆溶液(PBS-T)凰
抗体稀释溶液:称最明胶,加少量洗涤溶液(1.2.14),加热溶释,玲战定容至1000 1nL。4. 2. 15
二抗溶液:1体原症嘉释溶
底物缓冲溶田乙酸溶液
底物储备溶
底物溶液:
液(4.2.17)。临用时配制
4.3仪器
不锈钢筛
4.3.2高速离心机
4.3.3电动振荡器
4. 3. 4 酶标仪:内1
u底棒
454nm滤光片
培养箱:可授温度,37℃
5酶标微孔板
微量加样器吸头。
4.4分析步骤
4. 4. 1 水样的采集和像
可按 4. 4. 1. 1 或 4. 4
最作。
抗(4.7)混合:
的 pH★5. 0,
二甲基亚城(DSO)中,
过氧化数和10ml.底物缓冲溶
4. 4.1.1采集约5 ml.水能0月的不锈钢筛(3.3.1)过滤于玻璃树式滤器(3.3.2)中(除去水样中大部分浮游生物和悬浮物人两膜(3.3.4)减压过滤,保留滤液,4. 4. 1.2采集约5mL.水样,用39自的不锈钢筛(3.3. 1)过油除去水以用大部分浮游生物和悬泽物),取 1ml.滤液置于离心管中.用度速离心机离元-0s1/min)3 m取上清液保留。注:如减压过滤或离心后的水样不能立即%折,可置于玻璃容器中,在保存,30 d内分析完毕。4.4.2测定
包被酶标微孔板
将包被溶液(4.2.12)加人酶标微孔板(100mL/孔),4℃下放胃过夜4.4.2.2封闭酶标微孔板
用洗涤液(4.2.11)洗涤3次放置过夜的酶标微孔板(每次洗涤3min),加人封闭溶液(4.2.13)封闭酶标微孔板(200μL/孔),37℃下放置2h,或4℃下放置过夜。4.4,2.3抗原抗体反应
以下操作同时进行。
a)鼠取500 μL抗微囊藻市素(MC-L.R)的单克隆抗体(4.2.1)和500μI.微囊藻毒素标准系列溶(4. 2. 5中的 0. 1 社g/L 液)于1. 5 mL试管1.混合后用电动振药器(4.3. 3)振荡.室温静5
GB/T20466—2006
置 30 min。
按以上操作配制其余反应液。这些反应液用于制作徽塞策毒素标准抑制曲线。b)量取500μL抗微囊藻毒素(MC-LR)的单克隆抗体(4.2.1)和500μL水样(4.4.1)于1.5mL试替中,混合后用电动振荡器(4.3.3)振荡,室温静置30min。此反应液用于测定水样中微囊藻毒素的含显。
4.4.2.4竞争反应
用洗涤液(4.2.14)洗涤3次封闭过的酶标微孔板(每次洗涤3min),滴加抗原抗休反应溶液(4.1.2.3)(10μl./孔)。不同浓度做两次平行试验,37℃或室温放置90min。在酶标微孔板的适当孔位滴加抗体稀释溶液(4.2.15),作为阴性对照。4.4.2.5二抗溶液与抗微囊藻毒素(MC-LR)的单克隆抗体反应用洗涤液(4.2.14)洗涤3次竞争反应后的酶标微孔板(每次洗涤3mi),滴加二抗溶液(4.2.16)(100μL/孔).37℃或室温放置30min。4.4.2.6显色及显色后吸光度的确定用洗涤液(4.2.14)洗涤5次经4.4.2.5反应的酶标微孔板(每次洗涤3min).滴加底物溶液(4.2.19)100 μL/孔),37C或室温放置15min--20min,显色。滴加1mol/I.硫酸(4.2.11)(50μL/孔)终止显色反应。
30min内,用酶标仪(4.3.4)在450nm处,测定显色后的吸光度。4. 4. 2.7 定量
取经1.4.2.6测定的标准系列溶波的吸光度平均值与水样吸光度平均值,按式(2)分别计算标准系列溶液吸光度(或水样吸光度)与阴性对照试验的比值(X),其数值以%表示。OD×100
式中:
标准系列溶液吸光度(或水样吸光度)与阴性对照试验的比值,%X
标准系列溶液的吸光度平均值与水样吸光度平均值;OD,
(2)
水样吸光度平均值。
以X,为纵坐标,不同标准系列溶液浓度的对数为横坐标,绘制标准曲线或计算回归方程。依据测定水样的吸光度,在标推曲线上查山(或用回归方程计算出)样品中微藻毒素的含晕。4. 5 结果计算
水样中微囊藻毒素的含量(X>以μg/表示,按式(3)计算:X: = t2 X Va
武中:
X—水样中微囊藻毒素的含最,单位为微克每升(g/L);从标准曲线上查出的微囊藻毒素含量,单位为微克每升(ug/L);G2
V.水样的稀释倍数.
计算结果应表示到小数点后两位。4.6充许差
同-水样,两次平行测定结果之差,不得超过乎均值的10%。5 测定结果的保证与控制
每一测定批次,应使用已知量的样品做测定结果的控制试验。(3)
高效液相色谱法
淼考文献
GB/T 20466—2006
F1l Lawton L, A, , Fdwards C, , Codd G. A. Extiartion and high-perlormance liquid chromatographic method for the determinatinn nf microcystins in raw and trcated waters, Anulyst:1994.119(7):1525-1530.
[2] Ikawa M. ,Phillips N, , Haney J. F. ,et al. Interference by plastics additives in the HPI.Cdeterrnination of micracystin I.R and -YR. Toxicon. 1999, 37(6): 923 929.[3] Ramanan S.,Tang J..Velayudhan A,Isolutiat and preparativc purification of micrucystinvariants.JChromatogrA,2000,883(1):103-112间接竞争酶联免疫吸附法
[i.An J.,Carmichacl W.W. Use of a coloritmetric protein phasphatasc inhiition assay and en-zytne linked immunosorhent assay for the study ol microcystins and nodularins. Toxicon.1994, 32 1495-1507.
L2J Rivasseau C., Racaud P, , Deguin A., et al. Evaluation uf an ELISA Kit for the Manito-ring of Microcystins (Cyanobatterial Toxins) in Water and Algac Environmental Saruples.Environ, Sci. Technol. ,1999, 33(9): 1520-1527.[3] Jarkko R.,Kirsti F..Jaana K., et al, Detection of Microcystins with protein phosphaluseinhihition assay+ high-performancc liguid chrumutogruply UV delection and enzymc-linkedimmunosorbent assay comparison of methods. Analytica Chinica Acta,2002,466:213-231.
GB/T20466-2006
中华人民共和国
国家标准
水中微塞藻毒素的测定
GB/T 20466—2006
中国标准出版杜出版发行
北京复兴广外三里河北街16号
邮瞰编码:100045
网址 www, spc, nel. cn
电话:6852364568517548
中国标准出版社秦阜岛印刷!印刷各地新华书店经销
开木880×12301/16印张0.75字数16千字20C年12月第一版2006年12川第次印别书号:155356:1-28595定价10.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T20466—2006
水中微囊藻毒素的测定
Determination of microcystins in water2006-08-24发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2007-01-01实施
本标由中国科学院提出,
本标准山全国食品工业标准化技术委员会归口。本标准起草单位:中国科学院水牛生物研究所,言
本标准主要起草人:片南琴、肖邦定、荣立荣、刘永定、陈伟GB/T20466—2006下载标准就来标准下载网
1范围
水中微嘉藻毒素的测定
GB/T20466—2006
本标准见定了高效液相色谱法和间接竞争酶联免疫吸附法测定水中微囊藻毒素(环状七肽)的条件和详细分析步骤。
本标准适用可饮用水、湖泊水、河水、地表水中微寒藻毒素的测定,样品中微囊藻毒素的检出限:高效疲相色谱法和酶联免接吸附法均为 0.1 g/L。2微囊藻毒素的分子式、分子质量及结构式2.1分子式
微龚藻毒素 RR(
LR(MC-LR): C,HA
2.2分子质量
MC RR:1
2.3结构式
MC-RR MC
.Ca,HN.,Oa,微囊藻莓素-YR(MCYR).H.N,O..微囊藻毒素-MC-YR:
MC-RR .MC
3高效液相色谱法
3.1方法提要
、MC-L 中的R, R
微衰藻毒素在波长238nm下有特异的吸收峰。不同的微囊藻毒素异构体在高效液相色谱中有不同的保留时间,与标准微囊毒素的保留时间相比较,可确定样品中微囊藻声素的组成。依据出峰面程,计算水样中微囊藻毒素的含量。3.2试剂和溶液
除非另有规定,仅使用分析纯试剂、蒸馏水或去离子水。1
GB/T 20466—2006
甲酵:色诺纯。
3.2.220%(体积分数)甲醇液:20mL醇(3.2.1)与8)mL水混合,50%(体积分数)甲醇落液:50ml.甲醇(3.2.1)与50ml.水混合3.2.35
磷酸一氢钾溶液(0.05mol/L),称取0.68g磷酸二氢钾,用水溶解,定容至100mL3.2.4
20%(体积分数)磷酸溶液:20ml.磷酸与80mL水混合。3. 2. 5
3.2.6三氟乙酸(TFA):色谱纯,
磷酸盐缓冲溶液:用20%(体积分数)磷酸溶液(3.2.5)将磷酸二氢钾液(3.2.4)调至pH3.0。3. 2.7
3.2.8淋洗溶液:10mL水;10ml.20%体秋分数)甲醇溶液(3.2.2),3.2.9洗脱溶液(酸化甲醇溶液);用中醇(3.2.1)将0.1miL三氟乙酸(3.2.6)定容至100ml。3.2.10微囊藻毒素标准品:微襄苏素-LR(MC-1.R).微囊藻毒素-RR(MC-RR)、微襄毒素-YR(MC-YR),纯度不低于95%。
3.2.11微囊菜毒素标准储备液:分别称取微囊藻毒素标准品(3.2.19)MC1.R、MC-RR、MC-YR各0.5mg(按实际含量折算)用500μL甲醇(3.2.1)溶解,再用纯水定容至50ml.,:20℃保存。此标推储备溶液的浓度约为10g/ml.
3.2.12标准系列溶液:用20(体积分数)甲醇(3.2.2)将微囊莱萨素标准储备溶液(3.2.11)分别稀释至约0.00μg/mL,0.1 μg/ml..0.2μg/mL,0.5μg/ml.,lμg/mL、2ug/ml.5μg/ml.,10μg/inl.(临用时配制):
3.3仪器和设备
3.3.1不锈钢筛:500日。
3.3.2不锈钢或玻璃杯式滤器:250mL,3.3.3抽滤瓶:带真空泵
3.3.4滤膜:GF/C玻璃纤维滤膜和0.45um乙酸纤维酯滤膜。3.3.5Cs固相萃取小柱:Sep-pak柱,500mg/6mL3.3.650mI.玻璃注射器.100ml.玻璃注射器或SPF固相萃取装置。3.3.7旋转蒸发器或吹氮浓缩器:3.3.8祸旋混合器。
3.3.9效液相色谱仪:配有紫外可见光检测器。3.3.10色谱柱:Ci反相柱,柱长250mm内径4.6mm,填料粒经5μm3.4分析步
3.4.1水样的采集和保存
用采水器采集1500ml.--2000ml.水样(水样采集后,应在4h内完成以下前处理步骤)。用500目的不锈钢筛(3.3.1)过滤,除去水样中大部分浮游生物和悬浮物.取过滤后的水样1200mL于玻璃杯式滤器(3.3.2)中.依次经滤膜(3.3.4)减压过滤。准确最取1000ml.滤液置于棕色试剂瓶中,注,如减压过滤后的水样不能立即分析,可置于玻璃容器中,在一20℃保存,30d内分析完哗。3.4.2水样的集和洗脱
3.4.2.1C1固相萃取小柱(3.3.5)预活化用玻璃注射器啵取1UmL甲醇(3.2.1),注人Ci固相萃取小柱(白然滴下)。当甲醇面接近小柱上层筛片时,加人10mL.15rL纯水活化(活化过程,不应使Cis固相萃取小柱变下,萃取小杜中应始终充满液体)。连接50ml.或100mL玻璃注射器,或连接SPE固相萃取装置(3.3.6)。3.4.2.2微囊藻毒素的富集和洗脱将1000mI.水样滤液(3.4.1)依注入50mL玻璃注射器、100mL玻璃注射器或SPE固相萃取装置(3.3.6)中,使水样滤液流经预先活化的C:固相萃取小柱(3.4.2.1)进行富集(控制流速为8mL/rrin--10ml./min)。富集完毕,依次用淋洗辫液(3.2.8)淋洗Ci固相萃取小柱。再用10mL洗2
CB/T20466—2006
脱溶液(3.2,9)洗脱微囊藻毒素(萃取过程.不应使C周相萃取小柱变下.萃取小柱中应始终充满液体。洗脱液收集在玻璃穿器中。保留富集后的水样,用于再次富集,3.4.2.3再次高集和洗脱
按3.4.2.2的操作步骤,再次富集,洗脱。注:有条件的实验室可选样较大柱睿盘的C周相萃取小柱,只需对水样富集、洗脱一次,3.4.3定容
将两次洗脱液混合:在40℃下用旋转蒸发器或吹氮浓缩器(3.3.7)浓缩至干。用1ml.甲醇(3.2.1)分两次(第一次,第二次各0.5mI.)溶解浓缩至十的物质,用涡旋混合器(3.3.8)充分涡旋混合1min。用尖嘴吸管取山,小股氮气流吹于(或离心T燥),加50%(体积分数)甲醇溶液(3.2.3)定容至100I。此步骤均应在玻璃容器中操作。3.4.4测定
3.4.4.1色谱条件
色谱柱温度:40℃;
—流动相:中醇(3.2.1)与磷酸盐缓冲溶液(3.2.7)按体积比(57:43)混合;流速;1 mL/minl
检测器:紫外可见光检测器波长238ntm。3. 4, 4. 2定量
用进样器分别吸取10pL标准系列溶液(3.2.12),注入高效液相色谱仪(3.3.9)。在上述色谱条件(3.1.4.1)下测定标准系列溶液的响应峰面积:以响应峰面积为纵坐标,标准系列溶液的浓度为横坐标,绘制标准曲线或计算回归方程。吸取10μL试样(3.4.3)注人液相色谱仪,在上述色谱条件(3.4.4.1)下测定试样的响应峰面积(应在仪器检测的线性范围内)。依据测定的响应峰面,在标准曲绒上查出(或用回归方程计算出)水样中微藻毒素的含量。
在上述色谱条件(3.4.4.1)下,MC-RR,MC-YR、MC-LK的保留时间分别约为8.8min.9.5 min、10.6mins
在上述色谱条件(3.4.4.1)下,标样及水样中微囊藻毒素的色谱图见图1和图20. 014 -
图1微囊藻毒素(MC-RR,MC-YR、MC-LR)标样色谱围12.00
GB/T20466—2006
-0. 010 -
3.5结果计算
水样中微藏
素的含量
分别西琴
MC-RR,M
从核谁曲线上查出
采集水
计算结果应表
3.6允许差
积数,单
积数值
数点后
1表示孩式(1)
吉果之差,不得超过平均值的10%。同一水样,两次平
间接竞争酶联免疫吸随泌S
每升(g/
C-LR)的含量,单位为微点每亳升方法提要
水中的微囊藻毒素经离心或过滤处理后与一定量的特异性抗体反应,多余的游离抗体则与酶标板内的包被抗原结合。加人酶标记物和底物显色~与标滩微斑莱素比较:计算水样中微囊藻毒素的含量。4.2试剂
除非另有规定仅使用分析纯试剂、蒸馏水或去离子水。4.2.1抗微囊藻毒素(MC-ILR)的单克隆抗体:杂交瘤技术制备,经亲和层析纯化。4.2.2人工抗原:MCI.R牛血清白蛋白结合物(MC-I.R-BSA)。4.2.320%(体积分数)乙醇溶液:20mL乙醇马80ml.水混合。4.2.4标准稀释液:称取0.005g明胶和0.1g登氮化钠,用水溶解,定容至100mL。4.2.5微囊藻毒素(MC-LR)标准系列溶液:称取适量微囊薄毒素(MCI.R)标准品(3.2.10),用20(体积分数)乙醇溶液(4.2.3)配制成MC-1.R含量为0.5mg/mL的溶液。再用标准稀释液(4.2.1)稀4
GB/T 20466-2006
释至MC-LR含量为10 μg/mI.的溶液,继续配制MC-[.R含量分别为0.1 μg/L,0.2 μg/L,0.5μg/I.1g/L、2g/L的标准系列溶液。
4.2.6牛血清白蛋白(BSA):生化试剂。4.2.7酶标一抗:辣根过氧化物酶(HRP)标记山羊抗小鼠1gG。4.2.8磷酸盐缓冲溶液(pH7.1):分别称取0.2磷酸氮二钾、2.9磷酸氢二钠(VazHPO。12H.U)、8.0 g氛化钠,0.2 氯化钾,混合,用水溶解,定容至 1 000 ml4.2.9乙酸钠溶液(0.1m10l/):称取1.36三水合乙酸钠,用水解,定容至100mL。4.2.10乙酸溶液(lml/1.):量取5.88ml.冰乙酸,加水定容至100mL4.2.11硫酸溶波(lma1/1.):量取55.6mlL浓抗酸,措玻棒缓注人约200mL水中,搅拌,冷却至室湿:加水定容至1000mL:
4. 2. 12 包被溶液;称吸 1 mg人至航原(4. 2. 2)解于+gg0 mL磷酸盖缓冲溶羧(4. 2. 8)中。4.2. 13
封闭浴液:你取 0.5R剪膝加少厘磷酸盐缓冲溶液(4.2.8%加热溶解冷却后定容至1 000 mL mL吐温 20,用磷酸盐缓冲溶液~4.2. 8)素容至1 000 rLL。洗漆溶液(PBS-T)凰
抗体稀释溶液:称最明胶,加少量洗涤溶液(1.2.14),加热溶释,玲战定容至1000 1nL。4. 2. 15
二抗溶液:1体原症嘉释溶
底物缓冲溶田乙酸溶液
底物储备溶
底物溶液:
液(4.2.17)。临用时配制
4.3仪器
不锈钢筛
4.3.2高速离心机
4.3.3电动振荡器
4. 3. 4 酶标仪:内1
u底棒
454nm滤光片
培养箱:可授温度,37℃
5酶标微孔板
微量加样器吸头。
4.4分析步骤
4. 4. 1 水样的采集和像
可按 4. 4. 1. 1 或 4. 4
最作。
抗(4.7)混合:
的 pH★5. 0,
二甲基亚城(DSO)中,
过氧化数和10ml.底物缓冲溶
4. 4.1.1采集约5 ml.水能0月的不锈钢筛(3.3.1)过滤于玻璃树式滤器(3.3.2)中(除去水样中大部分浮游生物和悬浮物人两膜(3.3.4)减压过滤,保留滤液,4. 4. 1.2采集约5mL.水样,用39自的不锈钢筛(3.3. 1)过油除去水以用大部分浮游生物和悬泽物),取 1ml.滤液置于离心管中.用度速离心机离元-0s1/min)3 m取上清液保留。注:如减压过滤或离心后的水样不能立即%折,可置于玻璃容器中,在保存,30 d内分析完毕。4.4.2测定
包被酶标微孔板
将包被溶液(4.2.12)加人酶标微孔板(100mL/孔),4℃下放胃过夜4.4.2.2封闭酶标微孔板
用洗涤液(4.2.11)洗涤3次放置过夜的酶标微孔板(每次洗涤3min),加人封闭溶液(4.2.13)封闭酶标微孔板(200μL/孔),37℃下放置2h,或4℃下放置过夜。4.4,2.3抗原抗体反应
以下操作同时进行。
a)鼠取500 μL抗微囊藻市素(MC-L.R)的单克隆抗体(4.2.1)和500μI.微囊藻毒素标准系列溶(4. 2. 5中的 0. 1 社g/L 液)于1. 5 mL试管1.混合后用电动振药器(4.3. 3)振荡.室温静5
GB/T20466—2006
置 30 min。
按以上操作配制其余反应液。这些反应液用于制作徽塞策毒素标准抑制曲线。b)量取500μL抗微囊藻毒素(MC-LR)的单克隆抗体(4.2.1)和500μL水样(4.4.1)于1.5mL试替中,混合后用电动振荡器(4.3.3)振荡,室温静置30min。此反应液用于测定水样中微囊藻毒素的含显。
4.4.2.4竞争反应
用洗涤液(4.2.14)洗涤3次封闭过的酶标微孔板(每次洗涤3min),滴加抗原抗休反应溶液(4.1.2.3)(10μl./孔)。不同浓度做两次平行试验,37℃或室温放置90min。在酶标微孔板的适当孔位滴加抗体稀释溶液(4.2.15),作为阴性对照。4.4.2.5二抗溶液与抗微囊藻毒素(MC-LR)的单克隆抗体反应用洗涤液(4.2.14)洗涤3次竞争反应后的酶标微孔板(每次洗涤3mi),滴加二抗溶液(4.2.16)(100μL/孔).37℃或室温放置30min。4.4.2.6显色及显色后吸光度的确定用洗涤液(4.2.14)洗涤5次经4.4.2.5反应的酶标微孔板(每次洗涤3min).滴加底物溶液(4.2.19)100 μL/孔),37C或室温放置15min--20min,显色。滴加1mol/I.硫酸(4.2.11)(50μL/孔)终止显色反应。
30min内,用酶标仪(4.3.4)在450nm处,测定显色后的吸光度。4. 4. 2.7 定量
取经1.4.2.6测定的标准系列溶波的吸光度平均值与水样吸光度平均值,按式(2)分别计算标准系列溶液吸光度(或水样吸光度)与阴性对照试验的比值(X),其数值以%表示。OD×100
式中:
标准系列溶液吸光度(或水样吸光度)与阴性对照试验的比值,%X
标准系列溶液的吸光度平均值与水样吸光度平均值;OD,
(2)
水样吸光度平均值。
以X,为纵坐标,不同标准系列溶液浓度的对数为横坐标,绘制标准曲线或计算回归方程。依据测定水样的吸光度,在标推曲线上查山(或用回归方程计算出)样品中微藻毒素的含晕。4. 5 结果计算
水样中微囊藻毒素的含量(X>以μg/表示,按式(3)计算:X: = t2 X Va
武中:
X—水样中微囊藻毒素的含最,单位为微克每升(g/L);从标准曲线上查出的微囊藻毒素含量,单位为微克每升(ug/L);G2
V.水样的稀释倍数.
计算结果应表示到小数点后两位。4.6充许差
同-水样,两次平行测定结果之差,不得超过乎均值的10%。5 测定结果的保证与控制
每一测定批次,应使用已知量的样品做测定结果的控制试验。(3)
高效液相色谱法
淼考文献
GB/T 20466—2006
F1l Lawton L, A, , Fdwards C, , Codd G. A. Extiartion and high-perlormance liquid chromatographic method for the determinatinn nf microcystins in raw and trcated waters, Anulyst:1994.119(7):1525-1530.
[2] Ikawa M. ,Phillips N, , Haney J. F. ,et al. Interference by plastics additives in the HPI.Cdeterrnination of micracystin I.R and -YR. Toxicon. 1999, 37(6): 923 929.[3] Ramanan S.,Tang J..Velayudhan A,Isolutiat and preparativc purification of micrucystinvariants.JChromatogrA,2000,883(1):103-112间接竞争酶联免疫吸附法
[i.An J.,Carmichacl W.W. Use of a coloritmetric protein phasphatasc inhiition assay and en-zytne linked immunosorhent assay for the study ol microcystins and nodularins. Toxicon.1994, 32 1495-1507.
L2J Rivasseau C., Racaud P, , Deguin A., et al. Evaluation uf an ELISA Kit for the Manito-ring of Microcystins (Cyanobatterial Toxins) in Water and Algac Environmental Saruples.Environ, Sci. Technol. ,1999, 33(9): 1520-1527.[3] Jarkko R.,Kirsti F..Jaana K., et al, Detection of Microcystins with protein phosphaluseinhihition assay+ high-performancc liguid chrumutogruply UV delection and enzymc-linkedimmunosorbent assay comparison of methods. Analytica Chinica Acta,2002,466:213-231.
GB/T20466-2006
中华人民共和国
国家标准
水中微塞藻毒素的测定
GB/T 20466—2006
中国标准出版杜出版发行
北京复兴广外三里河北街16号
邮瞰编码:100045
网址 www, spc, nel. cn
电话:6852364568517548
中国标准出版社秦阜岛印刷!印刷各地新华书店经销
开木880×12301/16印张0.75字数16千字20C年12月第一版2006年12川第次印别书号:155356:1-28595定价10.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 热门标准
- 国家标准(GB)
- GB/T2828.1-2012 计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB50367-2013 混凝土结构加固设计规范
- GB5009.225-2023 食品安全国家标准 酒和食用酒精中乙醇浓度的测定
- GB8552-1987 电子器件详细规范 低功率非线绕固定电阻器 RJ13型金属膜固定电阻器评定水平E(可供认证用)
- GB/T11379-2008 金属覆盖层 工程用铬电镀层
- GB/T23892.3-2009 滑动轴承 稳态条件下流体动压可倾瓦块止推轴承 第3部分:可倾瓦块止推轴承计算的许用值
- GB/T20976-2023 软冰淇淋预拌粉质量要求
- GB/T9145-2003 普通螺纹 中等精度、优选系列的极限尺寸
- GB/T9239-1988 刚性转子平衡品质 许用不平衡的确定
- GB/T15917.3-1995 金属镝及氧化镝化学分析方法 对氯苯基荧光酮--溴化十六烷基三甲基胺分光光度法测定钽量
- GB/T11839-1989 二氧化铀芯块中硼的测定 姜黄素萃取光度法
- GB/T6122.1-2002 圆角铣刀 第1部分:型式和尺寸
- GB/T7433-1987 对称电缆载波通信系统抗无线电广播和通信干扰的指标
- GB/T12053-1989 光学识别用字母数字字符集 第一部分:OCR-A字符集印刷图象的形状和尺寸
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2