- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 医药行业标准(YY) >>
- YY 0057-1991 固体药用聚烯烃塑料瓶
标准号:
YY 0057-1991
标准名称:
固体药用聚烯烃塑料瓶
标准类别:
医药行业标准(YY)
标准状态:
已作废-
发布日期:
1991-11-21 -
实施日期:
1992-03-01 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
323.48 KB
中标分类号:
轻工、文化与生活用品>>日用玻璃、陶瓷、搪瓷、塑料制品>>Y28日用塑料制品
部分标准内容:
中华人民共和国医药行业标准
固体药用聚烯烃塑料瓶
主题内容与适用范围
YY0057—91
本标准规定了药用塑料瓶的材料、技术要求、试验方法、检验规则和标志、包装、运输、贮存要求。本标准适用于包装非芳香性、非油脂性、非挥发性及易氧化的固体药品(片剂、胶衰、制剂)的塑料瓶。
2引用标准
中华人民共和国药典
GB2828逐批检查计数抽样程序及抽样表(适用于连续批的检查)3材料
高密度聚乙烯树脂或聚丙烯树脂为主要原料。4技术要求
4.1药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。瓶的表面应光洁、平整,不允许有变形和明显的擦痕。不允许有砂眼、油污、气泡。瓶口应平整、光滑。4.2物理性能应符合表1规定:
密封性
振荡试验
水蒸气渗透性
4.3化学性能应符合表2规定:
还原性物质
重金属
溶出物试验
不挥发物
水漫液
乙醇漫液
正已烷漫液
不允许泄漏
不允许泄漏
≤100mg/24h·L
消耗0. 02mo1/L高锰酸钾液<1. 0mL≤1.0ppm
≤12.0mg
≤75.0mg
4.4菌检试验应符合以下规定:小于100mL的塑料瓶细菌总数不得超过1500个/瓶,霉菌总数不得超过150个/瓶;100mL至250mL的塑料瓶细菌总数不得超过3000个/瓶,菌总数不得超过300个/瓶;大于250mL的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。所有规格的国家医药管理局1991-11-21批准1992-03-01实施
塑料瓶大肠杆菌均不得检出。
4.5异常毒性:无异常毒性。
5试验方法
5.1外观
在自然光线明亮处目测检验。
5.2密封性试验
YY 0057—91
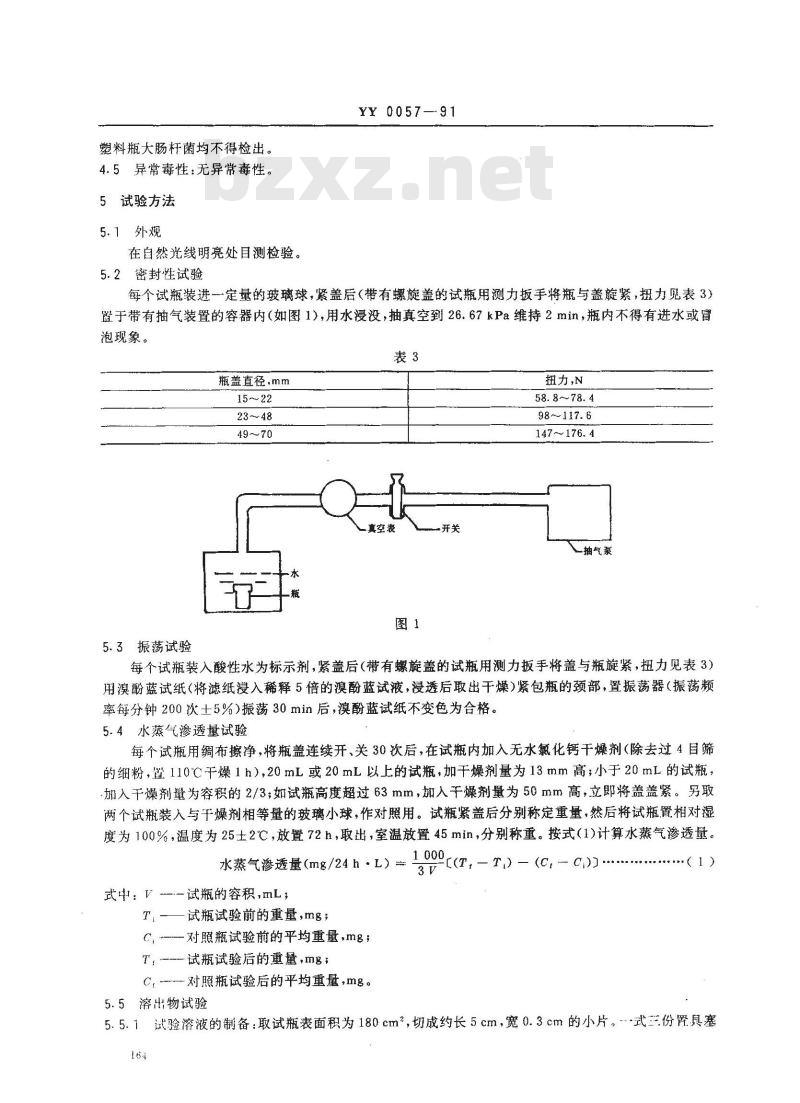
每个试瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内(如图1),用水浸没,抽真空到26.67kPa维持2min,瓶内不得有进水或冒泡现象。
瓶盖直径,mm下载标准就来标准下载网
5.3振荡试验
真空表
扭力,N
58.8~78.4
147~~176. 4
抽气泵
每个试瓶装入酸性水为标示剂,紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率每分钟200次土5%)振荡30min后,溴酚蓝试纸不变色为合格。5.4水蒸气渗透量试验
每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛的细粉,置110℃干燥1h),20mL或20mL以上的试瓶,加干燥剂量为13mm高;小于20mL的试瓶,加入干燥剂量为容积的2/3;如试瓶高度超过63mm,加入千燥剂量为50mm高,立即将盖盖紧。另取两个试瓶装入与燥剂相等量的玻璃小球,作对照用。试瓶紧盖后分别称定重量,然后将试瓶置相对湿度为100%,温度为25士2℃,放置72h,取出,室温放置45min,分别称重。按式(1)计算水蒸气渗透量。10(T- - T.) - (C, - C) .
水蒸气渗透量(mg/24h·L)
式中:-.-试瓶的容积,mL;
T,—试瓶试验前的重量,mg;
C,—对照瓶试验前的平均重量,mg;T,—-试瓶试验后的重量,mg;
C,对照瓶试验后的平均重量,mg。5.5溶出物试验
5.5.1试验溶液的制备:取试瓶表面积为180cm,切成约长5cm,宽0.3cm的小片。式份置具塞164
YY 0057-91
烧瓶中,加水约150mL,振摇洗涤小片,弃去水,重复操作一次,在30~40℃干燥后,分别用水(70℃)、乙醇(70℃)正已烷(58℃)60.0mL浸泡24h,放冷至室温,浸出液作下列试验,以同批水、乙醇、正已烷为对照液。
5.5.2还原性物质,精密量取上述水浸液20.0mL,精密加入0.02mo1/L高锰酸钾液3.0mL,稀硫酸5mL,加热煮沸10min,放冷后,精密加入0.05mL/L草酸钠溶液5.0mL,置水浴上加热至75~~80℃,用0.02mo1/L高锰酸钾液滴定至溶液呈微红色,持续15s不褪色为终点,用对照液作空白校正,两者消耗0.02mo1/L高锰酸钾液之差不得超过1.0mL。5.5.3重金属:精密量取水浸液20.0mL,置纳氏比色管中,用乙酸1mol/L或氢氧化铵6mol1/L调节pH到3.04.0之间,用水稀释到35mL,摇匀,加硫化氢试液10mL,用水稀释至50mL,摇匀,与2.0mL标准铅溶液按同法处理后,在暗处放置10min,同置白纸上,自上方观察,样品管显出的颜色与标准管比较不得更深。
5.5.4标准铅液的制备:精密称取在105℃干燥至恒重的硝酸铅0.1598g,置1000mL容量瓶中,加硝酸5mL与水50mL溶解后,用水稀释至刻度,摇匀,作为贮备液(每1mL相当于0.1mg的Pb)。临用前精密量取贮备液10.0mL,置100mL容量瓶中,加水稀释至刻度,摇匀,即得(每1mL相当于10 μg的Pb))。
5.5.5不挥发物:精密量取上述水、乙醇、正己烷浸出液50.0mL置已恒重的蒸发器中,在水浴中蒸干后,105℃干燥2h,称重,遗留残渣与对照液之间的差,水漫液不得超过12.0mg,乙醇浸液不得超过50.0mg,正己烷浸液不得超过75.0mg。5.6菌检试验
每个试瓶应加入试瓶容积1/3量的无菌生理盐水,将盖盖紧,振摇1min后取1mL,按附录A的方法检验。
5.7异常毒性试验
取试瓶用水清洗干净后,剪碎,每500cm2表面积加入去热原的生理盐水50mL,置高压灭菌器内,110℃灭菌30min取出,放冷备用,同时以同批生理盐水灭菌后作对照液。取17~20g同-来源的健康小白鼠(做过本试验的小白鼠不得重复使用)5只,经尾静脉注射上述试液1mL,用4~~5秒匀速注射完毕,全部小白鼠48h内不得有死亡,如有死亡应另取10只健康小白鼠,体重为18~19g,重复试验,全部小白鼠在 48 h 内不得有死亡。6检验规则
6.1药用塑料瓶的检验必须按GB2828方法进行。6.2药用塑料瓶由制造厂质量检验部门按本标准检验,合格后方可出厂。6.3药用塑料瓶以同一配方,同工艺,同一规格为一批。每批不得多于500000个。6.4抽样方案、检查水平及合格质量水平,见表4。表4抽样方案、检查水平、合格质量水平表检查项目
外观质量
物理性能
密封性
振荡试验
水蒸气渗透性
检查水平
般检查水平
特殊检查水平 s-3
特殊检查水平 S-3
特殊检查水平 S-2
特殊检查水平 S-1
合格质量水平
(AQL)
YY0057-91
6.5异常毒性试验和化学性能应在首批生产或改变原料、配方、工艺时作一次分析,合格后方可投产。化学性能在正常情况下,每三个月检验一次,合格率100%。6.6药用塑料瓶外观质量、物理性能及菌检必须每批进行检验。7标志、包装、运输和贮存
7.1每箱应有产品合格证,并注明生产厂名称、产品名称、规格批号、数量、检验员代号以及生产日期和防潮标志。
7.2产品的包装分内外二层,内层用清洁、防潮材料包装,外层用纸箱包装。7.3药用塑料瓶贮存期内应保管在清洁、干燥、通风、阴凉处。7.4药用塑料瓶运输时,应轻装、轻卸,切勿日晒雨淋,保持包装完整。7.5药用塑料瓶保质期(自生产之日起)二年。166
A1细菌总数测定法
YY 0057—91
附录A
菌检试验方法
(补充件)
细菌总数的测定,是考察供试品每克或每毫升内所污染的活菌数量。测定结果便于判明供试品被细菌污染的程度,以及生产单位所用的药品原料、工具设备和工艺流程、操作者的卫生状况,是对供试品进行卫生学总评价的综合依据。
A1.1供试品的测定
固体供试品,以无菌操作称取若干克,按下列方法之一进行稀释。A1.1.1将已称取供试品置入灭菌乳钵中加入适量稀释剂,充分研磨,然后移至于灭菌三角瓶中,共加入稀释剂100mL,使成1:10均匀供试液。A1.1.2将已称取的供试品连同100mL的稀释剂加入灭菌三角瓶或其他相应容器内,进行振荡,使成1:10的均匀供试液。
液体供试品,可量取10mL加入90mL稀释剂,混匀即得。用1mL灭菌吸管,吸取1:10供试液1mL,沿管壁注入装有9mL灭菌的稀释剂试管内,混匀即为1:100稀释液。
另取1mL灭菌吸管,按上项操作顺序做10倍递增稀释。如此每递增稀释一次,应换用1支1mL灭菌吸管并充分混匀,稀释至10-\或适当倍数备检。另用1mL灭菌吸管1支,按高倍稀释至低倍稀释的顺序分别吸取各稀释度的液体1mL,注入直径9cm的平Ⅲ内,或在做上述10倍递增稀释时,应稀释妥一稀释度,即可取1mL稀释液注入平Ⅲ内。一般可根据对供试品污染情况的估计,从供试液起选择2~3个适宜稀释度进行测定,每个稀释度各用2~3个乎血
稀释液注入平血后,应及时将熔化并冷至45~50℃的肉汤琼脂培养基倾注平Ⅲ内,各约15mL,随即转动平Ⅲ使充分混合均匀。待琼脂凝固后,翻转平板,置37℃培养箱内培养至24h和48h,并分别计算平板内生长的菌落。一般以48h的菌落数为准。为减少片状菌落的干扰,也可采用0.001%TTC琼脂,在无菌室开盖倒置或换灭菌的干燥陶瓦盖等方法使平板表面干燥后,再进行培养。A1.2菌落计数方法
先用肉眼观察,点数菌落数(菌不包括在内),然后持5~10倍放大镜检查有无遗漏。各平板菌落计数后,求出同一稀释度各平板生长的平均菌落数。如平板中有连成片状的菌落或花点样菌落蔓延生长时,该平板不宜计数。
A1.3细菌菌数报告
般的报告方法是选取同一稀释度平均菌落数在30~300之间的平板,作为菌落总数测定的范围。如每个稀释度使用两个平板,应采用两个平板的菌落平均数。其中一个平板有较大片状菌落生长时,或两平板菌落数相差一倍以上,此稀释度不宜采用。如每个稀释度使用三个平板,应采用三个平板菌落数的平均数,其中有两个平板菌落数较接近,另一个平板相差在一倍以上,或有片状菌落生长时,则应采用前者平均数为该稀释度的菌落数,按下列规则乘其稀释倍数报告之。稀释度的选择如下:
8.若只有一个稀释度,平均菌落数在30~300个之间时,乘以稀释倍数报告之(见表A1例1);b.若两个稀释度,其平均菌落数均在30~300个之间,则应求出两者总菌数之比,凡比值小于或167
YY0057---91
等于2应报告其平均数,若大于2则报告其中较小的数字(见表A1例2,3);c:若所有稀释度的平均菌落数均多于300个,则应按稀释度最高的平均菌落数,乘以稀释倍数报告之(见表A1例4)
样。若所有稀释度的平均菌落数均少于30个,则应按稀释倍数最低的平均菌落数,乘以稀释倍数报告之(见表A1例5);
e.若所有稀释度的平均菌落数均不在30~300之间,其中一个稀释度大于300,而相邻的另一稀释度小于30时,则以接近30或300的平均菌落数乘以稀释倍数报告之(见表A1例6);f.若所有稀释度均无菌生长,报告数为<10个/g(mL)。菌数的报告,菌数在100以内时,按实有数报告之,大于100时,采用左端前二位数字,在前两位数字之后的数值,应以四舍五入法计算。为了缩短数字后面零的个数,可用10的指数来表示(见表A1)。如供试品经检验,细菌数不合格,需复验时,应重新取样,依法复试两次,细菌数仍有一次不合格时,则该供试品细菌数应判为不合格。细菌计数结果及报告方法
苹均菌落数
霉菌总数测定法
供试品稀释倍数
不可计
不可计
两稀释度菌落总数
菌数之比个/g(mL)
513000
细菌总数报告方式
个/(mL)
27 000
510000
或1.6×10
或3.8×104
或2.7×104
或5.1×105
或2.7×102
或3.1×104
霉菌总数包括酵母菌)的测定,是考察供试品每克或鲜塞升内所污染活的酵斑菌、霖菌数量,籍以判明供试品的酵母菌、霉菌污染程度及其一般卫生状况。A2、1供试品的测定
供试液与稀释按细菌总数测定项下规定的方法进行。取供试液1:100和1:1000的稀释液各1mL分别注入平Ⅲ内,每个稀释度各用2~3个平Ⅲ,加入稀释液后将熔化并冷至45~50C的虎红琼脂培养基约15mL倾入平Ⅲ内,充分摇勾。凝固后,翻转苹板置25~28℃培养72h,计算平板内生长的馨菌菌落数。若有根霉或毛霉蔓延生长,为避免影响其它霉菌的计数时,应及时将此平板取出计数。A2.2酵母菌、霉菌菌数报告
酵母菌、霉菌计数,应选取带有菌丝体的菌落和酵母菌菌落进行点数。先点清每个平板上生长的菌落数,再求出每一稀释度的平均菌落数。判定结果时,应选取平板上菌落数既清楚可数,平均又在5一50个范围以内的菌落数,乘以稀释倍数后,做为供试品的霉菌总数报告之。若有两个稀释度的菌落数皆在5~50个以内或三个稀释度皆不在此范围之内时,应参照细菌总数测定的规则报告之。一般眼科制剂的细菌、霖菌总数测定按上述方法进行并报告之。如抗生素或有抑菌作用的制剂,采用适宜的方法处理后,按常规方法进行。如供试品经检验,霉菌总数不合格,需复检时,应重新取样,依法复试两次。霉菌数仍有一次不合格时,供试品应判为酵母菌、霉菌数不合格。368
A3大肠杆菌检验法
YY0057—91
大肠杆菌来源于人和温血动物的粪便。凡由供试品中检出大肠杆菌时,表明该药品已被粪便污染,愚者服用后,有被粪便中可能存在的其它肠道致病菌和寄生虫卵等病源体感染的危险。因此,大肠杆菌被列为重要的卫生指标菌,是非规定灭菌口服药品的常规必检项目之一大肠杆菌检验程序见下图解:
供试品
供试渡
胆盐乳糖增蘑
37 c 18 ~ 24 h
MacC平板或EMB平板
37c18~ 24 h
纯培养
37℃18~24h
染色、镜检
IMVC试验
图A1大肠杆菌检验程序
A3.1增菌培养
乳糖发醇
取供试液10mL,接种于备妥的10emL胆盐乳糖增菌液内。置37℃培养18~24h,进行增菌。A3.2分离培养
将上述增菌培养物,划线接种于麦康凯琼脂(M。C)或伊红美兰(EMB)琼脂平板上,置37C培养1824h,检查有无疑似大肠杆菌菌落。大肠杆菌在麦康凯平板上的典型菌落呈鲜艳的桃红、粉红色;在伊红美兰平板上的典型菌落呈紫黑色,圆形,边缘整齐,表面光滑湿润,常有金属光泽。由于药物影响,亦呈现紫色、粉紫、中心灰紫、无黑心、湿润等,常为大肠杆菌,均应注意挑选。A3.3纯培养
至少挑选2~3个疑似大肠杆菌菌落,分别接种于肉汤琼脂斜面或三糖(双糖)铁琼脂斜面,置37C培养 18~24 h。
A3.4染色镜检
将疑似大肠杆菌的纯培养物涂片、革兰氏染色。经染色镜检证明,为革兰氏阴性短杆菌者,应继续做生化试验。
A3.5生化试验
A3.5.1乳糖发酵试验
YY 0057 --- 91
将上述纯培养物接种于乳糖发酵管,置37℃培养24~48h,凡大肠杆菌,可发酵乳糖产酸产气,或产酸不产气时,加用酸性复红指示剂的应显红色;加BTB指示剂时显蓝色。产气者,倒管内有气泡。A3.5.2IMV.C试验
A3.5.2.1靛基质试验:将纯培养物接种于蛋白陈水,置37℃培养24~48h,沿管壁加柯凡克氏试剂0.3~0.5mL,轻微摇动,静置片刻,观察液面。阳性反应,液面皇玫瑰红色;阴性反应液面呈试剂本色。A3.5.2.2甲基红试验:将纯培养的菌苔接种于磷酸盐葡萄糖蛋白陈水培养基内,置37℃培养24~48h,加入甲基红试剂数滴,观察结果。阳性反应呈鲜红色或桔红色;阴性反应呈黄色。A3.5.2.3V-P试验:将纯培养物接种于磷酸盐葡萄糖蛋白陈水培养基内,置37℃培养48h,按培立脱法先加6%α-萘酚无水乙醇溶液1mL,再加40%的氢氧化钾溶液0.4mL,轻摇后观察结果。阳性反应,加入试剂后,应在15min内显红色、深红色。如不明显,可延长至4h。A3.5.2.4枸橼酸盐利用试验:将纯培养的菌苔接种于西蒙氏枸橼酸盐琼脂斜面,37℃培养24h,观察结果。阳性反应,斜面有菌苔生长,培养基由绿色变为蓝色。阴性反应斜面无菌苔生长,培养基仍为绿色。当见有微量或痕迹生长的可疑现象时,应将待检菌株分离,纯化后再行试验。A3.6供试品检验报告
供试品增菌后,在麦康凯或伊红美兰琼脂平板上分离的疑似大肠杆菌,经证实为革兰氏阴性短杆菌,乳糖发酵试验阳性,IMV,C试验呈“十十一”或“-+一一”反应者,应即报告供试品检出大肠杆菌。
注;①大肠杆菌及其他致病菌检查按一次检出结果为准,不再抽样复试。②关于大肠杆菌的IMV,C反应的说明:大肠杆菌IMV,C 试验的模式反应,在一般情况下应为“++一—”或将“—+”也包括在内,共代表了绝大多数大肠杆菌(占99%)的实际反应结果,因而受到了国际上的广泛承认,并将其列为大肠杆菌的常规鉴别 IMV,C 反应公式。但个别大肠杆菌的 IMV,C 反应,也可能出现*+一一一\和\++一+”等等异常现象。由于这种异常反应出现的频率极少,没有普遍性的代表意义因而在分类鉴别和统计学上,可以忽略不计。
附加说明:
本标准由上海医药工业研究院、浙江省药品检验所起草。本标准由国家医药管理局包装科研检测中心归口。170
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
固体药用聚烯烃塑料瓶
主题内容与适用范围
YY0057—91
本标准规定了药用塑料瓶的材料、技术要求、试验方法、检验规则和标志、包装、运输、贮存要求。本标准适用于包装非芳香性、非油脂性、非挥发性及易氧化的固体药品(片剂、胶衰、制剂)的塑料瓶。
2引用标准
中华人民共和国药典
GB2828逐批检查计数抽样程序及抽样表(适用于连续批的检查)3材料
高密度聚乙烯树脂或聚丙烯树脂为主要原料。4技术要求
4.1药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。瓶的表面应光洁、平整,不允许有变形和明显的擦痕。不允许有砂眼、油污、气泡。瓶口应平整、光滑。4.2物理性能应符合表1规定:
密封性
振荡试验
水蒸气渗透性
4.3化学性能应符合表2规定:
还原性物质
重金属
溶出物试验
不挥发物
水漫液
乙醇漫液
正已烷漫液
不允许泄漏
不允许泄漏
≤100mg/24h·L
消耗0. 02mo1/L高锰酸钾液<1. 0mL≤1.0ppm
≤12.0mg
≤75.0mg
4.4菌检试验应符合以下规定:小于100mL的塑料瓶细菌总数不得超过1500个/瓶,霉菌总数不得超过150个/瓶;100mL至250mL的塑料瓶细菌总数不得超过3000个/瓶,菌总数不得超过300个/瓶;大于250mL的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。所有规格的国家医药管理局1991-11-21批准1992-03-01实施
塑料瓶大肠杆菌均不得检出。
4.5异常毒性:无异常毒性。
5试验方法
5.1外观
在自然光线明亮处目测检验。
5.2密封性试验
YY 0057—91
每个试瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内(如图1),用水浸没,抽真空到26.67kPa维持2min,瓶内不得有进水或冒泡现象。
瓶盖直径,mm下载标准就来标准下载网
5.3振荡试验
真空表
扭力,N
58.8~78.4
147~~176. 4
抽气泵
每个试瓶装入酸性水为标示剂,紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率每分钟200次土5%)振荡30min后,溴酚蓝试纸不变色为合格。5.4水蒸气渗透量试验
每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛的细粉,置110℃干燥1h),20mL或20mL以上的试瓶,加干燥剂量为13mm高;小于20mL的试瓶,加入干燥剂量为容积的2/3;如试瓶高度超过63mm,加入千燥剂量为50mm高,立即将盖盖紧。另取两个试瓶装入与燥剂相等量的玻璃小球,作对照用。试瓶紧盖后分别称定重量,然后将试瓶置相对湿度为100%,温度为25士2℃,放置72h,取出,室温放置45min,分别称重。按式(1)计算水蒸气渗透量。10(T- - T.) - (C, - C) .
水蒸气渗透量(mg/24h·L)
式中:-.-试瓶的容积,mL;
T,—试瓶试验前的重量,mg;
C,—对照瓶试验前的平均重量,mg;T,—-试瓶试验后的重量,mg;
C,对照瓶试验后的平均重量,mg。5.5溶出物试验
5.5.1试验溶液的制备:取试瓶表面积为180cm,切成约长5cm,宽0.3cm的小片。式份置具塞164
YY 0057-91
烧瓶中,加水约150mL,振摇洗涤小片,弃去水,重复操作一次,在30~40℃干燥后,分别用水(70℃)、乙醇(70℃)正已烷(58℃)60.0mL浸泡24h,放冷至室温,浸出液作下列试验,以同批水、乙醇、正已烷为对照液。
5.5.2还原性物质,精密量取上述水浸液20.0mL,精密加入0.02mo1/L高锰酸钾液3.0mL,稀硫酸5mL,加热煮沸10min,放冷后,精密加入0.05mL/L草酸钠溶液5.0mL,置水浴上加热至75~~80℃,用0.02mo1/L高锰酸钾液滴定至溶液呈微红色,持续15s不褪色为终点,用对照液作空白校正,两者消耗0.02mo1/L高锰酸钾液之差不得超过1.0mL。5.5.3重金属:精密量取水浸液20.0mL,置纳氏比色管中,用乙酸1mol/L或氢氧化铵6mol1/L调节pH到3.04.0之间,用水稀释到35mL,摇匀,加硫化氢试液10mL,用水稀释至50mL,摇匀,与2.0mL标准铅溶液按同法处理后,在暗处放置10min,同置白纸上,自上方观察,样品管显出的颜色与标准管比较不得更深。
5.5.4标准铅液的制备:精密称取在105℃干燥至恒重的硝酸铅0.1598g,置1000mL容量瓶中,加硝酸5mL与水50mL溶解后,用水稀释至刻度,摇匀,作为贮备液(每1mL相当于0.1mg的Pb)。临用前精密量取贮备液10.0mL,置100mL容量瓶中,加水稀释至刻度,摇匀,即得(每1mL相当于10 μg的Pb))。
5.5.5不挥发物:精密量取上述水、乙醇、正己烷浸出液50.0mL置已恒重的蒸发器中,在水浴中蒸干后,105℃干燥2h,称重,遗留残渣与对照液之间的差,水漫液不得超过12.0mg,乙醇浸液不得超过50.0mg,正己烷浸液不得超过75.0mg。5.6菌检试验
每个试瓶应加入试瓶容积1/3量的无菌生理盐水,将盖盖紧,振摇1min后取1mL,按附录A的方法检验。
5.7异常毒性试验
取试瓶用水清洗干净后,剪碎,每500cm2表面积加入去热原的生理盐水50mL,置高压灭菌器内,110℃灭菌30min取出,放冷备用,同时以同批生理盐水灭菌后作对照液。取17~20g同-来源的健康小白鼠(做过本试验的小白鼠不得重复使用)5只,经尾静脉注射上述试液1mL,用4~~5秒匀速注射完毕,全部小白鼠48h内不得有死亡,如有死亡应另取10只健康小白鼠,体重为18~19g,重复试验,全部小白鼠在 48 h 内不得有死亡。6检验规则
6.1药用塑料瓶的检验必须按GB2828方法进行。6.2药用塑料瓶由制造厂质量检验部门按本标准检验,合格后方可出厂。6.3药用塑料瓶以同一配方,同工艺,同一规格为一批。每批不得多于500000个。6.4抽样方案、检查水平及合格质量水平,见表4。表4抽样方案、检查水平、合格质量水平表检查项目
外观质量
物理性能
密封性
振荡试验
水蒸气渗透性
检查水平
般检查水平
特殊检查水平 s-3
特殊检查水平 S-3
特殊检查水平 S-2
特殊检查水平 S-1
合格质量水平
(AQL)
YY0057-91
6.5异常毒性试验和化学性能应在首批生产或改变原料、配方、工艺时作一次分析,合格后方可投产。化学性能在正常情况下,每三个月检验一次,合格率100%。6.6药用塑料瓶外观质量、物理性能及菌检必须每批进行检验。7标志、包装、运输和贮存
7.1每箱应有产品合格证,并注明生产厂名称、产品名称、规格批号、数量、检验员代号以及生产日期和防潮标志。
7.2产品的包装分内外二层,内层用清洁、防潮材料包装,外层用纸箱包装。7.3药用塑料瓶贮存期内应保管在清洁、干燥、通风、阴凉处。7.4药用塑料瓶运输时,应轻装、轻卸,切勿日晒雨淋,保持包装完整。7.5药用塑料瓶保质期(自生产之日起)二年。166
A1细菌总数测定法
YY 0057—91
附录A
菌检试验方法
(补充件)
细菌总数的测定,是考察供试品每克或每毫升内所污染的活菌数量。测定结果便于判明供试品被细菌污染的程度,以及生产单位所用的药品原料、工具设备和工艺流程、操作者的卫生状况,是对供试品进行卫生学总评价的综合依据。
A1.1供试品的测定
固体供试品,以无菌操作称取若干克,按下列方法之一进行稀释。A1.1.1将已称取供试品置入灭菌乳钵中加入适量稀释剂,充分研磨,然后移至于灭菌三角瓶中,共加入稀释剂100mL,使成1:10均匀供试液。A1.1.2将已称取的供试品连同100mL的稀释剂加入灭菌三角瓶或其他相应容器内,进行振荡,使成1:10的均匀供试液。
液体供试品,可量取10mL加入90mL稀释剂,混匀即得。用1mL灭菌吸管,吸取1:10供试液1mL,沿管壁注入装有9mL灭菌的稀释剂试管内,混匀即为1:100稀释液。
另取1mL灭菌吸管,按上项操作顺序做10倍递增稀释。如此每递增稀释一次,应换用1支1mL灭菌吸管并充分混匀,稀释至10-\或适当倍数备检。另用1mL灭菌吸管1支,按高倍稀释至低倍稀释的顺序分别吸取各稀释度的液体1mL,注入直径9cm的平Ⅲ内,或在做上述10倍递增稀释时,应稀释妥一稀释度,即可取1mL稀释液注入平Ⅲ内。一般可根据对供试品污染情况的估计,从供试液起选择2~3个适宜稀释度进行测定,每个稀释度各用2~3个乎血
稀释液注入平血后,应及时将熔化并冷至45~50℃的肉汤琼脂培养基倾注平Ⅲ内,各约15mL,随即转动平Ⅲ使充分混合均匀。待琼脂凝固后,翻转平板,置37℃培养箱内培养至24h和48h,并分别计算平板内生长的菌落。一般以48h的菌落数为准。为减少片状菌落的干扰,也可采用0.001%TTC琼脂,在无菌室开盖倒置或换灭菌的干燥陶瓦盖等方法使平板表面干燥后,再进行培养。A1.2菌落计数方法
先用肉眼观察,点数菌落数(菌不包括在内),然后持5~10倍放大镜检查有无遗漏。各平板菌落计数后,求出同一稀释度各平板生长的平均菌落数。如平板中有连成片状的菌落或花点样菌落蔓延生长时,该平板不宜计数。
A1.3细菌菌数报告
般的报告方法是选取同一稀释度平均菌落数在30~300之间的平板,作为菌落总数测定的范围。如每个稀释度使用两个平板,应采用两个平板的菌落平均数。其中一个平板有较大片状菌落生长时,或两平板菌落数相差一倍以上,此稀释度不宜采用。如每个稀释度使用三个平板,应采用三个平板菌落数的平均数,其中有两个平板菌落数较接近,另一个平板相差在一倍以上,或有片状菌落生长时,则应采用前者平均数为该稀释度的菌落数,按下列规则乘其稀释倍数报告之。稀释度的选择如下:
8.若只有一个稀释度,平均菌落数在30~300个之间时,乘以稀释倍数报告之(见表A1例1);b.若两个稀释度,其平均菌落数均在30~300个之间,则应求出两者总菌数之比,凡比值小于或167
YY0057---91
等于2应报告其平均数,若大于2则报告其中较小的数字(见表A1例2,3);c:若所有稀释度的平均菌落数均多于300个,则应按稀释度最高的平均菌落数,乘以稀释倍数报告之(见表A1例4)
样。若所有稀释度的平均菌落数均少于30个,则应按稀释倍数最低的平均菌落数,乘以稀释倍数报告之(见表A1例5);
e.若所有稀释度的平均菌落数均不在30~300之间,其中一个稀释度大于300,而相邻的另一稀释度小于30时,则以接近30或300的平均菌落数乘以稀释倍数报告之(见表A1例6);f.若所有稀释度均无菌生长,报告数为<10个/g(mL)。菌数的报告,菌数在100以内时,按实有数报告之,大于100时,采用左端前二位数字,在前两位数字之后的数值,应以四舍五入法计算。为了缩短数字后面零的个数,可用10的指数来表示(见表A1)。如供试品经检验,细菌数不合格,需复验时,应重新取样,依法复试两次,细菌数仍有一次不合格时,则该供试品细菌数应判为不合格。细菌计数结果及报告方法
苹均菌落数
霉菌总数测定法
供试品稀释倍数
不可计
不可计
两稀释度菌落总数
菌数之比个/g(mL)
513000
细菌总数报告方式
个/(mL)
27 000
510000
或1.6×10
或3.8×104
或2.7×104
或5.1×105
或2.7×102
或3.1×104
霉菌总数包括酵母菌)的测定,是考察供试品每克或鲜塞升内所污染活的酵斑菌、霖菌数量,籍以判明供试品的酵母菌、霉菌污染程度及其一般卫生状况。A2、1供试品的测定
供试液与稀释按细菌总数测定项下规定的方法进行。取供试液1:100和1:1000的稀释液各1mL分别注入平Ⅲ内,每个稀释度各用2~3个平Ⅲ,加入稀释液后将熔化并冷至45~50C的虎红琼脂培养基约15mL倾入平Ⅲ内,充分摇勾。凝固后,翻转苹板置25~28℃培养72h,计算平板内生长的馨菌菌落数。若有根霉或毛霉蔓延生长,为避免影响其它霉菌的计数时,应及时将此平板取出计数。A2.2酵母菌、霉菌菌数报告
酵母菌、霉菌计数,应选取带有菌丝体的菌落和酵母菌菌落进行点数。先点清每个平板上生长的菌落数,再求出每一稀释度的平均菌落数。判定结果时,应选取平板上菌落数既清楚可数,平均又在5一50个范围以内的菌落数,乘以稀释倍数后,做为供试品的霉菌总数报告之。若有两个稀释度的菌落数皆在5~50个以内或三个稀释度皆不在此范围之内时,应参照细菌总数测定的规则报告之。一般眼科制剂的细菌、霖菌总数测定按上述方法进行并报告之。如抗生素或有抑菌作用的制剂,采用适宜的方法处理后,按常规方法进行。如供试品经检验,霉菌总数不合格,需复检时,应重新取样,依法复试两次。霉菌数仍有一次不合格时,供试品应判为酵母菌、霉菌数不合格。368
A3大肠杆菌检验法
YY0057—91
大肠杆菌来源于人和温血动物的粪便。凡由供试品中检出大肠杆菌时,表明该药品已被粪便污染,愚者服用后,有被粪便中可能存在的其它肠道致病菌和寄生虫卵等病源体感染的危险。因此,大肠杆菌被列为重要的卫生指标菌,是非规定灭菌口服药品的常规必检项目之一大肠杆菌检验程序见下图解:
供试品
供试渡
胆盐乳糖增蘑
37 c 18 ~ 24 h
MacC平板或EMB平板
37c18~ 24 h
纯培养
37℃18~24h
染色、镜检
IMVC试验
图A1大肠杆菌检验程序
A3.1增菌培养
乳糖发醇
取供试液10mL,接种于备妥的10emL胆盐乳糖增菌液内。置37℃培养18~24h,进行增菌。A3.2分离培养
将上述增菌培养物,划线接种于麦康凯琼脂(M。C)或伊红美兰(EMB)琼脂平板上,置37C培养1824h,检查有无疑似大肠杆菌菌落。大肠杆菌在麦康凯平板上的典型菌落呈鲜艳的桃红、粉红色;在伊红美兰平板上的典型菌落呈紫黑色,圆形,边缘整齐,表面光滑湿润,常有金属光泽。由于药物影响,亦呈现紫色、粉紫、中心灰紫、无黑心、湿润等,常为大肠杆菌,均应注意挑选。A3.3纯培养
至少挑选2~3个疑似大肠杆菌菌落,分别接种于肉汤琼脂斜面或三糖(双糖)铁琼脂斜面,置37C培养 18~24 h。
A3.4染色镜检
将疑似大肠杆菌的纯培养物涂片、革兰氏染色。经染色镜检证明,为革兰氏阴性短杆菌者,应继续做生化试验。
A3.5生化试验
A3.5.1乳糖发酵试验
YY 0057 --- 91
将上述纯培养物接种于乳糖发酵管,置37℃培养24~48h,凡大肠杆菌,可发酵乳糖产酸产气,或产酸不产气时,加用酸性复红指示剂的应显红色;加BTB指示剂时显蓝色。产气者,倒管内有气泡。A3.5.2IMV.C试验
A3.5.2.1靛基质试验:将纯培养物接种于蛋白陈水,置37℃培养24~48h,沿管壁加柯凡克氏试剂0.3~0.5mL,轻微摇动,静置片刻,观察液面。阳性反应,液面皇玫瑰红色;阴性反应液面呈试剂本色。A3.5.2.2甲基红试验:将纯培养的菌苔接种于磷酸盐葡萄糖蛋白陈水培养基内,置37℃培养24~48h,加入甲基红试剂数滴,观察结果。阳性反应呈鲜红色或桔红色;阴性反应呈黄色。A3.5.2.3V-P试验:将纯培养物接种于磷酸盐葡萄糖蛋白陈水培养基内,置37℃培养48h,按培立脱法先加6%α-萘酚无水乙醇溶液1mL,再加40%的氢氧化钾溶液0.4mL,轻摇后观察结果。阳性反应,加入试剂后,应在15min内显红色、深红色。如不明显,可延长至4h。A3.5.2.4枸橼酸盐利用试验:将纯培养的菌苔接种于西蒙氏枸橼酸盐琼脂斜面,37℃培养24h,观察结果。阳性反应,斜面有菌苔生长,培养基由绿色变为蓝色。阴性反应斜面无菌苔生长,培养基仍为绿色。当见有微量或痕迹生长的可疑现象时,应将待检菌株分离,纯化后再行试验。A3.6供试品检验报告
供试品增菌后,在麦康凯或伊红美兰琼脂平板上分离的疑似大肠杆菌,经证实为革兰氏阴性短杆菌,乳糖发酵试验阳性,IMV,C试验呈“十十一”或“-+一一”反应者,应即报告供试品检出大肠杆菌。
注;①大肠杆菌及其他致病菌检查按一次检出结果为准,不再抽样复试。②关于大肠杆菌的IMV,C反应的说明:大肠杆菌IMV,C 试验的模式反应,在一般情况下应为“++一—”或将“—+”也包括在内,共代表了绝大多数大肠杆菌(占99%)的实际反应结果,因而受到了国际上的广泛承认,并将其列为大肠杆菌的常规鉴别 IMV,C 反应公式。但个别大肠杆菌的 IMV,C 反应,也可能出现*+一一一\和\++一+”等等异常现象。由于这种异常反应出现的频率极少,没有普遍性的代表意义因而在分类鉴别和统计学上,可以忽略不计。
附加说明:
本标准由上海医药工业研究院、浙江省药品检验所起草。本标准由国家医药管理局包装科研检测中心归口。170
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 医药行业标准(YY)
- YY0345-2002 骨接合植入物金属骨针
- YY/T1636-2018 组织工程医疗器械产品再生膝关节软骨的体内磁共振评价方法
- YY/T0452-2003 止血钳
- YY0062-1991 X射线管组件固有滤过
- YY/T0457.6-2003 医用电气设备 光电X射线影像增强器特性 第6部分:对比度及炫光系数的测定
- YY0476-2004 眼内冲洗灌注液
- YY0714.1-2009 牙科学 活动义齿软衬材料 第1部分:短期使用材料
- YY/T0916.1-2014 医用液体和气体用小孔径连接件 第1部分:通用要求
- YY/T1533-2017 全自动时间分辨荧光免疫分析仪
- YY/T0179-2005 丁字式开口器
- YY0322-2000 高频电灼治疗仪
- YY0320-2000 麻醉机
- YY/T0268-2001 牙科学 用于口腔的医疗器械生物相容性临床前评价 第1单:评价与试验项目选择
- YY0011-1990 X射线摄影暗匣
- YY0014-1990 生化分析仪
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2