- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB 5009.255-2016 食品安全国家标准 食品中果聚糖的测定
标准号:
GB 5009.255-2016
标准名称:
食品安全国家标准 食品中果聚糖的测定
标准类别:
国家标准(GB)
标准状态:
现行出版语种:
简体中文下载格式:
.rar .pdf下载大小:
部分标准内容:
中华人民共和国国家标准
GB5009.255—2016
食品安全国家标准
食品中果聚糖的测定
2016-08-31发布
人民共和国
国家卫生和计划生育委员会
2017-03-01实施
1范围
食品安全国家标准
食品中果聚糖的测定
本标准规定了食品中果聚糖含量的离子色谱法测定方法。GB5009.255—2016
本标准适用于乳及乳制品、婴幼儿配方食品、婴幼儿谷类辅助食品、固体饮料、配制酒中单独添加的低聚果糖、多聚果糖或菊粉含量的测定。2原理
试样经热水浸提,样液中的蔗糖经蔗糖酶水解成葡萄糖和果糖,葡萄糖和果糖经硼氢化钠还原成相应的糖醇,多余的硼氢化钠用乙酸中和。样液中的果聚糖经过果聚糖酶水解成果糖和葡萄糖,经离子色谱-脉冲安培检测器测定果糖含量,通过换算系数,折算得到果聚糖的含量。3试剂和材料
3.1试剂
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。3.1.1氢氧化钠(NaOH)。
3.1.2马来酸(CH,O)。
3.1.3蔗糖酶:来源于酵母,酶活力≥300U。3.1.4硼氢化钠(NaBH,)。
3.1.5冰乙酸(CH,COOH)。
三水乙酸钠(CHCOONa·3H.O)。3.1.6
果聚糖酶:来源于黑曲霉,酶活力≥10000U3.1.7
50%氢氧化钠溶液(NaOH):色谱纯。3.1.8
3.1.9无水乙酸钠(CHCOONa):纯度≥99.0%。3.1.10
氮气(N,):纯度≥99.9%。
3.2试剂配制
3.2.1氢氧化钠溶液(1mol/L):称取40g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室温下可放置2个月。
3.2.2马来酸钠缓冲溶液(100mmol/L.pH6.5):称取1.16g马来酸(精确至0.01g)于150mL烧杯中,加人约70mL水溶解,用1mol/L氢氧化钠溶液调节pH6.5,用水稀释至100mL。4℃保存,可放置3个月。
3.2.3蔗糖酶溶液(4.5U/mL):将蔗糖酶(活力为300U)溶解于66mL马来酸钠缓冲溶液,分装到2mL的离心管中,一20℃保存,可放置6个月。使用前需测定酶活力。3.2.4氢氧化钠溶液(50mmol/L):称取2g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室1
温下可放置2个月。
GB5009.255—2016
3.2.5硼氢化钠溶液(10mg/mL):准确称取适量硼氢化钠(精确至0.001g)于聚丙烯离心管中,用50mmol/L氢氧化钠溶液溶解,最终质量浓度为10mg/mL,用时现配。3.2.6乙酸溶液(200mmol/L):吸取0.6mL冰乙酸,用水稀释至50mL,4℃保存,可放置2个月。3.2.7乙酸钠溶液(200mmol/L):称取1.36g三水乙酸钠(精确至0.01g),溶于水并稀释至50mL4℃保存,可放置2个月。
3.2.8乙酸钠缓冲溶液(pH4.5)吸取14mL乙酸溶液和11mL乙酸钠溶液混合,并用水稀释至50mL,用时现配。
3.2.9果聚糖酶溶液(455U/mL):将果聚糖酶(活力为10000U)溶解于22mL乙酸钠缓冲溶液,分装到2mL的离心管中,一20℃保存,可放置6个月。使用前需测定酶活力。3.2.10氢氧化钠溶液(200mmo1/L):取10.4mL50%氢氧化钠溶液,用水稀释至1000mL,通人氮气保护,缓慢摇匀,室温下可放置7d。3.2.11氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合溶液:称取41g无水乙酸钠(精确至0.01g),用约500mL水溶解,0.22um滤膜过滤,脱气10min,加人7.8mL50%氢氧化钠溶液,并用水稀释至1000mL,通人氮气保护,缓慢摇匀,室温下可放置7d。3.3标准物质
果糖标准物质(C,HO,):纯度≥99.0%。3.4标准溶液的配制
3.4.1果糖贮备溶液(2000mg/L):准确称取0.05g(精确至0.1mg)80℃烘干至恒重的果糖标准物质于50mL烧杯中,加人约10mL热水,待果糖溶解后,冷却至室温,用水稀释至25mL容量瓶中,摇匀,4℃保存,可放置1个月。
3.4.2果糖中间溶液(80.0mg/L):吸取果糖贮备溶液1mL,用水稀释至25mL容量瓶中,用时现配。3.4.3果糖标准曲线工作溶液:取适量果糖中间溶液,用水配制成质量浓度为0.800mg/L、1.60mg/L4.00mg/L,8.00mg/L、16.0mg/L的标准曲线工作溶液3.5材料
3.5.1净化柱:反相固相萃取柱,填料为苯乙烯二乙烯基苯,2.5ml。3.5.2微孔滤膜:水相,0.22um。4仪器和设备
离子色谱仪:配有三元及以上梯度泵,脉冲安培检测器,Au工作电极。4.2天平:感量为0.1mg、0.001g和0.01g。4.3
pH计:精度为0.01pH。
旋涡振荡器。
恒温水浴摇床:控温精度士1℃。4.6
离心机:转速≥3000r/min。
5分析步骤
5.1试样制备
5.1.1试样预处理
5.1.1.1固体样品:用“四分法”缩分至约200g样品经粉碎机粉碎,混匀,备用。5.1.1.2液体样品:将试样装能够容纳2倍试样体积的带盖容器中,摇匀,备用5.1.2提取
GB5009.255—2016
准确称取1g~5g(精确至0.001g.至少含有果聚糖5mg)试样于150mL锥形瓶中,加人80℃士1℃热水约50mL,置于80℃士1℃恒温水浴摇床中,150r/min振摇15min后,取出,冷却至室温,转移至100mL容量瓶中,用水分三次冲洗锥形瓶,定容,摇匀,溶液经滤纸过滤或者离心,滤液或上清液依据标准曲线的线性范围确定稀释倍数,备用取上述备用样液200μL于10mL具塞玻璃试管中,估算样液中可能的蔗糖含量,按照每毫克蔗糖加入300μL蔗糖酶溶液,旋涡振荡混匀,置于40℃土1℃恒温水浴摇床中,150r/min振摇60min后加人300μL硼氢化钠溶液,旋涡振荡混匀,置于40℃士1℃恒温水浴摇床中,150r/min振摇30min后,取出,冷却至室温。加入750μL乙酸溶液,静置10min。估算样液中可能的果聚糖含量,按照每毫克果聚糖加人1.2mL果聚糖酶溶液,旋涡振荡混匀,置于40℃土1C恒温水浴摇床中,150r/min振摇30min后,取出,冷却至室温。转移至10mL容量瓶中,用水分三次冲洗玻璃试管,定容,摇匀。活化净化柱,试样溶液依次通过0.22pm水相滤膜和净化柱,弃去前面3倍柱体积洗脱液,收集后面洗脱液待测。同时做试剂空白试验。5.2
仪器参考条件
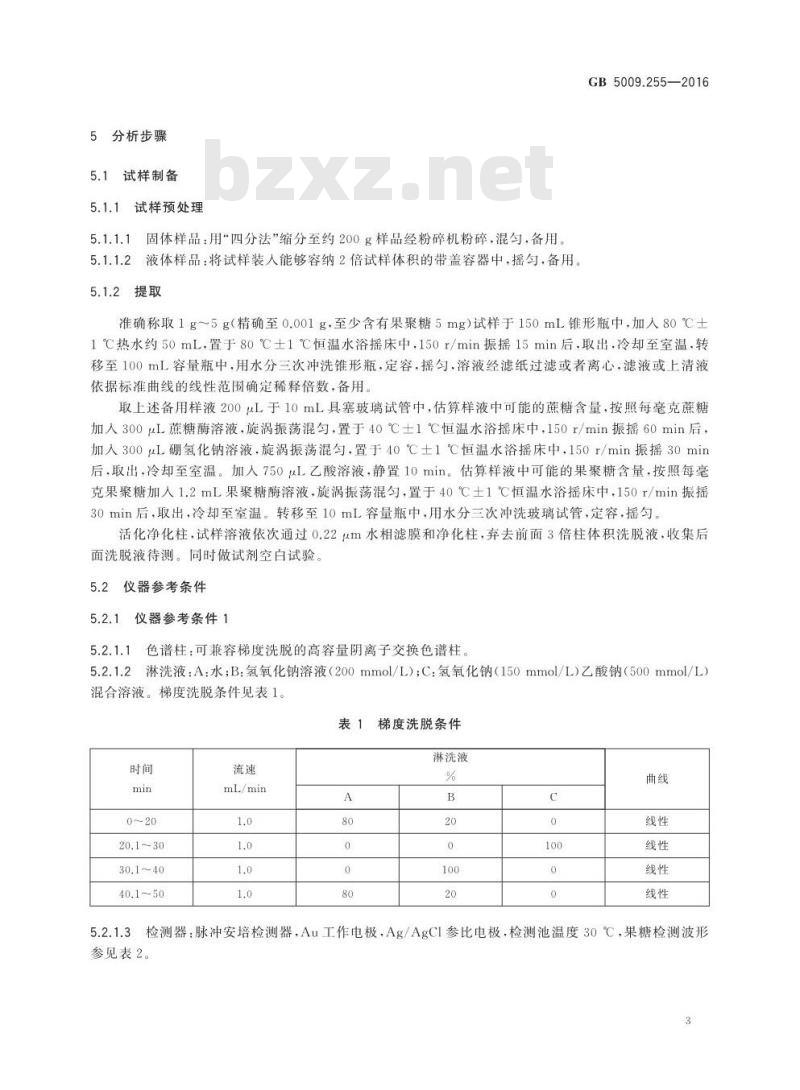
5.2.1仪器参考条件1
5.2.1.1色谱柱:可兼容梯度洗脱的高容量阴离子交换色谱柱5.2.1.2淋洗液:A:水;B:氢氧化钠溶液(200mmol/L);C:氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合溶液。梯度洗脱条件见表1。表1梯度洗脱条件
mL/min
淋洗液
5.2.1.3检测器:脉冲安培检测器,Au工作电极.Ag/AgCI参比电极,检测池温度30℃,果糖检测波形参见表2。
柱温:30℃。
进样体积:10μL。
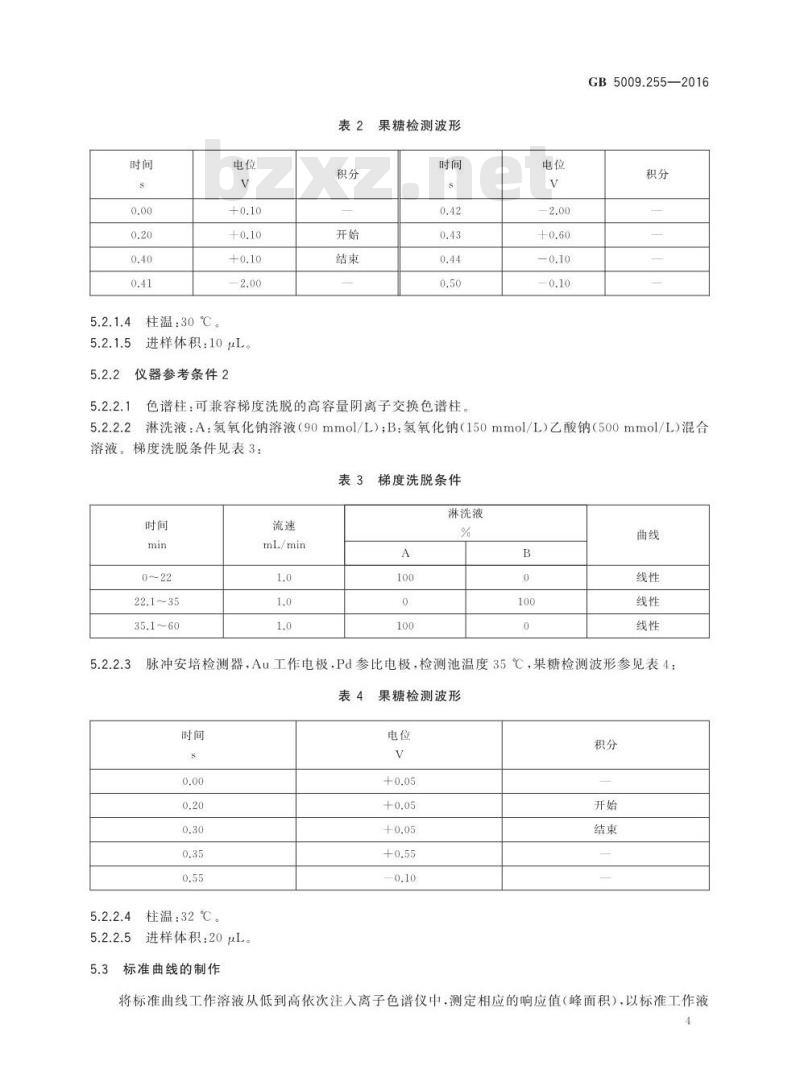
仪器参考条件2
果糖检测波形
色谱柱:可兼容梯度洗脱的高容量阴离子交换色谱柱电位
GB5009.2552016
淋洗液:A:氢氧化钠溶液(90mmol/L);B:氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合梯度洗脱条件见表3:
溶液。
表3梯度洗脱条件
mL/min
淋洗液
脉冲安培检测器,Au工作电极,Pd参比电极,检测池温度35℃,果糖检测波形参见表4:表4
柱温:32℃。
进样体积:20μL。
5.3标准曲线的制作
果糖检测波形
将标准曲线工作溶液从低到高依次注人离子色谱仪中,测定相应的响应值(峰面积),以标准工作液4
GB5009.255—2016
中果糖的质量浓度为横坐标,以响应值(峰面积)为纵坐标,绘制标准曲线。标准溶液色谱图参见附录A。
5.4试样溶液的测定
将试样溶液注入离子色谱仪中,记录色谱图。根据保留时间定性,记录峰面积,根据标准曲线得到待测液中果糖的质量浓度。同时测定试剂空白。6分析结果的表述
试样中果聚糖含量按式(1)、式(2)、式(3)计算:k×k×(c-co)xV×10
m×0.2×1000
式中:
180+162×(n-1)
180×n
试样中果聚糖的含量,单位为克每千克(g/kg);对果聚糖水解过程中增加的水分子进行校正;·(1)
....(2)
.(3)
对于F。型果聚糖末端果糖基被还原和GF,型果聚糖末端葡萄糖不被检测进行校正;试样测定液中果糖的质量浓度,单位为毫克每升(mg/L);试剂空白测定液中果糖的质量浓度,单位为毫克每升(mg/L);试样定容体积,单位为毫升(mL);试样酶解液定容体积,单位为毫升(mL);试样质量,单位为克(g);
用于酶解的样品溶液体积,单位为毫升(mL);单位转换系数:
平均聚合度,对于低聚果糖,按照n=4计算;对于多聚果糖,按照n一23计算;对于菊粉,按照n=10计算。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字7精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。8其他
当称样量为5g时,检出限为0.4g/kg,定量限为2.0g/kg。5
附录A
果糖标准溶液、奶粉样品色谱图A.1果糖标准溶液色谱图(参考条件1)果糖标准溶液色谱图(参考条件1)见图A.1。G0. 0
1果糖 11.909
图A.1果糖标准溶液色谱图
A.2奶粉样品色谱图(参考条件1)奶粉样品色谱图(参考条件1)见图A.2。50.0-
1果糖11.992
图A.2奶粉样品色谱图
GB5009.2552016
A.3果糖标准溶液色谱图(参考条件2)果糖标准溶液色谱图(参考条件2)见图A.3。Cariohydrales
1 600. 0 -
— 400.0 -
200. 0 -
4100. 0 -
A.4奶粉样品色谱图(参考条件2)-
果糖标准溶液色谱图
奶粉样品色谱图(参考条件2)见图A.4。Carlheithyelrales
1 200.0 -
奶粉样品色谱图
1-果糖-20. 54
GB5009.255—2016
1果裤20.07下载标准就来标准下载网
B.1蔗糖酶活力测定方法
B.1.1原理
附录B
酶活力测定方法
GB5009.255—2016
蔗糖酶(Sucrase,EC3.2.1.26)又称转化酶,可以从果糖末端切开蔗糖的果糖糖苷键,使蔗糖水解生成葡萄糖和果糖,葡萄糖和果糖是还原糖,其含量可通过3,5-二硝基水杨酸比色法测定,从而度量酶活力的大小。由于蔗糖酶在碱性条件下极易失活,所以可用碱终止反应。3,5-二硝基水杨酸和还原糖共热后生成棕红色氨基化合物,在最大吸收波长540nm处测定,在一定浓度范围内吸光值与还原糖含量呈线性关系,因此可用于还原糖含量的测定,从而测定蔗糖酶的活力大小。蔗糖酶活力定义为:在37℃、pH6.5条件下,每分钟水解产生1umol葡萄糖所需的酶量(活性)定义为1个酶活力单位。
B.1.2试剂
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水葡萄糖标准物质(C.H12O,):纯度≥99.0%。B.1.2.1
無糖(C12H22O):纯度≥99.0%。氢氧化钠(NaOH)。
马来酸(C,HO)
二硝基水杨酸(C,H,N.O,)。
酒石酸钾钠(C,H,KNaO)。
苯酚(CH,OH)。
亚硫酸钠(Na2SO,)。
B.1.3试剂配制
2.5umol/mL葡萄糖标准溶液:准确称取0.045g(精确至0.1mg)80℃烘干至恒重的葡萄糖B.1.3.12
标准物质于50mL烧杯中,加人约10mL热水,待葡萄糖溶解后,冷却至室温.用水稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月B.1.3.2氢氧化钠溶液(1mol/L):称取40g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室温下可放置2个月。
B.1.3.3马来酸钠缓冲溶液(0.1mol/L.pH6.5):称取1.16g马来酸(精确至0.01g)于150mL烧杯中,加入约70mL水溶解,用1mol/L氢氧化钠溶液调节pH至6.5.用水稀释至100ml,4℃保存,可放置3个月。
B.1.3.41.0mol/L蔗糖溶液:准确称取34.2g(精确至0.01g)蔗糖,用约50mL水溶解,用马来酸钠缓冲溶液稀释至100mL,摇匀,用时现配。B.1.3.5氢氧化钠溶液(2mol/L):称取80g氢氧化钠(精确至0.01g),用水溶解并稀释至1000mL室温下可放置2个月。
B.1.3.63.5-二硝基水杨酸溶液:将6.3g二硝基水杨酸和262mL2mol/LNaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g苯酚和5g亚硫酸钠,搅拌溶解,冷却后用水稀释至8
1.000mL,贮于棕色瓶中备用。
B.1.4仪器和设备
B.1.4.1恒温水浴锅:控温精度土1℃。B.1.4.2分光光度计:带1cm玻璃比色。B.1.4.3微量移液器:100μL、1000μL。5分析步骤
待测酶的制备
GB5009.255—2016
准确称取测试酶样品约0.1g(精确0.001g),用0.1mol/L马来酸钠缓冲溶液溶解并稀释,控制酶活力浓度在1U/mL~5U/mL范围内。B.1.5.2测定
B.1.5.2.1葡萄糖标准曲线的制作取6支10mL刻度试管,编号,按表B.1配制不同浓度的葡萄糖标准溶液:表B.1葡萄糖标准溶液
葡萄糖原液量/mL
加水量/mL
葡萄糖浓度/(μmol/mL)
在上述各试管中分别加入0.5mL3,5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放人盛有冷水的烧杯中冷却至室温,用水定容至5mL,混匀,以1号试管为空白,用分光光度计测定波长540nm处的吸光值。以吸光值为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。B.1.5.2.2蔗糖酶活力的测定
取10mL刻度试管.用微量移液器准确移取1.0mol/L蔗糖溶液0.8mL,准确加入待测酶0.1mL,在37℃士1℃恒温水浴保温30min,取出后立即加人0.1mL1mol/LNaOH溶液,摇匀以终止酶促反应。在相同的条件下,以沸水浴钝化酶液作为试剂空白。再向该溶液中加人0.5mL3,5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放入盛有冷水的烧杯中冷却至室温,用水定容至5mL,混勾。用分光光度计测定波长540nm处的吸光值,由标准曲线计算待测酶测定液中和试剂空白测定液中葡萄糖的质量浓度。
B.1.6计算
蔗糖酶活力按式(B.1)计算:
(c-c。)×V
式中:
蔗糖酶活力,单位为活力单位每毫升(U/mL);待测酶测定液中葡萄糖的摩尔浓度,单位为微摩尔每毫升(umol/mL);.(B.1)
GB5009.255—2016
试剂空白测定液中葡萄糖的摩尔浓度,单位为微摩尔每毫升(μmol/mL);co
V——酶水解液最终定容体积(5mL),单位为毫升(mL);V待测酶的用量,单位为毫升(mL);30—反应时间,单位为分(min)。B.2果聚糖酶活力测定方法
B.2.1原理
果聚糖酶(Inulinase,EC3.2.1.80)又称菊粉酶,是能够水解β-2,1-D-果聚糖果糖苷键的一类水解酶,使菊粉水解生成葡萄糖和果糖,葡萄糖和果糖是还原糖,其含量可通过3,5-二硝基水杨酸比色法测定,从而度量酶活力的大小。3,5-二硝基水杨酸和还原糖共热后生成棕红色氨基化合物,在最大吸收波长540nm处测定,在一定浓度范围内吸光值与还原糖含量呈线性关系,因此可用于还原糖含量的测定,从而测定果聚糖酶的活力大小。果聚糖酶活力定义为:在55℃、pH4.5条件下,每分钟水解产生1umol果糖所需的酶量(活性)定义为1个酶活力单位。
B.2.2试剂
果糖标准物质(C6H20):纯度≥99.0%。B.2.2.2
菊粉:纯度≥90.0%。
冰乙酸(CHCOOH)
三水乙酸钠(CH,COONa·3H,O)。二硝基水杨酸(C,H,NzO,)。
酒石酸钾钠(C,HKNaO。)。
苯酚(CH,OH)。
亚硫酸钠(NazSO:)。
试剂配制
B.2.3.12.5umol/mL果糖标准溶液:准确称取0.045g(精确至0.1mg)80℃烘干至恒重的果糖标准物质于50mL烧杯中,加入约10mL热水,待果糖溶解后,冷却至室温,用水稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月
B.2.3.2乙酸溶液(200mmol/L)吸取0.6mL冰乙酸,用水稀释至50mL,4℃保存,可放置2个月。B.2.3.3乙酸钠溶液(200mmol/L):称取1.36g三水乙酸钠(精确至0.01g),溶于水并稀释至50mL,4℃保存,可放置2个月。
B.2.3.4乙酸钠缓冲溶液(pH4.5):吸取14mL乙酸溶液和11mL乙酸钠溶液混合,并用水稀释至50mL,用时现配。
B.2.3.510%菊粉溶液:准确称取10g(精确至0.01g)菊粉用约50mL热水溶解,冷却至室温,用乙酸钠缓冲溶液稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月。B.2.3.6氢氧化钠溶液(2mo1/L):称取80g氢氧化钠(精确至0.01g),溶于水中并稀释至1000mL室温下可放置2个月。
B.2.3.73.5-二硝基水杨酸溶液:将6.3g二硝基水杨酸和262mL2mol/LNaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g苯酚和5g亚硫酸钠,搅拌溶解,冷却后用水稀释至1000mL,贮于棕色瓶中备用。
仪器和设备
恒温水浴锅:控温精度士1℃。
分光光度计:带1cm玻璃比色Ⅲ。B.2.4.2
微量移液器:100μL、1000μL。B.2.4.3
分析步骤
待测酶的制备
GB5009.255—2016
用乙酸钠缓冲溶液稀释测试酶样品.控制酶活力浓度在1U/mL~5U/mL范围内B.2.5.2测定
果糖标准曲线的制作
B.2.5.2.1
取6支10mL刻度试管,编号,按表B.2用去离子水配制不同浓度的果糖标准溶液2果糖标准溶液
果糖原液量/mlL
加水量/mL
果糖浓度/(μmol/mL)
在上述各试管中分别加人0.5mL3.5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放入盛有冷水的烧杯中冷却至室温,用水定容至5mL,混勾,以1号试管为空白,用分光光度计测定波长540nm处的吸光值。以吸光值为纵坐标,果糖质量浓度为横坐标,绘制标准曲线,B.2.5.2.2菊粉酶活力的测定
取10mL刻度试管,用微量移液器准确移取0.9mL10%菊粉溶液,准确加人待测酶0.1mL,在55℃士1℃恒温水浴保温20min,沸水浴中加热5min,以终止酶促反应。在相同的条件下,以沸水浴钝化酶液作为试剂空白。再向该溶液中加入0.5mL3.5-二硝基水杨酸溶液,混勾后于沸水浴中加热10min。取出后立即放人盛有冷水的烧杯中冷却至室温,用水定容至5mL,混匀。用分光光度计测定波长540nm处的吸光值,由标准曲线计算待测酶测定液中和试剂空白测定液中果糖的质量浓度B.2.6计算
果聚糖酶活力按式(B.2)计算:
(c-c)XV
式中:
果聚糖酶活力,单位为活力单位每毫升(U/mL);待测酶测定液中果糖的摩尔浓度,单位为微摩尔每毫升(umol/mL):试剂空白测定液中果糖的摩尔浓度,单位为微摩尔每毫升(μmol/mL);酶水解液最终定容体积(5mL),单位为毫升(mL);待测酶的用量,单位为毫升(mL);反应时间,单位为分(min)。
...(B.2)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB5009.255—2016
食品安全国家标准
食品中果聚糖的测定
2016-08-31发布
人民共和国
国家卫生和计划生育委员会
2017-03-01实施
1范围
食品安全国家标准
食品中果聚糖的测定
本标准规定了食品中果聚糖含量的离子色谱法测定方法。GB5009.255—2016
本标准适用于乳及乳制品、婴幼儿配方食品、婴幼儿谷类辅助食品、固体饮料、配制酒中单独添加的低聚果糖、多聚果糖或菊粉含量的测定。2原理
试样经热水浸提,样液中的蔗糖经蔗糖酶水解成葡萄糖和果糖,葡萄糖和果糖经硼氢化钠还原成相应的糖醇,多余的硼氢化钠用乙酸中和。样液中的果聚糖经过果聚糖酶水解成果糖和葡萄糖,经离子色谱-脉冲安培检测器测定果糖含量,通过换算系数,折算得到果聚糖的含量。3试剂和材料
3.1试剂
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。3.1.1氢氧化钠(NaOH)。
3.1.2马来酸(CH,O)。
3.1.3蔗糖酶:来源于酵母,酶活力≥300U。3.1.4硼氢化钠(NaBH,)。
3.1.5冰乙酸(CH,COOH)。
三水乙酸钠(CHCOONa·3H.O)。3.1.6
果聚糖酶:来源于黑曲霉,酶活力≥10000U3.1.7
50%氢氧化钠溶液(NaOH):色谱纯。3.1.8
3.1.9无水乙酸钠(CHCOONa):纯度≥99.0%。3.1.10
氮气(N,):纯度≥99.9%。
3.2试剂配制
3.2.1氢氧化钠溶液(1mol/L):称取40g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室温下可放置2个月。
3.2.2马来酸钠缓冲溶液(100mmol/L.pH6.5):称取1.16g马来酸(精确至0.01g)于150mL烧杯中,加人约70mL水溶解,用1mol/L氢氧化钠溶液调节pH6.5,用水稀释至100mL。4℃保存,可放置3个月。
3.2.3蔗糖酶溶液(4.5U/mL):将蔗糖酶(活力为300U)溶解于66mL马来酸钠缓冲溶液,分装到2mL的离心管中,一20℃保存,可放置6个月。使用前需测定酶活力。3.2.4氢氧化钠溶液(50mmol/L):称取2g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室1
温下可放置2个月。
GB5009.255—2016
3.2.5硼氢化钠溶液(10mg/mL):准确称取适量硼氢化钠(精确至0.001g)于聚丙烯离心管中,用50mmol/L氢氧化钠溶液溶解,最终质量浓度为10mg/mL,用时现配。3.2.6乙酸溶液(200mmol/L):吸取0.6mL冰乙酸,用水稀释至50mL,4℃保存,可放置2个月。3.2.7乙酸钠溶液(200mmol/L):称取1.36g三水乙酸钠(精确至0.01g),溶于水并稀释至50mL4℃保存,可放置2个月。
3.2.8乙酸钠缓冲溶液(pH4.5)吸取14mL乙酸溶液和11mL乙酸钠溶液混合,并用水稀释至50mL,用时现配。
3.2.9果聚糖酶溶液(455U/mL):将果聚糖酶(活力为10000U)溶解于22mL乙酸钠缓冲溶液,分装到2mL的离心管中,一20℃保存,可放置6个月。使用前需测定酶活力。3.2.10氢氧化钠溶液(200mmo1/L):取10.4mL50%氢氧化钠溶液,用水稀释至1000mL,通人氮气保护,缓慢摇匀,室温下可放置7d。3.2.11氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合溶液:称取41g无水乙酸钠(精确至0.01g),用约500mL水溶解,0.22um滤膜过滤,脱气10min,加人7.8mL50%氢氧化钠溶液,并用水稀释至1000mL,通人氮气保护,缓慢摇匀,室温下可放置7d。3.3标准物质
果糖标准物质(C,HO,):纯度≥99.0%。3.4标准溶液的配制
3.4.1果糖贮备溶液(2000mg/L):准确称取0.05g(精确至0.1mg)80℃烘干至恒重的果糖标准物质于50mL烧杯中,加人约10mL热水,待果糖溶解后,冷却至室温,用水稀释至25mL容量瓶中,摇匀,4℃保存,可放置1个月。
3.4.2果糖中间溶液(80.0mg/L):吸取果糖贮备溶液1mL,用水稀释至25mL容量瓶中,用时现配。3.4.3果糖标准曲线工作溶液:取适量果糖中间溶液,用水配制成质量浓度为0.800mg/L、1.60mg/L4.00mg/L,8.00mg/L、16.0mg/L的标准曲线工作溶液3.5材料
3.5.1净化柱:反相固相萃取柱,填料为苯乙烯二乙烯基苯,2.5ml。3.5.2微孔滤膜:水相,0.22um。4仪器和设备
离子色谱仪:配有三元及以上梯度泵,脉冲安培检测器,Au工作电极。4.2天平:感量为0.1mg、0.001g和0.01g。4.3
pH计:精度为0.01pH。
旋涡振荡器。
恒温水浴摇床:控温精度士1℃。4.6
离心机:转速≥3000r/min。
5分析步骤
5.1试样制备
5.1.1试样预处理
5.1.1.1固体样品:用“四分法”缩分至约200g样品经粉碎机粉碎,混匀,备用。5.1.1.2液体样品:将试样装能够容纳2倍试样体积的带盖容器中,摇匀,备用5.1.2提取
GB5009.255—2016
准确称取1g~5g(精确至0.001g.至少含有果聚糖5mg)试样于150mL锥形瓶中,加人80℃士1℃热水约50mL,置于80℃士1℃恒温水浴摇床中,150r/min振摇15min后,取出,冷却至室温,转移至100mL容量瓶中,用水分三次冲洗锥形瓶,定容,摇匀,溶液经滤纸过滤或者离心,滤液或上清液依据标准曲线的线性范围确定稀释倍数,备用取上述备用样液200μL于10mL具塞玻璃试管中,估算样液中可能的蔗糖含量,按照每毫克蔗糖加入300μL蔗糖酶溶液,旋涡振荡混匀,置于40℃土1℃恒温水浴摇床中,150r/min振摇60min后加人300μL硼氢化钠溶液,旋涡振荡混匀,置于40℃士1℃恒温水浴摇床中,150r/min振摇30min后,取出,冷却至室温。加入750μL乙酸溶液,静置10min。估算样液中可能的果聚糖含量,按照每毫克果聚糖加人1.2mL果聚糖酶溶液,旋涡振荡混匀,置于40℃土1C恒温水浴摇床中,150r/min振摇30min后,取出,冷却至室温。转移至10mL容量瓶中,用水分三次冲洗玻璃试管,定容,摇匀。活化净化柱,试样溶液依次通过0.22pm水相滤膜和净化柱,弃去前面3倍柱体积洗脱液,收集后面洗脱液待测。同时做试剂空白试验。5.2
仪器参考条件
5.2.1仪器参考条件1
5.2.1.1色谱柱:可兼容梯度洗脱的高容量阴离子交换色谱柱5.2.1.2淋洗液:A:水;B:氢氧化钠溶液(200mmol/L);C:氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合溶液。梯度洗脱条件见表1。表1梯度洗脱条件
mL/min
淋洗液
5.2.1.3检测器:脉冲安培检测器,Au工作电极.Ag/AgCI参比电极,检测池温度30℃,果糖检测波形参见表2。
柱温:30℃。
进样体积:10μL。
仪器参考条件2
果糖检测波形
色谱柱:可兼容梯度洗脱的高容量阴离子交换色谱柱电位
GB5009.2552016
淋洗液:A:氢氧化钠溶液(90mmol/L);B:氢氧化钠(150mmol/L)乙酸钠(500mmol/L)混合梯度洗脱条件见表3:
溶液。
表3梯度洗脱条件
mL/min
淋洗液
脉冲安培检测器,Au工作电极,Pd参比电极,检测池温度35℃,果糖检测波形参见表4:表4
柱温:32℃。
进样体积:20μL。
5.3标准曲线的制作
果糖检测波形
将标准曲线工作溶液从低到高依次注人离子色谱仪中,测定相应的响应值(峰面积),以标准工作液4
GB5009.255—2016
中果糖的质量浓度为横坐标,以响应值(峰面积)为纵坐标,绘制标准曲线。标准溶液色谱图参见附录A。
5.4试样溶液的测定
将试样溶液注入离子色谱仪中,记录色谱图。根据保留时间定性,记录峰面积,根据标准曲线得到待测液中果糖的质量浓度。同时测定试剂空白。6分析结果的表述
试样中果聚糖含量按式(1)、式(2)、式(3)计算:k×k×(c-co)xV×10
m×0.2×1000
式中:
180+162×(n-1)
180×n
试样中果聚糖的含量,单位为克每千克(g/kg);对果聚糖水解过程中增加的水分子进行校正;·(1)
....(2)
.(3)
对于F。型果聚糖末端果糖基被还原和GF,型果聚糖末端葡萄糖不被检测进行校正;试样测定液中果糖的质量浓度,单位为毫克每升(mg/L);试剂空白测定液中果糖的质量浓度,单位为毫克每升(mg/L);试样定容体积,单位为毫升(mL);试样酶解液定容体积,单位为毫升(mL);试样质量,单位为克(g);
用于酶解的样品溶液体积,单位为毫升(mL);单位转换系数:
平均聚合度,对于低聚果糖,按照n=4计算;对于多聚果糖,按照n一23计算;对于菊粉,按照n=10计算。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字7精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。8其他
当称样量为5g时,检出限为0.4g/kg,定量限为2.0g/kg。5
附录A
果糖标准溶液、奶粉样品色谱图A.1果糖标准溶液色谱图(参考条件1)果糖标准溶液色谱图(参考条件1)见图A.1。G0. 0
1果糖 11.909
图A.1果糖标准溶液色谱图
A.2奶粉样品色谱图(参考条件1)奶粉样品色谱图(参考条件1)见图A.2。50.0-
1果糖11.992
图A.2奶粉样品色谱图
GB5009.2552016
A.3果糖标准溶液色谱图(参考条件2)果糖标准溶液色谱图(参考条件2)见图A.3。Cariohydrales
1 600. 0 -
— 400.0 -
200. 0 -
4100. 0 -
A.4奶粉样品色谱图(参考条件2)-
果糖标准溶液色谱图
奶粉样品色谱图(参考条件2)见图A.4。Carlheithyelrales
1 200.0 -
奶粉样品色谱图
1-果糖-20. 54
GB5009.255—2016
1果裤20.07下载标准就来标准下载网
B.1蔗糖酶活力测定方法
B.1.1原理
附录B
酶活力测定方法
GB5009.255—2016
蔗糖酶(Sucrase,EC3.2.1.26)又称转化酶,可以从果糖末端切开蔗糖的果糖糖苷键,使蔗糖水解生成葡萄糖和果糖,葡萄糖和果糖是还原糖,其含量可通过3,5-二硝基水杨酸比色法测定,从而度量酶活力的大小。由于蔗糖酶在碱性条件下极易失活,所以可用碱终止反应。3,5-二硝基水杨酸和还原糖共热后生成棕红色氨基化合物,在最大吸收波长540nm处测定,在一定浓度范围内吸光值与还原糖含量呈线性关系,因此可用于还原糖含量的测定,从而测定蔗糖酶的活力大小。蔗糖酶活力定义为:在37℃、pH6.5条件下,每分钟水解产生1umol葡萄糖所需的酶量(活性)定义为1个酶活力单位。
B.1.2试剂
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水葡萄糖标准物质(C.H12O,):纯度≥99.0%。B.1.2.1
無糖(C12H22O):纯度≥99.0%。氢氧化钠(NaOH)。
马来酸(C,HO)
二硝基水杨酸(C,H,N.O,)。
酒石酸钾钠(C,H,KNaO)。
苯酚(CH,OH)。
亚硫酸钠(Na2SO,)。
B.1.3试剂配制
2.5umol/mL葡萄糖标准溶液:准确称取0.045g(精确至0.1mg)80℃烘干至恒重的葡萄糖B.1.3.12
标准物质于50mL烧杯中,加人约10mL热水,待葡萄糖溶解后,冷却至室温.用水稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月B.1.3.2氢氧化钠溶液(1mol/L):称取40g氢氧化钠(精确至0.01g).溶于水并稀释至1000mL,室温下可放置2个月。
B.1.3.3马来酸钠缓冲溶液(0.1mol/L.pH6.5):称取1.16g马来酸(精确至0.01g)于150mL烧杯中,加入约70mL水溶解,用1mol/L氢氧化钠溶液调节pH至6.5.用水稀释至100ml,4℃保存,可放置3个月。
B.1.3.41.0mol/L蔗糖溶液:准确称取34.2g(精确至0.01g)蔗糖,用约50mL水溶解,用马来酸钠缓冲溶液稀释至100mL,摇匀,用时现配。B.1.3.5氢氧化钠溶液(2mol/L):称取80g氢氧化钠(精确至0.01g),用水溶解并稀释至1000mL室温下可放置2个月。
B.1.3.63.5-二硝基水杨酸溶液:将6.3g二硝基水杨酸和262mL2mol/LNaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g苯酚和5g亚硫酸钠,搅拌溶解,冷却后用水稀释至8
1.000mL,贮于棕色瓶中备用。
B.1.4仪器和设备
B.1.4.1恒温水浴锅:控温精度土1℃。B.1.4.2分光光度计:带1cm玻璃比色。B.1.4.3微量移液器:100μL、1000μL。5分析步骤
待测酶的制备
GB5009.255—2016
准确称取测试酶样品约0.1g(精确0.001g),用0.1mol/L马来酸钠缓冲溶液溶解并稀释,控制酶活力浓度在1U/mL~5U/mL范围内。B.1.5.2测定
B.1.5.2.1葡萄糖标准曲线的制作取6支10mL刻度试管,编号,按表B.1配制不同浓度的葡萄糖标准溶液:表B.1葡萄糖标准溶液
葡萄糖原液量/mL
加水量/mL
葡萄糖浓度/(μmol/mL)
在上述各试管中分别加入0.5mL3,5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放人盛有冷水的烧杯中冷却至室温,用水定容至5mL,混匀,以1号试管为空白,用分光光度计测定波长540nm处的吸光值。以吸光值为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。B.1.5.2.2蔗糖酶活力的测定
取10mL刻度试管.用微量移液器准确移取1.0mol/L蔗糖溶液0.8mL,准确加入待测酶0.1mL,在37℃士1℃恒温水浴保温30min,取出后立即加人0.1mL1mol/LNaOH溶液,摇匀以终止酶促反应。在相同的条件下,以沸水浴钝化酶液作为试剂空白。再向该溶液中加人0.5mL3,5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放入盛有冷水的烧杯中冷却至室温,用水定容至5mL,混勾。用分光光度计测定波长540nm处的吸光值,由标准曲线计算待测酶测定液中和试剂空白测定液中葡萄糖的质量浓度。
B.1.6计算
蔗糖酶活力按式(B.1)计算:
(c-c。)×V
式中:
蔗糖酶活力,单位为活力单位每毫升(U/mL);待测酶测定液中葡萄糖的摩尔浓度,单位为微摩尔每毫升(umol/mL);.(B.1)
GB5009.255—2016
试剂空白测定液中葡萄糖的摩尔浓度,单位为微摩尔每毫升(μmol/mL);co
V——酶水解液最终定容体积(5mL),单位为毫升(mL);V待测酶的用量,单位为毫升(mL);30—反应时间,单位为分(min)。B.2果聚糖酶活力测定方法
B.2.1原理
果聚糖酶(Inulinase,EC3.2.1.80)又称菊粉酶,是能够水解β-2,1-D-果聚糖果糖苷键的一类水解酶,使菊粉水解生成葡萄糖和果糖,葡萄糖和果糖是还原糖,其含量可通过3,5-二硝基水杨酸比色法测定,从而度量酶活力的大小。3,5-二硝基水杨酸和还原糖共热后生成棕红色氨基化合物,在最大吸收波长540nm处测定,在一定浓度范围内吸光值与还原糖含量呈线性关系,因此可用于还原糖含量的测定,从而测定果聚糖酶的活力大小。果聚糖酶活力定义为:在55℃、pH4.5条件下,每分钟水解产生1umol果糖所需的酶量(活性)定义为1个酶活力单位。
B.2.2试剂
果糖标准物质(C6H20):纯度≥99.0%。B.2.2.2
菊粉:纯度≥90.0%。
冰乙酸(CHCOOH)
三水乙酸钠(CH,COONa·3H,O)。二硝基水杨酸(C,H,NzO,)。
酒石酸钾钠(C,HKNaO。)。
苯酚(CH,OH)。
亚硫酸钠(NazSO:)。
试剂配制
B.2.3.12.5umol/mL果糖标准溶液:准确称取0.045g(精确至0.1mg)80℃烘干至恒重的果糖标准物质于50mL烧杯中,加入约10mL热水,待果糖溶解后,冷却至室温,用水稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月
B.2.3.2乙酸溶液(200mmol/L)吸取0.6mL冰乙酸,用水稀释至50mL,4℃保存,可放置2个月。B.2.3.3乙酸钠溶液(200mmol/L):称取1.36g三水乙酸钠(精确至0.01g),溶于水并稀释至50mL,4℃保存,可放置2个月。
B.2.3.4乙酸钠缓冲溶液(pH4.5):吸取14mL乙酸溶液和11mL乙酸钠溶液混合,并用水稀释至50mL,用时现配。
B.2.3.510%菊粉溶液:准确称取10g(精确至0.01g)菊粉用约50mL热水溶解,冷却至室温,用乙酸钠缓冲溶液稀释至100mL容量瓶中,摇匀,4℃保存,可放置1个月。B.2.3.6氢氧化钠溶液(2mo1/L):称取80g氢氧化钠(精确至0.01g),溶于水中并稀释至1000mL室温下可放置2个月。
B.2.3.73.5-二硝基水杨酸溶液:将6.3g二硝基水杨酸和262mL2mol/LNaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g苯酚和5g亚硫酸钠,搅拌溶解,冷却后用水稀释至1000mL,贮于棕色瓶中备用。
仪器和设备
恒温水浴锅:控温精度士1℃。
分光光度计:带1cm玻璃比色Ⅲ。B.2.4.2
微量移液器:100μL、1000μL。B.2.4.3
分析步骤
待测酶的制备
GB5009.255—2016
用乙酸钠缓冲溶液稀释测试酶样品.控制酶活力浓度在1U/mL~5U/mL范围内B.2.5.2测定
果糖标准曲线的制作
B.2.5.2.1
取6支10mL刻度试管,编号,按表B.2用去离子水配制不同浓度的果糖标准溶液2果糖标准溶液
果糖原液量/mlL
加水量/mL
果糖浓度/(μmol/mL)
在上述各试管中分别加人0.5mL3.5-二硝基水杨酸溶液,混匀后于沸水浴中加热10min。取出后立即放入盛有冷水的烧杯中冷却至室温,用水定容至5mL,混勾,以1号试管为空白,用分光光度计测定波长540nm处的吸光值。以吸光值为纵坐标,果糖质量浓度为横坐标,绘制标准曲线,B.2.5.2.2菊粉酶活力的测定
取10mL刻度试管,用微量移液器准确移取0.9mL10%菊粉溶液,准确加人待测酶0.1mL,在55℃士1℃恒温水浴保温20min,沸水浴中加热5min,以终止酶促反应。在相同的条件下,以沸水浴钝化酶液作为试剂空白。再向该溶液中加入0.5mL3.5-二硝基水杨酸溶液,混勾后于沸水浴中加热10min。取出后立即放人盛有冷水的烧杯中冷却至室温,用水定容至5mL,混匀。用分光光度计测定波长540nm处的吸光值,由标准曲线计算待测酶测定液中和试剂空白测定液中果糖的质量浓度B.2.6计算
果聚糖酶活力按式(B.2)计算:
(c-c)XV
式中:
果聚糖酶活力,单位为活力单位每毫升(U/mL);待测酶测定液中果糖的摩尔浓度,单位为微摩尔每毫升(umol/mL):试剂空白测定液中果糖的摩尔浓度,单位为微摩尔每毫升(μmol/mL);酶水解液最终定容体积(5mL),单位为毫升(mL);待测酶的用量,单位为毫升(mL);反应时间,单位为分(min)。
...(B.2)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:



- 热门标准
- 国家标准
- GB/T2828.1-2012 计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划
- GB/T228.1-2021 金属材料 拉伸试验 第1部分:室温试验方法
- GB/T18204.4-2000 公共场所毛巾、床上卧具微生物检验方法细菌总数测定
- GB/T97.1-2002 平垫圈A级
- GB/T23892.3-2009 滑动轴承 稳态条件下流体动压可倾瓦块止推轴承 第3部分:可倾瓦块止推轴承计算的许用值
- GB/T11839-1989 二氧化铀芯块中硼的测定 姜黄素萃取光度法
- GB15603-2022 危险化学品仓库储存通则
- GB/T1804-2000 一般公差 未注公差的线性和角度尺寸的公差
- GB/T7433-1987 对称电缆载波通信系统抗无线电广播和通信干扰的指标
- GB/T21238-2007 玻璃纤维增强塑料夹砂管
- GB/T28809-2012 轨道交通 通信、信号和处理系统 信号用安全相关电子系统
- GB/T9239-1988 刚性转子平衡品质 许用不平衡的确定
- GB/T15917.3-1995 金属镝及氧化镝化学分析方法 对氯苯基荧光酮--溴化十六烷基三甲基胺分光光度法测定钽量
- GB/T5738-1995 瓶装酒、饮料塑料周转箱
- GB/T13985-1992 照相机操作力和强度
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2