- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 国家标准(GB) >>
- GB/T 19915.8-2005 猪链球菌2型毒力因子荧光PCR检测方法
标准号:
GB/T 19915.8-2005
标准名称:
猪链球菌2型毒力因子荧光PCR检测方法
标准类别:
国家标准(GB)
标准状态:
现行-
发布日期:
2005-09-27 -
实施日期:
2005-11-04 出版语种:
简体中文下载格式:
.rar.pdf下载大小:
164.92 KB
出版社:
中国标准出版社书号:
155066.1-26772页数:
16开, 页数:5, 字数:6千字标准价格:
8.0 元出版日期:
2005-11-04计划单号:
20051783-T-469
点击下载
标准简介:
标准下载解压密码:www.bzxz.net
本标准规定了猪链球菌2型毒力因子MRP和EF检测的荧光PCR操作方法。本标准适用于检测生猪拭子、增菌增养物、疑似病料及猪组织样品中猪链球菌2型菌株的致病力。 GB/T 19915.8-2005 猪链球菌2型毒力因子荧光PCR检测方法 GB/T19915.8-2005
部分标准内容:
ICS 07. 100. 30
中华人民共和国国家标准
GB/T19915.8—2005
猪链球菌2型毒力因子荧光PCR
检测方法
Protocol of real-time PCR assay for virulence factors ofStreptococcus suis type 2
2005-09-27发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2005-11-01实施
本标准的附录A为规范性附录。
本标准由国家标准化管理委员会提出:前
本标准由全国动物防疫标准化管理委员会归口,本标准由中国检验梭疫科学研究院和江苏出人境检验检疫局负责起草。GB/T19915.8—2005
本标准主要起草人:林祥梅、吴绍强、韩雪清,贸广乐、刘建、梅琳、陈国强、张敬友、姜焱、唐泰山。本标推为首饮发布。
1范围
猪链球菌2型毒力因子荧光PCR
检测方法
CB/T 19915.8-2005
本标谁规定了猪链球菌2型毒力因子MRP和EF检测的荧光PCR操作方法。本标准适用于检测生猪拭子、增菌培养物,疑似病料及猪组织样品中猪链球菌2型菌株的致病力。2术语和定义
下列术语和定义适用于本标准。2. 1
毒力因字virulence factor
猪链球菌2型菌株的致病力与其毒力因子直接相关。猪链球菌2型的毒力因子有溶菌酶干放蛋白(MRP)、胞外因子(FF),溶血素、英膜多糖以及 44 kDa蛋白、IgG结合蛋白,毛粘着素等,其中,溶菌趣释放强白(MRP)和脑外因子(EF)是最主要的两个毒力因子,可作判定菌株毒力的指标。一股认为表型 MRP+EF 一为强致病株,MRF →EF 一为弱致病株,MRP- EF…为非致病株,未发现MRP-EF-表型。
3缩略语
本标雅采用下列缩略语:
荧光PCR
4实验材料与仪器
4.1实验试剂
实验试剂包括:
荧光聚合酶链反应
溶菌酶释放蛋白
胞外因子
荧光信号到达设定的闻值所经历的循环数6-羧基荧光素
四甲基罗丹明
~猪链球菌2型毒力因子荧光PCR检测引物、探针、阳性对照及常规PCR反应试剂;商品化的组织基因组DNA提取试剂盒,具体提取操作参照说明书进行。4.2仪器
所用仪器包括:wwW.bzxz.Net
一荧光PCR仪:
一高速冷冻离心机;
—台式离心机;
旋涡混匀器;
冰箱(2℃-8℃和--20℃两种):微量可调移液器(0122~20μ20μ~200±l100~1000等规格)和相应配套的吸头。
GB/T 19915.8—2005
5操作方法
5. 1方法概要
荧光PCR方法是一种快速、灵敏、特异的检测病原体的方法。本研究选择猪链球菌2型的MR户和EF两个力因子基因设计引物进行PCR、同时在扩增序列中间设计了荧光探针,进行多重荧光PCR检测。反应结束即可根据扩增曲线判定有无目的基因,从而确定待检菌是否含有猪链球菌2型MRP 和 EF毒力因子基因,并据此判定其致病力:5.2 操作步骤
5.2. 1实时荧光 PCR扩增体系
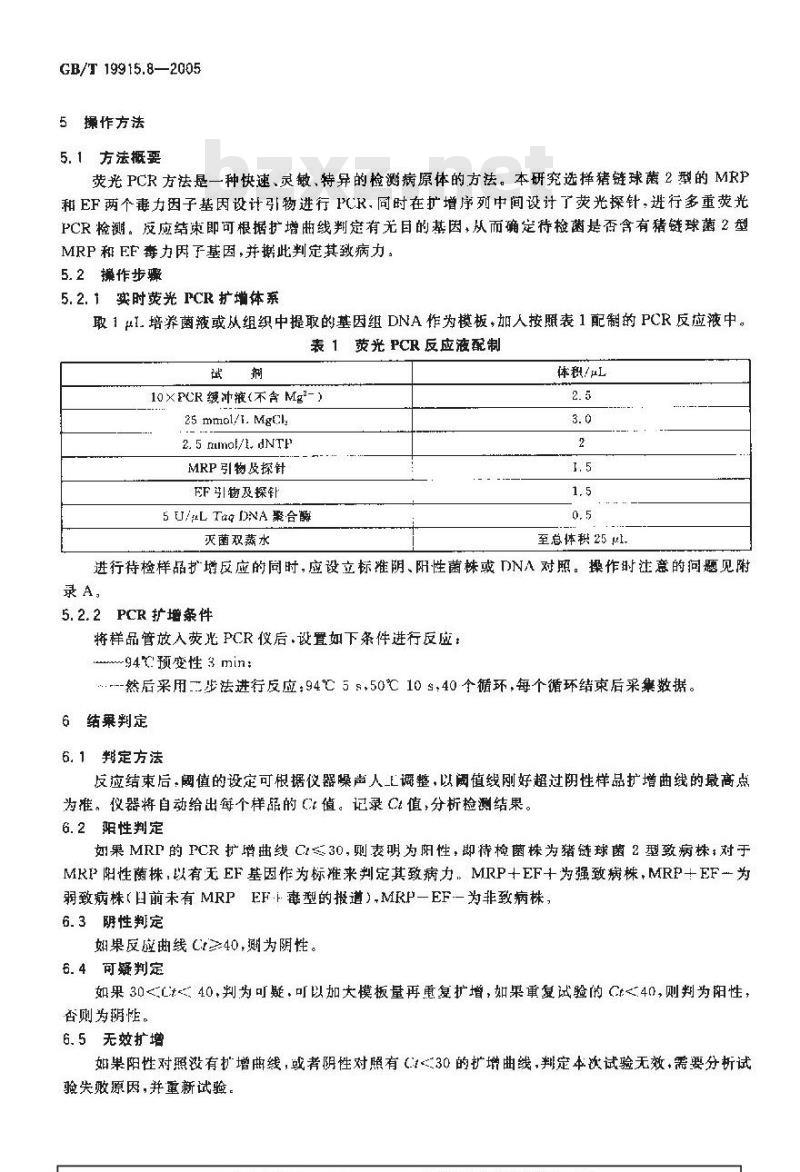
取1uL.培养菌液或从组织中提取的基因组DNA作为模板,加人按照表1配制的PCR反应液中。表1荧光PCR反应液配制
10×PCR缓冲液(不含Mg2-)
25 mmol/1. MgCl
2. 5 mmol/1. dNTP
MRP引物及探针
FF引物及探针
5 U/μL Taq DNA 聚合酶
灭菌双蒸水
体积/μ
至总体积25 μl
进行待检样品扩增反应的同时,应设立标准阴、阳性菌株或DNA对照。操作时注意的问题见附录A,
5.2.2PCR 扩增条件
将样品管放入荧光PCR仪后.设置如下条件进行反应:wa~94预变性3min:
.--然后采用二步法进行反应94℃5s,50℃10s,40个循环,每个循环结束后采集数据。6结果判定
6. 1 判定方法
反应结束后,阅值的设定可根据仪器噪声人上调整,以阅值线刚好超过阴性样品扩增曲线的最高点为准。仪器将自动给出每个样品的Ct值。记录 Ct值,分析捡测结果。6. 2 性判定
如果 MRP 的 PCR 扩增曲线 Ci≤30,则表明为阳性,即待检菌株为猪链球菌 2 型致病株;对于MRP阳性菌株,以有无EF基困作为标准来判定其致病力,MRP十EF十为强致病株,MRP+EF一为弱致病株(日前未有 MRPEFF型的报道).MRP一EF一为非致病株,6.3阴性判定
如果反应曲线Ct≥40,测为阴性。6.4可疑判定
如果306.5无效扩增
如果阳性对照没有扩增曲线,或者阴性对照有(t30的扩增曲线,判定本欲试验无效,需要分析试验失败原因,并重新试验,
(规范性附录)
检测过程中生物安全和防止交叉污染的措施GB/T19915.8—2005
4. 1样品处理过程中必须一次性于套,并经常更换。ICR反应滚配制过程中应在超净工作台等治净环境中进行。
A.2抽样和制样上具必须清洁下净,用下试验的器[和离心管,PCR 管等必须经过 12℃、15 min高压灭菌后才可使用。
A.3引物、探针等溶澈应按照安际.T.作浓度砍性溶解好,并分装层使用,防止试验过程中污染。A.4试验前后.要把超净上作台的紫外灯打非,以破坏可能残留的[N1,A.5上机运行前应检查各FPCR管盖是否盖紧.以防荧光物质泄露面污染机器。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T19915.8—2005
猪链球菌2型毒力因子荧光PCR
检测方法
Protocol of real-time PCR assay for virulence factors ofStreptococcus suis type 2
2005-09-27发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2005-11-01实施
本标准的附录A为规范性附录。
本标准由国家标准化管理委员会提出:前
本标准由全国动物防疫标准化管理委员会归口,本标准由中国检验梭疫科学研究院和江苏出人境检验检疫局负责起草。GB/T19915.8—2005
本标准主要起草人:林祥梅、吴绍强、韩雪清,贸广乐、刘建、梅琳、陈国强、张敬友、姜焱、唐泰山。本标推为首饮发布。
1范围
猪链球菌2型毒力因子荧光PCR
检测方法
CB/T 19915.8-2005
本标谁规定了猪链球菌2型毒力因子MRP和EF检测的荧光PCR操作方法。本标准适用于检测生猪拭子、增菌培养物,疑似病料及猪组织样品中猪链球菌2型菌株的致病力。2术语和定义
下列术语和定义适用于本标准。2. 1
毒力因字virulence factor
猪链球菌2型菌株的致病力与其毒力因子直接相关。猪链球菌2型的毒力因子有溶菌酶干放蛋白(MRP)、胞外因子(FF),溶血素、英膜多糖以及 44 kDa蛋白、IgG结合蛋白,毛粘着素等,其中,溶菌趣释放强白(MRP)和脑外因子(EF)是最主要的两个毒力因子,可作判定菌株毒力的指标。一股认为表型 MRP+EF 一为强致病株,MRF →EF 一为弱致病株,MRP- EF…为非致病株,未发现MRP-EF-表型。
3缩略语
本标雅采用下列缩略语:
荧光PCR
4实验材料与仪器
4.1实验试剂
实验试剂包括:
荧光聚合酶链反应
溶菌酶释放蛋白
胞外因子
荧光信号到达设定的闻值所经历的循环数6-羧基荧光素
四甲基罗丹明
~猪链球菌2型毒力因子荧光PCR检测引物、探针、阳性对照及常规PCR反应试剂;商品化的组织基因组DNA提取试剂盒,具体提取操作参照说明书进行。4.2仪器
所用仪器包括:wwW.bzxz.Net
一荧光PCR仪:
一高速冷冻离心机;
—台式离心机;
旋涡混匀器;
冰箱(2℃-8℃和--20℃两种):微量可调移液器(0122~20μ20μ~200±l100~1000等规格)和相应配套的吸头。
GB/T 19915.8—2005
5操作方法
5. 1方法概要
荧光PCR方法是一种快速、灵敏、特异的检测病原体的方法。本研究选择猪链球菌2型的MR户和EF两个力因子基因设计引物进行PCR、同时在扩增序列中间设计了荧光探针,进行多重荧光PCR检测。反应结束即可根据扩增曲线判定有无目的基因,从而确定待检菌是否含有猪链球菌2型MRP 和 EF毒力因子基因,并据此判定其致病力:5.2 操作步骤
5.2. 1实时荧光 PCR扩增体系
取1uL.培养菌液或从组织中提取的基因组DNA作为模板,加人按照表1配制的PCR反应液中。表1荧光PCR反应液配制
10×PCR缓冲液(不含Mg2-)
25 mmol/1. MgCl
2. 5 mmol/1. dNTP
MRP引物及探针
FF引物及探针
5 U/μL Taq DNA 聚合酶
灭菌双蒸水
体积/μ
至总体积25 μl
进行待检样品扩增反应的同时,应设立标准阴、阳性菌株或DNA对照。操作时注意的问题见附录A,
5.2.2PCR 扩增条件
将样品管放入荧光PCR仪后.设置如下条件进行反应:wa~94预变性3min:
.--然后采用二步法进行反应94℃5s,50℃10s,40个循环,每个循环结束后采集数据。6结果判定
6. 1 判定方法
反应结束后,阅值的设定可根据仪器噪声人上调整,以阅值线刚好超过阴性样品扩增曲线的最高点为准。仪器将自动给出每个样品的Ct值。记录 Ct值,分析捡测结果。6. 2 性判定
如果 MRP 的 PCR 扩增曲线 Ci≤30,则表明为阳性,即待检菌株为猪链球菌 2 型致病株;对于MRP阳性菌株,以有无EF基困作为标准来判定其致病力,MRP十EF十为强致病株,MRP+EF一为弱致病株(日前未有 MRPEFF型的报道).MRP一EF一为非致病株,6.3阴性判定
如果反应曲线Ct≥40,测为阴性。6.4可疑判定
如果30
如果阳性对照没有扩增曲线,或者阴性对照有(t30的扩增曲线,判定本欲试验无效,需要分析试验失败原因,并重新试验,
(规范性附录)
检测过程中生物安全和防止交叉污染的措施GB/T19915.8—2005
4. 1样品处理过程中必须一次性于套,并经常更换。ICR反应滚配制过程中应在超净工作台等治净环境中进行。
A.2抽样和制样上具必须清洁下净,用下试验的器[和离心管,PCR 管等必须经过 12℃、15 min高压灭菌后才可使用。
A.3引物、探针等溶澈应按照安际.T.作浓度砍性溶解好,并分装层使用,防止试验过程中污染。A.4试验前后.要把超净上作台的紫外灯打非,以破坏可能残留的[N1,A.5上机运行前应检查各FPCR管盖是否盖紧.以防荧光物质泄露面污染机器。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 热门标准
- 国家标准(GB)
- GB/T42970-2023 半导体集成电路 视频编解码电路测试方法
- GB/T97.1-2002 平垫圈A级
- GB/T43802-2024 绿色产品评价 物流周转箱
- GB/T1182-2018 产品几何技术规范(GPS) 几何公差 形状、方向、位置和跳动公差标注
- GB/T38920-2020 危险废物储运单元编码要求
- GB28129-2011 乙羧氟草醚原药
- GB31604.49-2023 食品安全国家标准 食品接触材料及制品 多元素的测定和多元素迁移量的测定
- GB/T18721.4-2024 印刷技术 印前数据交换 第4部分:显示用宽色域标准彩色图像数据 [Adobe RGB (1998)/SCID]
- GB/T7967-1987 声学 水声发射器的大功率特性和测量
- GB29140-2024 纯碱单位产品能源消耗限额
- GB1913.2-1990 漂白浸渍绝缘纸
- GB/T10599-1998 多绳摩擦式提升机
- GB/T8878—2014 棉针织内衣
- GB15193.5-2003 骨髓细胞微核试验
- GB/T15412-1994 应用电视摄像机云台通用技术条件
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2