- 您的位置:
- 标准下载网 >>
- 标准分类 >>
- 商检行业标准(SN) >>
- SN/T 1207-2011 猪痢疾检疫技术规范
标准号:
SN/T 1207-2011
标准名称:
猪痢疾检疫技术规范
标准类别:
商检行业标准(SN)
标准状态:
现行出版语种:
简体中文下载格式:
.rar .pdf下载大小:
部分标准内容:
中华人民共和国出入境检验检疫行业标准SN/T 1207—2011
代替SN/T1207-2003
猪痫疾检疫技术规范
Quarantineprotocolforswinedysentery2011-05-31发布
中华人民共和国
国家质量监督检验检疫总局
2011-12-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准代替SN/T1207—2003《猪疾短螺旋体分离培养操作规程》。本标准与SN/T1207—2003相比,主要技术变化如下:增加了猪制疾临床诊断及疾病概述相关技术内容;一增加了患病猪大肠组织切片镜检操作方法内容;SN/T1207—2011
修改、完善了猪痢疾短螺旋体分离培养和鉴定方法,细化了采样方法与检测程序;-增加了猪疾短螺旋体的PCR检测鉴定方法。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国湖北出入境检验检疫局、华中农业大学本标准主要起草人:陈建军、郭明星、曾宪东、金梅林、张四喜、黄晟、冯汉利、赵晖、徐家文、张春亚本标准所代替标准的历次版本发布情况为:SN/T1207-—2003。
TIKANYKACA
1范围
猪疾检疫技术规范
SN/T1207—2011
本标准规定了猪痢疾病的临床诊断、组织切片镜检及猪疾短螺旋体分离培养和鉴定方法。本标准适用于猪痫疾病的检疫诊断规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T6682分析实验室用水规格和试验方法GB19489实验室生物安全通用要求GB/T19495.3转基因产品检测核酸提取纯化方法3缩略语
下列缩略语适用于本文件
SD(swinedysentery):猪痫疾
B.h(brachyspirahyodysenteriae):猪痢疾短螺旋体B.i(brachyspirainnocens):非致病性短螺旋体B.p(brachyspirapilosicoli):结肠菌毛样短螺旋体4临床诊断
猪只感染SD后所表现出的临床、病理症状大多较为典型,对于本病的检疫可结合猪群的流行病学、临床症状及病理解剖检验的结果对猪只是否感染本病作出初步的诊断,具体方法参见附录A。实验室诊断
5.1大肠组织切片镜检
5.1.1材料准备
器材:组织切片机、生物显微镜、染色缸、水浴锅、恒温培养箱、载玻片。5. 1.1. 1
5.1.1.2试剂:10%福尔马林、70%乙醇、95%乙醇、无水乙醇、二甲苯、切片石蜡、革兰氏染色液或姬姆萨染色液。
5.1.2样品采集与处理
检病猪,取病变大肠段(盲肠、结肠和直肠前段),冷藏送检,5.1.2.1
切取1cm左右病变大肠段样品置10%福尔马林中至少固定3h~4h1
TTKANYKAa
SN/T1207—2011
5.1.2.3取出样品用流水冲洗1h。5.1.2.4将样品依次浸39℃的95%乙醇、无水乙醇中,各脱水30min。5.1.2.5再将脱水后的样品浸入38℃的二甲苯中,透明10min~15min。5.1.2.6取透明样品依次浸入56℃的二甲苯石蜡(体积比=1:1)10min、二甲苯石蜡(体积比=1:3)20min和液体石蜡中30min~60min,进行浸蜡包埋。5.1.2.7用切片机切片,并将组织切片贴于洁净载玻片上,置56℃温箱2h3h或38℃温箱中过夜烘干,备染。
5.1.2.8取烘干切片样品依次浸人两缸二甲苯中脱蜡,各3min~5min。5.1.2.9再依次放人无水酒精、95%和70%酒精中浸泡2min~3min,取出用流水润洗。5.1.2.10用革兰氏染色液染色,干燥,再用二甲苯透明一次,用盖玻片封片备检。或以10倍稀释的姬姆萨染色液浸染脱蜡切片样品8h~24h,再迅速通过两缸无水乙醇,干燥,二甲苯透明,封片备检。5.1.3镜检
镜检观察,SD阳性病猪病料可在粘膜表面特别是在结肠腺窝内见到大量的B.h样菌体,B.h为革兰氏阴性,长6μm~8.5um,呈舒展的2~4个螺旋状,两端尖锐的蛇样菌(参见附录B)。5.2猪痫疾短螺旋体的分离培养和鉴定5.2.1材料准备
5.2.1.1器材:生物显微镜、载玻片、厌氧培养箱(罐)(20%CO2、80%H,)、离心机、灭菌注射器、手术刀、止血钳、缝合针、线、灭菌棉拭子。5.2.1.2试剂:BJ培养基、磷酸缓冲液(0.01mol/L·pH7.2PBS)(配制方法见附录C)、革兰氏染色液或姬姆萨染色液。
5.2.1.3试验动物:仔猪(15kg~25kg)或豚鼠(3周龄~4周龄)或幼小鼠(20g左右)。5.2.2病料采集处理与分离培养
5.2.2.1采集直肠或新鲜粪便拭子样品,置入装有适量PBS的灭菌试管内,密封后0℃~4℃保存送检,3d内进行分离培养检验;对于病死猪或扑杀猪,可将大肠(盲肠、结肠及直肠前段)分段两头结扎(每段10cm),分离取出,样品置4℃保存箱尽快送检,进行镜检及病原分离培养,样品保存不超过5d~7d。
5.2.2.2取少许样品抹片染色或做成悬滴标本,直接镜检.观察有无B.h样菌体及活力。5.2.2.3对于含菌量较多的病科可直接划线接种或用无菌PBS作1:10稀释后划线接种于BJ培养基平板,置厌氧培养箱中42℃培养。5.2.2.4对于临床表现不明显的以及投药治疗后的猪病料,由于含菌量少或活力减弱,需先将样品用适量PBS溶解后,低速离心除去残渣,取上清,再以6000r/min~8000r/min离心20min,进行集菌后,再取沉淀物划线接种BJ培养基平板,置厌氧培养器内42℃培养。5.2.3结果观察
每隔2d检查一次,观察有无溶血区及溶血菌落,阴性样品应至少培养6d。B.h生长能产生强β溶血区,溶血区呈条状或一端稍尖的椭圆形斑点,其菌落不明显.只在溶血区内可见一层云雾状菌苔,B.i和B.P等螺旋体呈弱β溶血,结合染色镜检结果,可初步判定猪只是否感染B.h。B.h最终判定还需进行生化鉴定或核酸序列检测,必要时通过结肠致病性试验进行鉴定(具体方法见附录D)。
TKANYKACa
5.2.4生化鉴定
SN/T 1207—2011
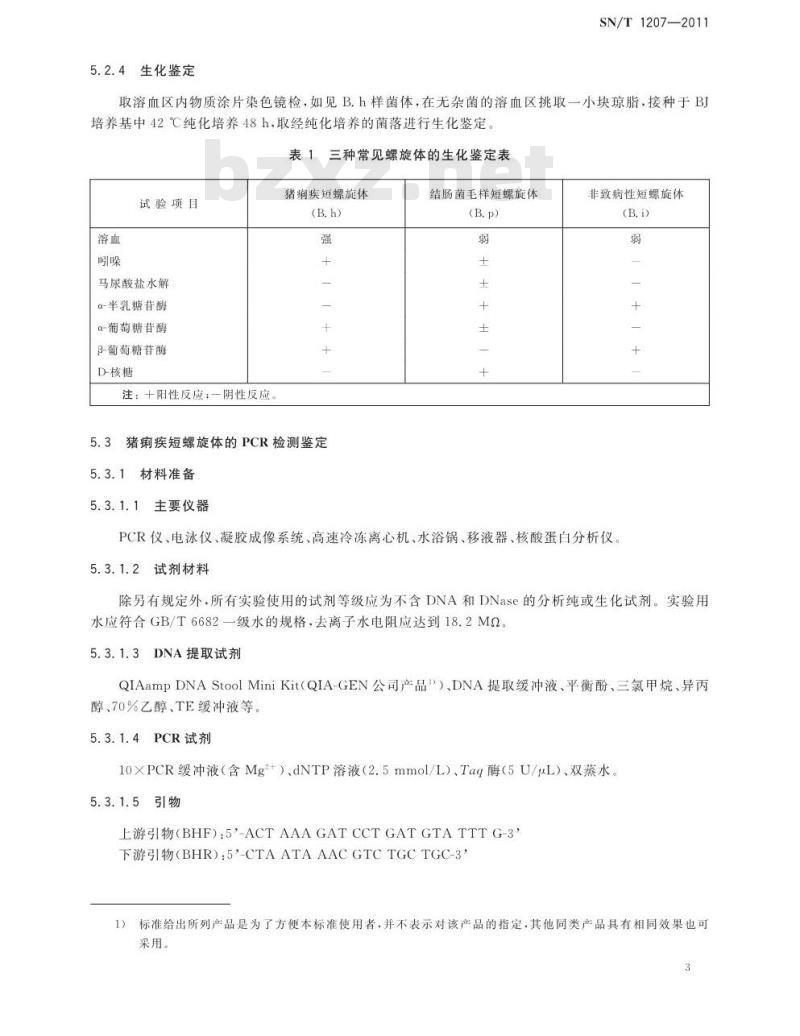
取溶血区内物质涂片染色镜检,如见B.h样菌体,在无杂菌的溶血区挑取一小块琼脂,接种于BJ培养基中42℃纯化培养48h,取经纯化培养的菌落进行生化鉴定。表1三种常见螺旋体的生化鉴定表试验项目
马尿酸盐水解
α-半乳糖苷酶
α-葡萄糖苷酶
β-葡萄糖苷酶
D-核糖
注:十阳性反应:一阴性反应
猪痫疾短螺旋体
5.3猪痢疾短螺旋体的PCR检测鉴定5.3.1材料准备
主要仪器
结肠菌毛样短螺旋体
非致病性短螺旋体
PCR仪、电泳仪、凝胶成像系统、高速冷冻离心机、水浴锅、移液器、核酸蛋白分析仪5.3.1.2试剂材料
除另有规定外.所有实验使用的试剂等级应为不含DNA和DNase的分析纯或生化试剂。实验用水应符合GB/T6682一级水的规格,去离子水电阻应达到18.2MQ5.3.1.3DNA提取试剂
QIAampDNAStoolMiniKit(QIA-GEN公司产品)、DNA提取缓冲液、平衡酚、三氯甲烷、异丙醇、70%乙醇、TE缓冲液等。
5.3.1.4PCR试剂
10XPCR缓冲液(含Mg2+)、dNTP溶液(2.5mmol/L)、Taq酶(5U/μL)、双蒸水。5.3.1.5引物
上游引物(BHF):5-ACTAAAGATCCTGATGTATTTG-3下游引物(BHR):5'-CTAATAAACGTCTGCTGC-31)标准给出所列产品是为了方便本标准使用者,并不表示对该产品的指定,其他同类产品具有相同效果也可采用。
TTIKANYKAC
SN/T1207—2011
5.3.1.6电泳试剂
琼脂糖、溴化乙锭、TBE缓冲液、上样缓冲液、相对分子质量Marker(DL-2000)。5.3.2检测步骤
5.3.2.1试样DNA的提取
对于分离培养的可疑菌株,其总DNA可采取酚/三氯甲烷法进行提取,提取程序参照GB/T19495.3操作。对于粪便样品可直接采用QIAampDNAStoolMiniKit直接提取总DNA,提取程序按试剂盒说明操作。
5.3.2.2DNA纯度和浓度的测定
取5LDNA溶液加双蒸水稀释到适宜体积.用核酸蛋白分析仪分别测定260nm和280nm波长吸光度值A250和A280。DNA的浓度计算见式(1):c=AXNX50/1000
式中:
CDNA浓度,单位为微克每微升(μg/μL);A260nm波长吸光度值;
N核酸稀释倍数。
当A260和A280比值在1.7~1.9之间时,核酸纯度适宜作PCR扩增。5.3.2.3PCR扩增
检测过程应同时做阳性和阴性空白对照。..1)
PCR反应体系:10×PCR缓冲液(含Mg2+)5μL,dNTP(2.5mmol/L)4μL.Taq酶(5U/μL)0.5μL10μmol/μL正义、反义引物各1uL,模板DNA0.5μg~1μg,补加双蒸水至50μL。PCR扩增参数:95℃预变性5min;95℃变性30s,52℃退火30s.72℃延伸45s,35个循环;最后72℃延伸5min。
5.3.2.4PCR扩增产物电泳检测
用TBE缓冲液制备1.5%琼脂糖凝胶,加人EB至终浓度为0.5μg/mL(也可在电泳后进行染色)。取5uLPCR扩增产物与2L上样缓冲液混合后加人点样孔进行电泳,电压5V/cm~9V/cm,20min~30min。用凝胶成像仪观察分析电泳结果。5.3.2.5结果判定
阳性对照扩增出352bp,阴性空白对照孔未见有PCR扩增条带,表明试验成立,否则应重做。试验成立,样品孔如发现有352bp大小的扩增条带,则判定检样中含有B.h,否则判为阴性;必要时可对该扩增产物作进一步的酶切鉴定或测序鉴定进行确认(PCR产物序列参见附录E)。5.3.2.6扩增产物酶切鉴定
PCR扩增若产生约352bp的核酸条带,可利用市售胶回收试剂盒回收扩增产物,再利用AflⅢ内切酶进行酶切,B.h的酶切产物片段大小为139bp、213bp。4
TTKANYKAa
附录A
(资料性附录)
疾病概述
SN/T1207—2011
A.1猪痫疾(swinedysentery、SD),又称血痫、黑痫、粘液出血性下痫,是由猪痢疾短螺旋体(Brachyspirahyodysenteriae,B.h)(以前又名猪痢疾蛇形螺旋体Serpulinahyodysenteriae,S.h,猪痢疾密螺旋体Treponemahyodysenteriae,T.h,)引起的猪特有的一种严重的肠道传染病。临床症状以消瘦、腹泻、粘液性或粘液出血性下痢为特征,病理学特征为卡他性、出血性、纤维素性或坏死性盲肠与结肠炎。SD最早报道于1921年,此后,世界多数养猪地区都报道了本病的发生,该病主要发生于生长发育期的猪,以2月龄~3月龄仔猪发病多,死亡率高,哺乳仔猪、成年猪发病较少,即或感染也不表现出典型的SD症状,猪群一旦感染本病将很难彻底根除,给世界各国的养猪生产造成较大的危害,国内外兽医界均十分重视此病的研究,在我国该病被列为我国进境动物二类检疫性传染病A.2本病主要经消化道感染,各种应激因素、阴雨潮湿、气候多变,均可促使本病发生,本病的发生无明显季节性,常呈缓慢传播,且流行持续期长,自然条件下,断奶仔猪SD的发病率可达90%,死亡率达30%,经药物预防治疗,多数病猪转为慢性,康复猪仍可在粪便中排出B.h。B.h的保菌宿主有猪、小鼠和犬等,虽然B.h是一种庆氧菌,但其具有广泛环境的适应存活能力,在湖泊、粪坑中能存活60d以上。因而保持猪舍环境卫生、做好灭鼠工作对预防本病的发生具有十分重要的作用。A.3粘液出血性腹泻是SD最典烈的症状,但不同猪只的染病程度有较大的差异,大多数自然感染病例.潜伏期在2d至2个月以上,一般为1周~2周.根据病程的不同,通常把SD分为急性、亚急性和慢性感染。急性感染病例:猪只感染本病后,开始多排稀软的粪便,随即粪中出现大量粘液和血块,呈油脂样或胶冻状,粪色为棕色、红黑色不等,随着病程的发展,病猪排便失禁,迅速消瘦,弓腰缩腹,起立无力,极度衰弱,以至死亡或转为慢性,病程在1周~2周。在猪群暴发本病之初,部分最急性病例,甚至不表现出明显症状,在儿小时内突然死广。亚急性和慢性病例:猪只粘液出血性下利时轻时重,粪便常含有均匀的黯黑色血液,俗称黑粪,病猪生长发育停滞,精神萎靡不振,部分康复猪经一定时间可复发,病程在4周以上。
A.4SD病变仅局限于大肠,小肠和其他组织器官均无特征性病变,在猪回肠结合处常见一条明显的分界线。急性期病例大肠壁和肠系膜呈充血和水肿,粘膜常被粘液和带血斑的纤维蛋白覆盖,结肠内容物质软或呈水样并含有渗出物。早期病变常出现在结肠攀顶部,随着病情的发展大肠壁的水肿程度可能减轻,但粘膜病变加重,蔓延至盲肠、整个结肠和直肠前段,粘膜表面出现广泛的浅表环死,在整个发病期都可在肠腔中和腺窝内显微镜检观察到天量的B.h。A.5对于猪痫疾的检疫,可结合流行病学、临床症状及病理解剖检验结果,对猪只是否感染本病作出初步判断·病原的确诊还需进行病原的分离培养和鉴定,传统的检验方法有大肠组织切片镜检,B.h菌株的分离培养,病原的确诊鉴定方法包括溶血试验、结肠致病性试验以及利用PCR技术检测B.h的特异核酸序列等。
TTKANYKAa
SN/T1207—2011
附录B
(资料性附录)
猪痫疾病原体图谱
图B.1结肠腺窝和上皮组织中B.h(WarthinStarry;×750)TYKANYKAa
C.1TSA基础培养基
胰陈(Trypticase)
植物蛋白陈(Phytone)
氯化钠
猪粪抽汁的制备
附录C
(规范性附录)
试剂的配制
SN/T1207—2011
猪粪抽汁:一份健康猪粪加四份PBS(0.01mol/L,pH7.2~7.4).混匀,4℃磁力搅拌20h~24h,取混合物离心(7000r/min~8000r/min,1h),吸取上清液,置一80℃保存备用C.3
3BJ培养基
TSA基础
猪粪抽汁
脱纤牛血或马血
壮观霉素
抗敌素
万古霉素
利福平
螺旋霉素
蒸馏水
200mg/L
25mg/L
校正pH7.3士0.1.分装于三角烧瓶中,100kPa~110kPa高压灭菌15min,备用。临使用前溶解培养基,待其冷却至50℃~60℃时再加人无菌采集的脱纤牛血或马血和各抗生素贮存液。抗生素存液的制备方法
壮观霉素、抗敌素、万古霉素可直接溶于灭菌蒸馏水中,用0.22um滤膜过滤除菌,置4℃冰箱保存备用。利福平、螺旋霉素则需先用适量无水乙醇溶解,然后加入无菌水,使乙醇终浓度为20%,再用细菌滤器过滤除菌。抗生素贮存液可按每1000mL培养基加1mL的比例制备。抗生素贮存液置4℃冰箱保存可使用6个月。
5PBS(0.01mol/L.pH7.2)缓冲液的配制C.5
磷酸氢二钠(NazHPO4)
磷酸二氢钾(KH,PO.)
TIKANYKACA
SN/T1207—2011
氯化钠(NaCI)
去离子水
加至1000mL
100kPa~110kPa(121℃)高压灭菌15min后备用。o0
TTKANYKAA
D.1试样处理
附录D
(规范性附录)
结肠致病性试验
SN/T1207—2011
致病性试验需采用10代以内的菌种,用接种环刮取血液琼脂平血上的菌落到灭菌生理盐水管中,振荡溶解,低速离心去琼脂,使每毫升含5.0×10个菌体。D.2口服感染试验
取健康试验猪2头,先禁食24h~48h,然后每天一次胃管投服分离菌株50mL或直接饲喂BJ培养物每次10血/头~20皿/头,连投两次,观察30d。也可用小鼠或豚鼠试验,每个菌株至少用6只,先停饲24h~48h后,每只每次灌服1mL,次日再灌服一次,15天后部检观察盲肠病变,感染后50%出现腹泻和大肠病变者,表示分离株为致病性BhD.3结肠接种试验
取健康试验猪2头,先禁食48h。全身麻醉后剖腹暴露结肠,先注人200mL~400mL灭菌生理盐水,用手将肠内容物向后推移,排空肠内容物,每隔8cm~10cm肠段,每段间隔2cm,进行双重结扎,注意不要损伤血管。一头猪视需要可结扎6个~10个肠段,能同时测定5个~9个菌株的致病性。每个肠段注人5mL菌液,另设一肠段注射5mL生理盐水作为对照。另一头接种相同菌株和菌量,但肠段部位的前后顺序与第一头相反。接种后缝合腹腔,禁食,隔3d剖检。如接种段比对照肠段明显肿胀、肠内渗出液体增多、充血显著(见图D.1),涂片镜检的病原菌形态特征与自然病例一致,则认为该菌株有致病性。B.i等螺旋体和对照肠段无上述病理变化牛理盐水对照
致病菌株发应(肠段拟液膨胀)
图D.1猪结肠结扎试验反应示意图9
SN/T 1207—2011
ACTAAAGATCbZxz.net
AAGAGCTTCT
GAATGGGTAT
TGCGGT(N)ACTC
TTCTACTGGT
AATCTAACTT
GAAGATGTTT
附录E
(资料性附录)
PCR产物测序结果
CTGATGTATT TGCTATAGGT
GAAAAACAAG AATATATTGC
TGTTGCTGCT
AAGGTTCTAA
TGGTCTGAAG
CTTCAAAGAT
TAGTAAAAAT
AATAATGCTT
TGCTATTTGT
AAACTGCTAA
TCTGAAAGAC
CATTTATGAA
GACTGTGCTA
ACTGTATATTC
TTTAGCTACTAATGCTGTAA
TAGGAAAACA TGTTGAATAT
GTATTTGGAT ACAATATGGC
GAAAAAAGGA
TTAAAAGTAA
CAGAATTTAT
GCCTACTAAT
GAAGGCAGCA GACGTTTATT
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
代替SN/T1207-2003
猪痫疾检疫技术规范
Quarantineprotocolforswinedysentery2011-05-31发布
中华人民共和国
国家质量监督检验检疫总局
2011-12-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准代替SN/T1207—2003《猪疾短螺旋体分离培养操作规程》。本标准与SN/T1207—2003相比,主要技术变化如下:增加了猪制疾临床诊断及疾病概述相关技术内容;一增加了患病猪大肠组织切片镜检操作方法内容;SN/T1207—2011
修改、完善了猪痢疾短螺旋体分离培养和鉴定方法,细化了采样方法与检测程序;-增加了猪疾短螺旋体的PCR检测鉴定方法。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国湖北出入境检验检疫局、华中农业大学本标准主要起草人:陈建军、郭明星、曾宪东、金梅林、张四喜、黄晟、冯汉利、赵晖、徐家文、张春亚本标准所代替标准的历次版本发布情况为:SN/T1207-—2003。
TIKANYKACA
1范围
猪疾检疫技术规范
SN/T1207—2011
本标准规定了猪痢疾病的临床诊断、组织切片镜检及猪疾短螺旋体分离培养和鉴定方法。本标准适用于猪痫疾病的检疫诊断规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T6682分析实验室用水规格和试验方法GB19489实验室生物安全通用要求GB/T19495.3转基因产品检测核酸提取纯化方法3缩略语
下列缩略语适用于本文件
SD(swinedysentery):猪痫疾
B.h(brachyspirahyodysenteriae):猪痢疾短螺旋体B.i(brachyspirainnocens):非致病性短螺旋体B.p(brachyspirapilosicoli):结肠菌毛样短螺旋体4临床诊断
猪只感染SD后所表现出的临床、病理症状大多较为典型,对于本病的检疫可结合猪群的流行病学、临床症状及病理解剖检验的结果对猪只是否感染本病作出初步的诊断,具体方法参见附录A。实验室诊断
5.1大肠组织切片镜检
5.1.1材料准备
器材:组织切片机、生物显微镜、染色缸、水浴锅、恒温培养箱、载玻片。5. 1.1. 1
5.1.1.2试剂:10%福尔马林、70%乙醇、95%乙醇、无水乙醇、二甲苯、切片石蜡、革兰氏染色液或姬姆萨染色液。
5.1.2样品采集与处理
检病猪,取病变大肠段(盲肠、结肠和直肠前段),冷藏送检,5.1.2.1
切取1cm左右病变大肠段样品置10%福尔马林中至少固定3h~4h1
TTKANYKAa
SN/T1207—2011
5.1.2.3取出样品用流水冲洗1h。5.1.2.4将样品依次浸39℃的95%乙醇、无水乙醇中,各脱水30min。5.1.2.5再将脱水后的样品浸入38℃的二甲苯中,透明10min~15min。5.1.2.6取透明样品依次浸入56℃的二甲苯石蜡(体积比=1:1)10min、二甲苯石蜡(体积比=1:3)20min和液体石蜡中30min~60min,进行浸蜡包埋。5.1.2.7用切片机切片,并将组织切片贴于洁净载玻片上,置56℃温箱2h3h或38℃温箱中过夜烘干,备染。
5.1.2.8取烘干切片样品依次浸人两缸二甲苯中脱蜡,各3min~5min。5.1.2.9再依次放人无水酒精、95%和70%酒精中浸泡2min~3min,取出用流水润洗。5.1.2.10用革兰氏染色液染色,干燥,再用二甲苯透明一次,用盖玻片封片备检。或以10倍稀释的姬姆萨染色液浸染脱蜡切片样品8h~24h,再迅速通过两缸无水乙醇,干燥,二甲苯透明,封片备检。5.1.3镜检
镜检观察,SD阳性病猪病料可在粘膜表面特别是在结肠腺窝内见到大量的B.h样菌体,B.h为革兰氏阴性,长6μm~8.5um,呈舒展的2~4个螺旋状,两端尖锐的蛇样菌(参见附录B)。5.2猪痫疾短螺旋体的分离培养和鉴定5.2.1材料准备
5.2.1.1器材:生物显微镜、载玻片、厌氧培养箱(罐)(20%CO2、80%H,)、离心机、灭菌注射器、手术刀、止血钳、缝合针、线、灭菌棉拭子。5.2.1.2试剂:BJ培养基、磷酸缓冲液(0.01mol/L·pH7.2PBS)(配制方法见附录C)、革兰氏染色液或姬姆萨染色液。
5.2.1.3试验动物:仔猪(15kg~25kg)或豚鼠(3周龄~4周龄)或幼小鼠(20g左右)。5.2.2病料采集处理与分离培养
5.2.2.1采集直肠或新鲜粪便拭子样品,置入装有适量PBS的灭菌试管内,密封后0℃~4℃保存送检,3d内进行分离培养检验;对于病死猪或扑杀猪,可将大肠(盲肠、结肠及直肠前段)分段两头结扎(每段10cm),分离取出,样品置4℃保存箱尽快送检,进行镜检及病原分离培养,样品保存不超过5d~7d。
5.2.2.2取少许样品抹片染色或做成悬滴标本,直接镜检.观察有无B.h样菌体及活力。5.2.2.3对于含菌量较多的病科可直接划线接种或用无菌PBS作1:10稀释后划线接种于BJ培养基平板,置厌氧培养箱中42℃培养。5.2.2.4对于临床表现不明显的以及投药治疗后的猪病料,由于含菌量少或活力减弱,需先将样品用适量PBS溶解后,低速离心除去残渣,取上清,再以6000r/min~8000r/min离心20min,进行集菌后,再取沉淀物划线接种BJ培养基平板,置厌氧培养器内42℃培养。5.2.3结果观察
每隔2d检查一次,观察有无溶血区及溶血菌落,阴性样品应至少培养6d。B.h生长能产生强β溶血区,溶血区呈条状或一端稍尖的椭圆形斑点,其菌落不明显.只在溶血区内可见一层云雾状菌苔,B.i和B.P等螺旋体呈弱β溶血,结合染色镜检结果,可初步判定猪只是否感染B.h。B.h最终判定还需进行生化鉴定或核酸序列检测,必要时通过结肠致病性试验进行鉴定(具体方法见附录D)。
TKANYKACa
5.2.4生化鉴定
SN/T 1207—2011
取溶血区内物质涂片染色镜检,如见B.h样菌体,在无杂菌的溶血区挑取一小块琼脂,接种于BJ培养基中42℃纯化培养48h,取经纯化培养的菌落进行生化鉴定。表1三种常见螺旋体的生化鉴定表试验项目
马尿酸盐水解
α-半乳糖苷酶
α-葡萄糖苷酶
β-葡萄糖苷酶
D-核糖
注:十阳性反应:一阴性反应
猪痫疾短螺旋体
5.3猪痢疾短螺旋体的PCR检测鉴定5.3.1材料准备
主要仪器
结肠菌毛样短螺旋体
非致病性短螺旋体
PCR仪、电泳仪、凝胶成像系统、高速冷冻离心机、水浴锅、移液器、核酸蛋白分析仪5.3.1.2试剂材料
除另有规定外.所有实验使用的试剂等级应为不含DNA和DNase的分析纯或生化试剂。实验用水应符合GB/T6682一级水的规格,去离子水电阻应达到18.2MQ5.3.1.3DNA提取试剂
QIAampDNAStoolMiniKit(QIA-GEN公司产品)、DNA提取缓冲液、平衡酚、三氯甲烷、异丙醇、70%乙醇、TE缓冲液等。
5.3.1.4PCR试剂
10XPCR缓冲液(含Mg2+)、dNTP溶液(2.5mmol/L)、Taq酶(5U/μL)、双蒸水。5.3.1.5引物
上游引物(BHF):5-ACTAAAGATCCTGATGTATTTG-3下游引物(BHR):5'-CTAATAAACGTCTGCTGC-31)标准给出所列产品是为了方便本标准使用者,并不表示对该产品的指定,其他同类产品具有相同效果也可采用。
TTIKANYKAC
SN/T1207—2011
5.3.1.6电泳试剂
琼脂糖、溴化乙锭、TBE缓冲液、上样缓冲液、相对分子质量Marker(DL-2000)。5.3.2检测步骤
5.3.2.1试样DNA的提取
对于分离培养的可疑菌株,其总DNA可采取酚/三氯甲烷法进行提取,提取程序参照GB/T19495.3操作。对于粪便样品可直接采用QIAampDNAStoolMiniKit直接提取总DNA,提取程序按试剂盒说明操作。
5.3.2.2DNA纯度和浓度的测定
取5LDNA溶液加双蒸水稀释到适宜体积.用核酸蛋白分析仪分别测定260nm和280nm波长吸光度值A250和A280。DNA的浓度计算见式(1):c=AXNX50/1000
式中:
CDNA浓度,单位为微克每微升(μg/μL);A260nm波长吸光度值;
N核酸稀释倍数。
当A260和A280比值在1.7~1.9之间时,核酸纯度适宜作PCR扩增。5.3.2.3PCR扩增
检测过程应同时做阳性和阴性空白对照。..1)
PCR反应体系:10×PCR缓冲液(含Mg2+)5μL,dNTP(2.5mmol/L)4μL.Taq酶(5U/μL)0.5μL10μmol/μL正义、反义引物各1uL,模板DNA0.5μg~1μg,补加双蒸水至50μL。PCR扩增参数:95℃预变性5min;95℃变性30s,52℃退火30s.72℃延伸45s,35个循环;最后72℃延伸5min。
5.3.2.4PCR扩增产物电泳检测
用TBE缓冲液制备1.5%琼脂糖凝胶,加人EB至终浓度为0.5μg/mL(也可在电泳后进行染色)。取5uLPCR扩增产物与2L上样缓冲液混合后加人点样孔进行电泳,电压5V/cm~9V/cm,20min~30min。用凝胶成像仪观察分析电泳结果。5.3.2.5结果判定
阳性对照扩增出352bp,阴性空白对照孔未见有PCR扩增条带,表明试验成立,否则应重做。试验成立,样品孔如发现有352bp大小的扩增条带,则判定检样中含有B.h,否则判为阴性;必要时可对该扩增产物作进一步的酶切鉴定或测序鉴定进行确认(PCR产物序列参见附录E)。5.3.2.6扩增产物酶切鉴定
PCR扩增若产生约352bp的核酸条带,可利用市售胶回收试剂盒回收扩增产物,再利用AflⅢ内切酶进行酶切,B.h的酶切产物片段大小为139bp、213bp。4
TTKANYKAa
附录A
(资料性附录)
疾病概述
SN/T1207—2011
A.1猪痫疾(swinedysentery、SD),又称血痫、黑痫、粘液出血性下痫,是由猪痢疾短螺旋体(Brachyspirahyodysenteriae,B.h)(以前又名猪痢疾蛇形螺旋体Serpulinahyodysenteriae,S.h,猪痢疾密螺旋体Treponemahyodysenteriae,T.h,)引起的猪特有的一种严重的肠道传染病。临床症状以消瘦、腹泻、粘液性或粘液出血性下痢为特征,病理学特征为卡他性、出血性、纤维素性或坏死性盲肠与结肠炎。SD最早报道于1921年,此后,世界多数养猪地区都报道了本病的发生,该病主要发生于生长发育期的猪,以2月龄~3月龄仔猪发病多,死亡率高,哺乳仔猪、成年猪发病较少,即或感染也不表现出典型的SD症状,猪群一旦感染本病将很难彻底根除,给世界各国的养猪生产造成较大的危害,国内外兽医界均十分重视此病的研究,在我国该病被列为我国进境动物二类检疫性传染病A.2本病主要经消化道感染,各种应激因素、阴雨潮湿、气候多变,均可促使本病发生,本病的发生无明显季节性,常呈缓慢传播,且流行持续期长,自然条件下,断奶仔猪SD的发病率可达90%,死亡率达30%,经药物预防治疗,多数病猪转为慢性,康复猪仍可在粪便中排出B.h。B.h的保菌宿主有猪、小鼠和犬等,虽然B.h是一种庆氧菌,但其具有广泛环境的适应存活能力,在湖泊、粪坑中能存活60d以上。因而保持猪舍环境卫生、做好灭鼠工作对预防本病的发生具有十分重要的作用。A.3粘液出血性腹泻是SD最典烈的症状,但不同猪只的染病程度有较大的差异,大多数自然感染病例.潜伏期在2d至2个月以上,一般为1周~2周.根据病程的不同,通常把SD分为急性、亚急性和慢性感染。急性感染病例:猪只感染本病后,开始多排稀软的粪便,随即粪中出现大量粘液和血块,呈油脂样或胶冻状,粪色为棕色、红黑色不等,随着病程的发展,病猪排便失禁,迅速消瘦,弓腰缩腹,起立无力,极度衰弱,以至死亡或转为慢性,病程在1周~2周。在猪群暴发本病之初,部分最急性病例,甚至不表现出明显症状,在儿小时内突然死广。亚急性和慢性病例:猪只粘液出血性下利时轻时重,粪便常含有均匀的黯黑色血液,俗称黑粪,病猪生长发育停滞,精神萎靡不振,部分康复猪经一定时间可复发,病程在4周以上。
A.4SD病变仅局限于大肠,小肠和其他组织器官均无特征性病变,在猪回肠结合处常见一条明显的分界线。急性期病例大肠壁和肠系膜呈充血和水肿,粘膜常被粘液和带血斑的纤维蛋白覆盖,结肠内容物质软或呈水样并含有渗出物。早期病变常出现在结肠攀顶部,随着病情的发展大肠壁的水肿程度可能减轻,但粘膜病变加重,蔓延至盲肠、整个结肠和直肠前段,粘膜表面出现广泛的浅表环死,在整个发病期都可在肠腔中和腺窝内显微镜检观察到天量的B.h。A.5对于猪痫疾的检疫,可结合流行病学、临床症状及病理解剖检验结果,对猪只是否感染本病作出初步判断·病原的确诊还需进行病原的分离培养和鉴定,传统的检验方法有大肠组织切片镜检,B.h菌株的分离培养,病原的确诊鉴定方法包括溶血试验、结肠致病性试验以及利用PCR技术检测B.h的特异核酸序列等。
TTKANYKAa
SN/T1207—2011
附录B
(资料性附录)
猪痫疾病原体图谱
图B.1结肠腺窝和上皮组织中B.h(WarthinStarry;×750)TYKANYKAa
C.1TSA基础培养基
胰陈(Trypticase)
植物蛋白陈(Phytone)
氯化钠
猪粪抽汁的制备
附录C
(规范性附录)
试剂的配制
SN/T1207—2011
猪粪抽汁:一份健康猪粪加四份PBS(0.01mol/L,pH7.2~7.4).混匀,4℃磁力搅拌20h~24h,取混合物离心(7000r/min~8000r/min,1h),吸取上清液,置一80℃保存备用C.3
3BJ培养基
TSA基础
猪粪抽汁
脱纤牛血或马血
壮观霉素
抗敌素
万古霉素
利福平
螺旋霉素
蒸馏水
200mg/L
25mg/L
校正pH7.3士0.1.分装于三角烧瓶中,100kPa~110kPa高压灭菌15min,备用。临使用前溶解培养基,待其冷却至50℃~60℃时再加人无菌采集的脱纤牛血或马血和各抗生素贮存液。抗生素存液的制备方法
壮观霉素、抗敌素、万古霉素可直接溶于灭菌蒸馏水中,用0.22um滤膜过滤除菌,置4℃冰箱保存备用。利福平、螺旋霉素则需先用适量无水乙醇溶解,然后加入无菌水,使乙醇终浓度为20%,再用细菌滤器过滤除菌。抗生素贮存液可按每1000mL培养基加1mL的比例制备。抗生素贮存液置4℃冰箱保存可使用6个月。
5PBS(0.01mol/L.pH7.2)缓冲液的配制C.5
磷酸氢二钠(NazHPO4)
磷酸二氢钾(KH,PO.)
TIKANYKACA
SN/T1207—2011
氯化钠(NaCI)
去离子水
加至1000mL
100kPa~110kPa(121℃)高压灭菌15min后备用。o0
TTKANYKAA
D.1试样处理
附录D
(规范性附录)
结肠致病性试验
SN/T1207—2011
致病性试验需采用10代以内的菌种,用接种环刮取血液琼脂平血上的菌落到灭菌生理盐水管中,振荡溶解,低速离心去琼脂,使每毫升含5.0×10个菌体。D.2口服感染试验
取健康试验猪2头,先禁食24h~48h,然后每天一次胃管投服分离菌株50mL或直接饲喂BJ培养物每次10血/头~20皿/头,连投两次,观察30d。也可用小鼠或豚鼠试验,每个菌株至少用6只,先停饲24h~48h后,每只每次灌服1mL,次日再灌服一次,15天后部检观察盲肠病变,感染后50%出现腹泻和大肠病变者,表示分离株为致病性BhD.3结肠接种试验
取健康试验猪2头,先禁食48h。全身麻醉后剖腹暴露结肠,先注人200mL~400mL灭菌生理盐水,用手将肠内容物向后推移,排空肠内容物,每隔8cm~10cm肠段,每段间隔2cm,进行双重结扎,注意不要损伤血管。一头猪视需要可结扎6个~10个肠段,能同时测定5个~9个菌株的致病性。每个肠段注人5mL菌液,另设一肠段注射5mL生理盐水作为对照。另一头接种相同菌株和菌量,但肠段部位的前后顺序与第一头相反。接种后缝合腹腔,禁食,隔3d剖检。如接种段比对照肠段明显肿胀、肠内渗出液体增多、充血显著(见图D.1),涂片镜检的病原菌形态特征与自然病例一致,则认为该菌株有致病性。B.i等螺旋体和对照肠段无上述病理变化牛理盐水对照
致病菌株发应(肠段拟液膨胀)
图D.1猪结肠结扎试验反应示意图9
SN/T 1207—2011
ACTAAAGATCbZxz.net
AAGAGCTTCT
GAATGGGTAT
TGCGGT(N)ACTC
TTCTACTGGT
AATCTAACTT
GAAGATGTTT
附录E
(资料性附录)
PCR产物测序结果
CTGATGTATT TGCTATAGGT
GAAAAACAAG AATATATTGC
TGTTGCTGCT
AAGGTTCTAA
TGGTCTGAAG
CTTCAAAGAT
TAGTAAAAAT
AATAATGCTT
TGCTATTTGT
AAACTGCTAA
TCTGAAAGAC
CATTTATGAA
GACTGTGCTA
ACTGTATATTC
TTTAGCTACTAATGCTGTAA
TAGGAAAACA TGTTGAATAT
GTATTTGGAT ACAATATGGC
GAAAAAAGGA
TTAAAAGTAA
CAGAATTTAT
GCCTACTAAT
GAAGGCAGCA GACGTTTATT
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
标准图片预览:




- 其它标准
- 热门标准
- 行业标准
- SN/T1509-2005 异尖线虫病诊断规程
- SN/T1359.2-2004 进口纺织机械检验规程 织袜机
- SN/T1395.2-2005 禽衣原体病琼脂免疫扩散试验操作规程
- SN/T0328-94 出口氟石中氟化钙的化学分析方法
- SN/T1083.1-2002 焦炭分析试样水分、灰分的快速测定
- SN/T3455-2012 植检标准样品评价通用要求
- SN/T3079.1-2012 进出口安全技术防范产品检验规程第1部分:安全防范报警设备
- SN/T4381-2015 食品接触材料纸、再生纤维材料使用改性聚苯醚测定纸和纸板迁移物的试验方法
- SN/T1443.2-2004 食品安全管理体系 审核指南
- SN0665-1997 出口肉及肉制品中雌三醇残留量检验方法放射免疫法
- SN0530-1996 出口肉中呋喃唑酮残留量的检验方法液相色谱法
- SN/T0380-1995 出口活鱼检验规程
- SN/T0877-2000 进出口发菜检验规程
- SN/T0794-1999 进出口西洋参检验规程
- SN/T0772-1999 出口真空软包装云腿片检验规程
- 行业新闻
请牢记:“bzxz.net”即是“标准下载”四个汉字汉语拼音首字母与国际顶级域名“.net”的组合。 ©2025 标准下载网 www.bzxz.net 本站邮件:bzxznet@163.com
网站备案号:湘ICP备2025141790号-2
网站备案号:湘ICP备2025141790号-2